Реакции медьорганических реагентов включают виды, содержащие связи медь-углерод, действующие как нуклеофилы в присутствии органических электрофилов. Медьорганические реагенты теперь широко используются в органическом синтезе в качестве мягких селективных нуклеофилов для реакций замещения и конъюгированного добавления.
С момента открытия, которые катализируют конъюгированное добавление реагентов Гриньяра в 1941 г. медьорганические реагенты появились как слабоосновные, нуклеофильные реагенты для реакций замещения и присоединения. Состав медьорганических соединений зависит от способа их получения, и различные виды медьорганических реагентов проявляют разные свойства. В результате диапазон реакций с участием медьорганических реагентов чрезвычайно широк.
Механизм нуклеофильное замещение органокупратами низшего порядка в значительной степени зависит от структуры субстрата, органокупрата и условий реакции. Ранние данные предполагали, что имело место прямое смещение S N 2; однако более свежие результаты предполагают, что имеет место обратное окислительное присоединение меди (I) к связи уходящей углеродной группы с образованием промежуточного соединения меди (III), которое затем подвергается восстановительному отщеплению с образованием связанного продукта. Оба эти механизма предсказывают инверсию электрофильного углерода, которая наблюдается в ряде случаев. С другой стороны, эксперименты с улавливанием радикалов и наблюдение рацемизации во время замещения предполагают радикальный механизм.
(1)

В 1941 году Хараш обнаружил что реагенты Гриньяра добавляют к циклогексенону в присутствии Cu (I), что приводит к 1,4-присоединению вместо 1,2-присоединения. Эта работа предвещала обширные исследования по добавкам конъюгатов к енонам с органокупратами. Обратите внимание, что если использовать реактив Гриньяра (например, RMgBr), реакция с еноном вместо этого будет протекать через 1,2-присоединение. Механизм 1,4-присоединения купратов к енонам проходит через нуклеофильное присоединение разновидностей Cu (I) к бета-углероду алкена с образованием промежуточного соединения Cu (III) с последующим восстановительным отщеплением Cu (I). В исходной статье, описывающей эту реакцию, метилмагнийбромид взаимодействует с изофороном с добавлением 1 мольных процентов хлорида меди (I) и без него (см. Рисунок).
![Добавление метилмагнийбромида к изофорону. [10]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/97/Coppercatalyzedenonegrignardaddition.png/400px-Coppercatalyzedenonegrignardaddition.png)
Без добавления соли основными продуктами являются спирт B(42%) от нуклеофильного присоединения к карбонильной группе и диен C(48%) в качестве его реакции дегидратации товар. С добавлением соли основным продуктом является 1,4-аддукт A (82%) с некоторым количеством C (7%).
Также возможно 1,6-присоединение, например, на одной стадии промышленного производства фулвестранта :

Реакции диастереоселективного присоединения конъюгатов хиральных органокупратов обеспечивают β-функционализированные кетоны с высоким выходом и диастереоселективностью. Недостатком этих реакций является потребность в полном эквиваленте энантиочистого исходного материала.
(3)

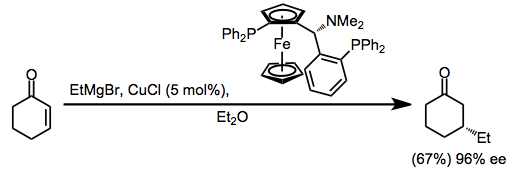
В последнее время были разработаны каталитические энантиоселективные методы, основанные на катализируемом медью (I) сопряженное присоединение реакций Гриньяра к енонам. Предлагаемый механизм включает трансметалляцию из реактива Гриньяра в медь, добавление конъюгата и определяющее скорость восстановительное элиминирование (см. Аналогичный верхний путь в уравнении (2)).
(4)
Винил и арил реагенты Гриньяра сочетаются с первичными алкилгалогенидами в присутствии каталитического количества галогенидной соли меди (I). Использование Li 2 CuCl 4 вместо простых галогенидных солей меди (I) (CuX) улучшает выходы этих реакций сочетания.
(5)

Добавление Реагенты Гриньяра для алкинов облегчаются каталитическим количеством галогенида меди. За трансметаллированием до меди и карбокупрацией следует трансметаллирование продукта алкена обратно в магний. Добавление является синхронным, если координирующая группа не находится поблизости в субстрате, и в этом случае добавление становится антикоррозийным и дает улучшение.
(6)

Пропаргилметансульфинаты являются полезными субстратами для синтеза алленов из стехиометрических медноорганических комплексов. В этом случае комплексы образовывались in situ посредством комбинации реактива Гриньяра, бромида меди (I) и бромида лития. Медноорганические комплексы очень часто требуют активации кислотой Льюиса для эффективной реакции; бромид магния, образующийся in situ, в данном случае служит в качестве активирующей кислоты Льюиса.
(7)
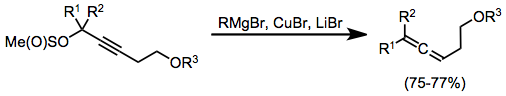
Алкенилмедные комплексы, легко образующиеся при карбокупрации, полезны для введения винильной группы в β положение карбонильного соединения. В этом случае, как указано выше, бромид магния служит в качестве активирующей кислоты Льюиса.
(8)

Эпоксид, открывающийся органокупратами, очень селективен в отношении менее затрудненного положения. Замещение происходит с полной инверсией конфигурации у электрофильного углерода.
(9)
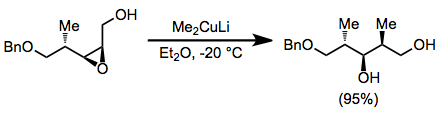
Как правило, органокупраты реагируют с аллильными электрофилами анти-S N 2 способом. В приведенной ниже реакции наблюдалась почти полная инверсия конфигурации, несмотря на присутствие второго стереоцентра в кольце.
(10)

Добавление конъюгата органокупратов широко используется в органическом синтезе. Купраты винилового эфира служат удобными эквивалентами в реакциях сопряженного присоединения к енонам. Полученные в результате енольные эфиры могут быть гидролизованы до 1,4-дикетонов, к которым трудно получить доступ с использованием традиционной химии карбонила.
(11)

Использование добавок в сочетании со стехиометрическим количеством медьорганических комплексов увеличивает скорость и выход многих реакций. В частности, медноорганические комплексы медленно реагируют в отсутствие кислоты Льюиса. Хотя бромид магния, образующийся in situ в результате реакции реактивов Гриньяра и галогенидов меди (I), может выполнять эту роль (см. Выше), также можно использовать внешние кислоты Льюиса. В присутствии эфирата трифторида бора медьорганические комплексы могут присоединяться к стерически перегруженным енонам с умеренным выходом (осуществление такого же преобразования с помощью органокупрата будет затруднено).
(12)
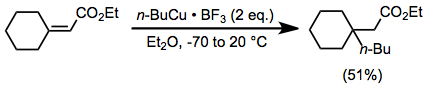
Эфират трифторида бора также полезен в качестве добавка в реакциях цианокупратов высшего порядка. Использование 2-тиенильной группы в качестве «фиктивного» заместителя в цианокупрате позволяет сохранить потенциально ценный литийорганический реагент, используемый для образования цианкупрата (поскольку в медьсодержащих побочных продуктах присутствует только фиктивная группа). В отсутствие эфирата трифторида бора в этом случае не наблюдали никакой реакции.
(13)
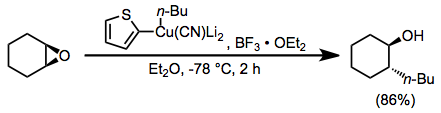
Реакции присоединения конъюгатов цианокупратов более высокого порядка представляют собой еще одно полезное применение эфирата трифторида бора. Виниловая группа переносится в этой реакции избирательно; это отличается от реакций замещения с использованием того же самого реагента, которые приводят к селективному переносу метильной группы.
(14)

Вторичные амины можно алкилировать купратами. Реакция основана на окислительном связывании литийалкил-амида меди, который, как сообщается, образуется in situ во время реакции между диалкилкупратами лития и первичными или вторичными амидами.

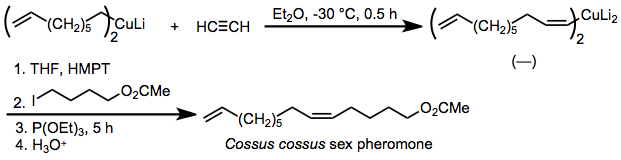
Поскольку стереоселективность карбокупрации чрезвычайно высока выше, реакция была применена для синтеза феромонов, в которых геометрическая чистота двойных связей имеет решающее значение. Одним из примеров является феромон насекомых Cossus cossus, который синтезируется путем син-селективного карбокупрации ацетилена и алкилирования полученного органокупрата в присутствии добавленного фосфита.
(15)