| Пируват карбоксилаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристаллографическая структура пируваткарбоксилазы из Rhizobium etli : домен биотинкарбоксилазы (синий); аллостерический связывающий домен (зеленый); биотин-связывающий домен (красный); и карбоксилтрансферазный домен (оранжевый) Кристаллографическая структура пируваткарбоксилазы из Rhizobium etli : домен биотинкарбоксилазы (синий); аллостерический связывающий домен (зеленый); биотин-связывающий домен (красный); и карбоксилтрансферазный домен (оранжевый) | |||||||||
| Идентификаторы | |||||||||
| ЕС нет. | 6.4.1.1 | ||||||||
| № CAS | 9014-19-1 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | Amigo / QuickGO | ||||||||
| |||||||||
| Пируват карбоксилтрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | PYR_CT | ||||||||
| Pfam | PF00682 | ||||||||
| ИнтерПро | IPR000891 | ||||||||
| ПРОФИЛЬ | PDOC50991 | ||||||||
| |||||||||
| Пируват карбоксилаза | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | ПК | ||||||
| Ген NCBI | 5091 | ||||||
| HGNC | 8636 | ||||||
| OMIM | 608786 | ||||||
| RefSeq | NM_000920 | ||||||
| UniProt | P11498 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 6.4.1.1 | ||||||
| Locus | Chr. 11 q11-q13.1 | ||||||
| |||||||
Пируваткарбоксилазу ( ПК), кодируемый геном PC является фермент из лигазы класса, который катализирует ( в зависимости от вида) физиологически необратимого карбоксилирования из пирувата с образованием оксалоацетата (OAA).
Он катализирует следующую реакцию:
Это важная анаплеротическая реакция, при которой из пирувата образуется оксалоацетат. Фермент представляет собой митохондриальный белок, содержащий простетическую группу биотина, требующую магния или марганца и ацетил-КоА.
Пируваткарбоксилаза была впервые открыта в 1959 году в Западном резервном университете Кейса М. Ф. Аттером и Д. Б. Кичем. С тех пор он был обнаружен у самых разных прокариот и эукариот, включая грибы, бактерии, растения и животных. У млекопитающих ПК играет решающую роль в глюконеогенезе и липогенезе, в биосинтезе нейромедиаторов и в индуцированной глюкозой секреции инсулина островками поджелудочной железы. Оксалоацетат, продуцируемый ПК, является важным промежуточным продуктом, который используется в этих биосинтетических путях. У млекопитающих ПК экспрессируется тканеспецифическим образом, причем его активность наиболее высока в печени и почках (глюконеогенные ткани), в жировой ткани и молочной железе (липогенные ткани), а также в островках поджелудочной железы. Активность умеренная в головном мозге, сердце и надпочечниках и меньше всего в лейкоцитах и фибробластах кожи.
Структурные исследования PC были проведены с помощью электронной микроскопии, ограниченного протеолиза, а также путем клонирования и секвенирования генов и кДНК, кодирующих фермент. Наиболее хорошо охарактеризованные формы активного ПК состоят из четырех идентичных субъединиц, расположенных в форме тетраэдра. Каждая субъединица содержит один фрагмент биотина, действующий как маятник для транспортировки диоксида углерода к каталитическому сайту, который образуется на границе раздела между соседними мономерами. Каждая субъединица функционального тетрамера содержит четыре домена: домен карбоксилирования биотина (BC), домен транскарбоксилирования (CT), домен носителя биотина карбоксила (BCCP) и недавно названный домен PC тетрамеризации (PT). Из двух наиболее полных доступных кристаллических структур были визуализированы асимметричная и симметричная формы белка. Стафилококк Staphylococcus тетрамер в комплексе с активатором коэнзим А является весьма симметричным, обладающей симметрией 222, и был подтвержден исследованиями крио-ЭМ. В отличие от Rhizobium etli, тетрамер в комплексе с этил-КоА, негидролизуемым аналогом ацетил-КоА, обладает только одной линией симметрии.
Сравнение симметрии пируваткарбоксилазы Rhizobium etli
Rhizobium etli 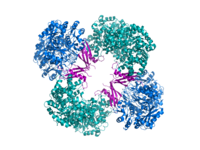 Золотистый стафилококк
Золотистый стафилококк Пируваткарбоксилаза использует ковалентно связанный кофактор биотина, который используется для катализа АТФ- зависимого карбоксилирования пирувата в оксалоацетат в две стадии. Биотин изначально карбоксилируется в активном центре BC под действием АТФ и бикарбоната. Карбоксильная группа впоследствии переносится карбоксибиотином на второй активный сайт в домене СТ, где пируват карбоксилируется с образованием оксалоацетата. Домен BCCP передает связанный кофактор между двумя удаленными активными сайтами. Сайт аллостерического связывания в ПК предлагает мишень для модификаторов активности, которые могут быть полезны при лечении ожирения или диабета II типа, а механистические выводы, полученные из полного структурного описания RePC (R. etli), позволяют проводить подробные исследования индивидуума. каталитические и регуляторные сайты фермента.
 Предлагаемый механизм пируваткарбоксилазы: ( A) АТФ-зависимое карбоксилирование биотина (домен BC); ( B) Транскарбоксилирование пирувата (домен CT).
Предлагаемый механизм пируваткарбоксилазы: ( A) АТФ-зависимое карбоксилирование биотина (домен BC); ( B) Транскарбоксилирование пирувата (домен CT). Механизм реакции можно разделить на две частичные реакции (см. Рисунок справа). В первой реакции АТФ карбоксилируется с образованием угольно-фосфорного ангидрида [ - O ( - O) P (= O) O – C (= O) O - ], который, в свою очередь, карбоксилирует кофактор биотина, ковалентно связанный с остатком лизина. домена BCCP. Углекислый фосфорный ангидрид разлагается на диоксид углерода и фосфат до того, как его атакует связанная с ферментом молекула биотина. У большинства видов для этой реакции требуется ацетил-КоА в качестве аллостерического активатора, связывающегося с доменом РТ. Во второй реакции, протекающей в домене СТ соседнего мономера, диоксид углерода переносится на молекулу акцептора, пируват, с образованием оксалоацетата. Реакция протекает через удаление протона из пирувата с помощью еще не идентифицированного остатка активного центра с образованием енолятного промежуточного соединения. Затем енолятное промежуточное соединение атакует CO 2, временно высвобождающийся из связанной с ферментом молекулы биотина. Образовавшийся оксалоацетат высвобождается. Молекула биотина протонируется указанным выше остатком активного сайта и высвобождается из активного центра домена CT, который подвергается повторному карбоксилированию. Главный регулятор активности фермента, ацетил-КоА, стимулирует расщепление АТФ в первой частичной реакции, а также, как было показано, вызывает конформационные изменения в тетрамерной структуре фермента.
Во время глюконеогенеза пируваткарбоксилаза участвует в синтезе фосфоенолпирувата (PEP) из пирувата. Пируват сначала превращается пируваткарбоксилазой в оксалоацетат (OAA) в митохондрии, требующей гидролиза одной молекулы АТФ. Затем OAA декарбоксилируется и одновременно фосфорилируется, что катализируется одной из двух изоформ фосфоенолпируваткарбоксикиназы (PEPCK) либо в цитозоле, либо в митохондриях с образованием PEP. В обычных глюконеогенных условиях OAA превращается в PEP митохондриальной PEPCK; затем полученный PEP транспортируется из митохондриального матрикса с помощью системы-переносчика анионов и превращается в глюкозу с помощью цитозольных глюконеогенных ферментов. Однако во время голодания, когда концентрация цитозольного НАДН низка, а уровни митохрондриального НАДН высоки, оксалоацетат может использоваться в качестве челнока восстанавливающих эквивалентов. Таким образом, OAA превращается в малат митохондриальной малатдегидрогеназой (MDH). После экспорта в цитозоль малат снова превращается в OAA с сопутствующим снижением NAD + ; OAA впоследствии превращается в PEP, который доступен для глюконеогенеза в цитозоле вместе с транспортируемым восстанавливающим эквивалентом NADH.
Очень высокие уровни активности ПК вместе с высокой активностью других глюконеогенных ферментов, включая PEPCK, фруктозо-1,6-бисфосфатазу и глюкозо-6-фосфатазу в печени и коре почек, предполагают, что основная роль ПК заключается в участии в глюконеогенезе. эти органы. Во время голодания или голодания, когда эндогенная глюкоза необходима для определенных тканей (головного мозга, лейкоцитов и мозгового вещества почек), экспрессия PC и других глюконеогенных ферментов повышается. Было показано, что у крыс и мышей изменение статуса питания влияет на активность ПК в печени. Голодание способствует выработке глюкозы в печени, поддерживаемой повышенным потоком пирувата, и увеличивает активность ПК и концентрацию белка; диабет аналогичным образом увеличивает глюконеогенез за счет увеличения поглощения субстрата и увеличения потока через ПК в печени у мышей и крыс. Подобно другим глюконеогенным ферментам, ПК положительно регулируется глюкагоном и глюкокортикоидами, а отрицательно регулируется инсулином. Кроме того, подтверждая ключевую роль ПК в глюконеогенезе, у молочного скота, который обладает способностью абсорбировать гексозу при адекватных уровнях питания, ПК и связанный с ним глюконеогенный фермент PEPCK заметно повышаются во время перехода к лактации в предполагаемой поддержке синтеза лактозы для производства молока.
Помимо роли ПК в глюконеогенезе, ПК выполняет анаплеротическую роль (реакция, катализируемая ферментами, которая может пополнять запасы промежуточных продуктов в цикле лимонной кислоты) для цикла трикарбоновой кислоты (необходимого для обеспечения оксалоацетата), когда промежуточные продукты удаляются для различных биосинтетические цели.
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.
[[Файл: [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]]
[[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]] [[]]  | alt = Гликолиз и глюконеогенез править ]] Гликолиз и глюконеогенез править
| alt = Гликолиз и глюконеогенез править ]] Гликолиз и глюконеогенез править Пируваткарбоксилазу аллостерически регулируется ацетил-КоА, Mg - АТФ и пирувата.
Как перекресток между углеводным и липидным метаболизмом, экспрессия пируваткарбоксилазы в глюконеогенных тканях, жировых тканях и островках поджелудочной железы должна быть скоординирована. В условиях избыточного питания уровни ПК повышаются в β-клетках поджелудочной железы, что увеличивает цикл пирувата в ответ на хронически повышенный уровень глюкозы. Напротив, уровни фермента ПК в печени снижаются инсулином ; в периоды избыточного питания ткань адипоцитов увеличивается за счет чрезмерной экспрессии PC и других липогенных ферментов. Печеночный контроль уровней глюкозы все еще регулируется при избыточном питании, но при диабете 2 типа, вызванном ожирением, регуляция периферических уровней глюкозы больше не регулируется инсулином. У крыс с диабетом 2 типа хроническое воздействие глюкозы на β-клетки из-за периферической инсулинорезистентности приводит к снижению активности фермента ПК и снижению цикла пирувата. Продолжающееся перепроизводство глюкозы гепатоцитами вызывает резкое изменение экспрессии генов в β-клетках с большим увеличением содержания глюкозы в крови. как правило, подавляются генами, и эквивалентные снижение экспрессии мРНКа для инсулина, ионные насосы, необходимыми для секреции инсулина, и метаболические ферменты, связанные с секрецией инсулина, в том числе пирувата карбоксилаза Одновременно жировая ткань развивается резистентность к инсулину вызывает накопление triaglycerols и не-этерифицированные жирные кислоты, находящиеся в обращении ; они не только еще больше ухудшают функцию β-клеток, но также еще больше снижают экспрессию PC. Эти изменения приводят к снижению фенотипа β-клеток при декомпенсированном диабете.
Дефицит пируваткарбоксилазы может вызвать молочный ацидоз в результате лактата наращивать. Обычно избыток пирувата переводится в глюконеогенез посредством преобразования пирувата в оксалоацетат, но из-за дефицита фермента избыток пирувата вместо этого превращается в лактат. Поскольку ключевая роль глюконеогенеза заключается в поддержании уровня сахара в крови, дефицит пируваткарбоксилазы также может привести к гипогликемии.