 Протеиногенные аминокислоты составляют небольшую часть всех аминокислот
Протеиногенные аминокислоты составляют небольшую часть всех аминокислот Протеиногенные аминокислоты являются аминокислотами, которые биосинтетически включаются в белки во время трансляции. Слово «протеиногенный» означает «создающий белок». На протяжении известной жизни существует 22 генетически закодированных (протеиногенных) аминокислоты, 20 в стандартном генетическом коде и еще 2, которые могут быть включены с помощью специальных механизмов трансляции.
Напротив, непротеиногенные аминокислоты представляют собой аминокислоты, которые либо не включены в белки (например, GABA, L-DOPA, или трийодтиронин ), неправильно введенные вместо генетически кодируемой аминокислоты или не продуцируемые непосредственно и изолированно с помощью стандартных клеточных механизмов (например, гидроксипролин ). Последнее часто является результатом посттрансляционной модификации белков. Некоторые непротеиногенные аминокислоты включены в нерибосомные пептиды, которые синтезируются нерибосомными пептидными синтетазами.
И эукариоты, и прокариоты могут включать селеноцистеин в свои белки через нуклеотидную последовательность, известную как элемент SECIS, который предписывает клетке транслировать ближайший кодон UGA как селеноцистеин (UGA обычно является стоп-кодоном ). У некоторых метаногенных прокариот кодон UAG (обычно стоп-кодон) также может транслироваться в пирролизин.
. У эукариот протеиногенная аминокислота всего 21 аминокислота, 20 из стандартных генетических кодов., плюс селеноцистеин. Люди могут синтезировать 12 из них друг от друга или из других молекул промежуточного метаболизма. Остальные девять необходимо употреблять (обычно в виде их белковых производных), поэтому они называются незаменимыми аминокислотами. Незаменимые аминокислоты: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин (т.е. H, I, L, K, M, F, T, W, V).
Было обнаружено, что протеиногенные аминокислоты родственны набору аминокислот, которые могут распознаваться системами аутоаминоацилирования рибозима. Таким образом, непротеиногенные аминокислоты были бы исключены из-за случайного эволюционного успеха нуклеотидных форм жизни. Были предложены и другие причины, объясняющие, почему некоторые специфические непротеиногенные аминокислоты обычно не включаются в белки; например, орнитин и гомосерин циклизуются против основы пептида и фрагментируют белок с относительно коротким периодом полураспада , в то время как другие токсичны, потому что они могут быть ошибочно включены в белки, такие как аналог аргинина канаванин.
Ниже показаны структуры и сокращения 21 аминокислоты, которые непосредственно кодируются для синтеза белка генетическим кодом эукариот. Приведенные ниже структуры являются стандартными химическими структурами, а не типичными формами цвиттериона, которые существуют в водных растворах.
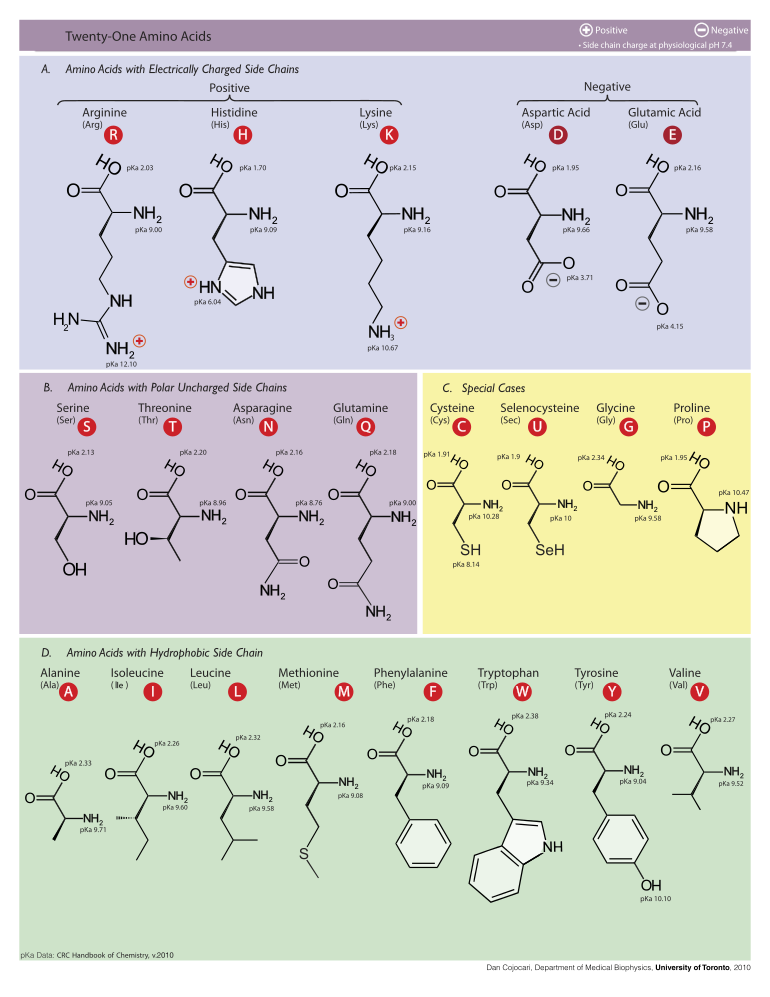 Сгруппированная таблица структуры, номенклатуры и их боковых групп 21 аминокислоты 'pKa значения
Сгруппированная таблица структуры, номенклатуры и их боковых групп 21 аминокислоты 'pKa значения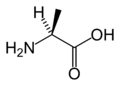
L- аланин. (Ala / A)

L-аргинин. (Arg / R)

L-Аспарагин. (Asn / N)
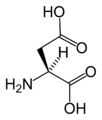
L-Аспарагиновая кислота. (Asp / D)
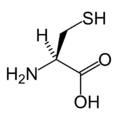
L-цистеин. (Cys / C)

L-Глутаминовая кислота. (Glu / E)

L-Глутамин. (Gln / Q)
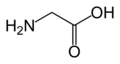
Глицин. (Gly / G)
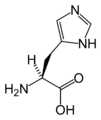
L-Histidine. (His / H)

L- Изолейцин. (Ile / I)

L-Лейцин. ( Leu / L)
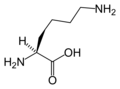
L- Лизин. (Lys / K)

L- Метионин. (Met / M)

L-Фенилаланин. (Phe / F)
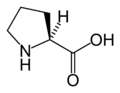
L-Пролин. (Pro / P)
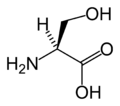
L- Серин. (Ser / S)
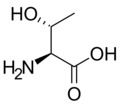
L- Треонин. (Thr / T)

L-Триптофан. (Trp / W)

L- Тирозин. (Tyr / Y)
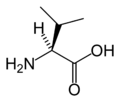
L-Valine. (Val / V)
IUPAC / IUBMB теперь также рекомендует стандартные сокращения для следующих двух аминокислот:

L- селеноцистеин. (Sec / U)
L-Pyrrolysine. (Pyl / O)
Fo Ниже представлена таблица, в которой перечислены однобуквенные символы, трехбуквенные символы и химические свойства боковых цепей стандартных аминокислот. Приведенные массы основаны на средневзвешенных значениях элементарных изотопов при их естественном содержании. Образование пептидной связи приводит к удалению молекулы воды. Следовательно, масса белка равна массе аминокислот, из которых состоит белок, минус 18,01524 Да на пептидную связь.
| Аминокислота | Короткая | Сокращенная | Средн. масса (Da ) | pI | pK 1. (α-COOH) | pK2. (α-NH 3) |
|---|---|---|---|---|---|---|
| Аланин | A | Ala | 89.09404 | 6.01 | 2.35 | 9,87 |
| Цистеин | C | Cys | 121,15404 | 5,05 | 1,92 | 10,70 |
| Аспарагиновая кислота | D | Asp | 133,10384 | 2,85 | 1,99 | 9,90 |
| Глутаминовая кислота | E | Glu | 147,13074 | 3,15 | 2,10 | 9,47 |
| Фенилаланин | F | Phe | 165,19184 | 5,49 | 2,20 | 9,31 |
| Глицин | G | Гли | 75,06714 | 6,06 | 2,35 | 9,78 |
| Гистидин | H | His | 155,15634 | 7,60 | 1,80 | 9,33 |
| Изолейцин | I | Иле | 131,17464 | 6,05 | 2,32 | 9,76 |
| Лизин | K | Лиз | 146,18934 | 9,60 | 2,16 | 9,06 |
| Лейцин | L | Leu | 131,17464 | 6,01 | 2,33 | 9,74 |
| Метионин | M | Met | 149,20784 | 5,74 | 2,13 | 9,28 |
| Аспарагин | N | Asn | 132,11904 | 5,41 | 2,14 | 8,72 |
| Пирролизин | O | Пил | 255,31 | ? | ? | ? |
| Пролин | P | Pro | 115,13194 | 6,30 | 1,95 | 10,64 |
| Глютамин | Q | Gln | 146.14594 | 5,65 | 2,17 | 9,13 |
| Аргинин | R | Arg | 174,20274 | 10,76 | 1,82 | 8,99 |
| Серин | S | Сер | 105,09344 | 5,68 | 2,19 | 9,21 |
| Треонин | T | Thr | 119,12034 | 5,60 | 2,09 | 9,10 |
| селеноцистеин | U | сек | 168,053 | 5,47 | 1,91 | 10 |
| Валин | V | Вал | 117.14784 | 6,00 | 2,39 | 9,74 |
| Триптофан | W | Trp | 204.22844 | 5,89 | 2,46 | 9,41 |
| Тирозин | Y | Тир | 181,19124 | 5,64 | 2,20 | 9,21 |
| Аминокислота | Короткая | Аббревиатура | Боковая цепь | Гидро-. фобическая | pKa | Полярный | pH | Маленький | Крошечный | Ароматический. или Алифатический | Ван-дер-Ваальс. объем (Å) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Аланин | A | Ala | -CH 3 | - | - | Алифатический | 67 | ||||
| Цистеин | C | Cys | -CH 2SH | 8,55 | кислая | - | 86 | ||||
| Аспарагиновая кислота | D | Asp | -CH 2 COOH | 3,67 | кислая | - | 91 | ||||
| Глутаминовая кислота | E | Glu | -CH 2CH2COOH | 4,25 | кислая | - | 109 | ||||
| Фенилаланин | F | Phe | -CH 2C6H5 | - | - | Ароматический | 135 | ||||
| Глицин | G | Gly | -H | - | - | - | 48 | ||||
| Гистидин | H | His | -CH 2-C3H3N2 | 6.54 | слабый основной | ароматический | 118 | ||||
| Изолейцин | I | Ile | -CH ( CH 3) CH 2CH3 | - | - | Алифатический | 124 | ||||
| Лизин | K | Lys | - (CH 2)4NH2 | 10,40 | основной | - | 135 | ||||
| Лейцин | L | Leu | -CH 2 CH (CH 3)2 | - | - | Алифатический | 124 | ||||
| Метионин | M | Met | -CH 2CH2S CH3 | - | - | Алифатический | 124 | ||||
| Аспарагин | N | Asn | -CH 2 CONH 2 | - | - | - | 96 | ||||
| Пирролизин | O | Pyl | - (CH 2)4NHCO C4H5N CH3 | ND | слабый основной | - | ? | ||||
| пролин | P | Pro | -CH 2CH2CH2- | - | - | - | 90 | ||||
| глутамин | Q | Gln | -CH 2CH2CONH 2 | - | - | - | 114 | ||||
| аргинин | R | Arg | - (CH 2)3NH-C (NH) NH 2 | 12,3 | сильно основной | - | 148 | ||||
| серин | S | Ser | -CH 2 OH | - | - | - | 73 | ||||
| Треонин | T | Thr | -CH (OH) CH 3 | - | - | - | 93 | ||||
| Селеноцистеин | U | сек | -CH 2SeH | 5,43 | кислая | - | ? | ||||
| валин | V | Val | -CH (CH 3)2 | - | - | Алифатический | 105 | ||||
| Триптофан | W | Trp | -CH 2C8H6N | - | - | Ароматический | 163 | ||||
| Тирозин | Y | Tyr | -CH 2-C6H4OH | 9,84 | слабокислый | ароматический | 141 |
§: Значения для Asp, Cys, Glu, His, Lys и Tyr были определены с использованием аминокислотного остатка, помещенного в центре пентапептида аланина. Arg взят из Pace et al. (2009). Значение Sec взято из Byun Kang (2011).
ND: Значение pKa пирролизина не сообщалось.
Примечание: Значение pKa аминокислотного остатка в небольшом пептиде обычно немного отличается, когда это внутри протеина. Расчет pKa белка иногда используется для расчета изменения значения pKa аминокислотного остатка в этой ситуации.
| Аминокислота | Короткая | Аббревиатура | Кодон (а) | Встречаемость | Важное значение ‡ у человека | |||
|---|---|---|---|---|---|---|---|---|
| в архейских белках. (%) | в бактериальных белках. (%) | в белках эукариот. (%) | Встречаемость. в человеческих белках. (%) | |||||
| Аланин | A | Ala | GCU, GCC, GCA, GCG | 8,2 | 10,06 | 7,63 | 7,01 | Нет |
| Цистеин | C | Cys | UGU, UGC | 0,98 | 0,94 | 1,76 | 2,3 | Условно |
| Аспарагиновая кислота | D | Asp | GAU, GAC | 6,21 | 5,59 | 5,4 | 4,73 | Нет |
| Глутаминовая кислота | E | Glu | GAA, GAG | 7,69 | 6,15 | 6,42 | 7,09 | Условно |
| Фенилаланин | F | Phe | UUU, UUC | 3,86 | 3,89 | 3,87 | 3,65 | Да |
| Глицин | G | Gly | GGU, GGC, GGA, GGG | 7,58 | 7,76 | 6,33 | 6,58 | Conditi в конечном итоге |
| Гистидин | H | His | CAU, CAC | 1,77 | 2,06 | 2,44 | 2,63 | Да |
| Изолейцин | I | Ile | AUU, AUC, AUA | 7,03 | 5,89 | 5,1 | 4,33 | Да |
| Лизин | K | Лиз | AAA, AAG | 5,27 | 4,68 | 5,64 | 5,72 | Да |
| Лейцин | L | Лей | UUA, UUG, CUU, CUC, CUA, CUG | 9,31 | 10,09 | 9,29 | 9,97 | Да |
| Метионин | M | Met | AUG | 2,35 | 2,38 | 2,25 | 2,13 | Да |
| Аспарагин | N | Asn | AAU, AAC | 3,68 | 3,58 | 4,28 | 3,58 | Нет |
| Пирролизин | O | Pyl | UAG * | 0 | 0 | 0 | 0 | Нет |
| Пролин | P | Pro | CCU, CCC, CCA, CCG | 4,26 | 4,61 | 5,41 | 6,31 | Нет |
| Глютамин | Q | Gln | CAA, CAG | 2,38 | 3,58 | 4,21 | 4,77 | Нет |
| Аргинин | R | Арг | CGU, CGC, CGA, CGG, AGA, AGG | 5,51 | 5,88 | 5,71 | 5,64 | Условно |
| Серин | S | Ser | UCU, UCC, UCA, UCG, AGU, AGC | 6,17 | 5,85 | 8,34 | 8,33 | Нет |
| Треонин | T | Thr | ACU, ACC, ACA, ACG | 5,44 | 5,52 | 5,56 | 5,36 | Да |
| Селеноцистеин | U | Сек | UGA ** | 0 | 0 | 0 | >0 | Нет |
| Валин | V | Вал | GUU, GUC, GUA, GUG | 7,8 | 7,27 | 6,2 | 5,96 | Да |
| Триптофан | W | Trp | UGG | 1,03 | 1,27 | 1,24 | 1,22 | Да |
| Тирозин | Y | Тир | UAU, UAC | 3,35 | 2,94 | 2,87 | 2,66 | Условно |
| Стоп-кодон † | - | Срок | UAA, UAG, UGA †† | ? | ? | ? | N / A | N / A |
* UAG обычно является стоп-кодоном янтарного цвета, но в организмах, содержащих биологические В механизм, кодируемый кластером генов pylTSBCD, будет включена аминокислота пирролизин.. ** UGA обычно является стоп-кодоном опала (или умбры), но кодирует селеноцистеин, если присутствует элемент SECIS.. † Стоп-кодон не является аминокислота, но включена для полноты картины.. †† UAG и UGA не всегда действуют как стоп-кодоны (см. выше).. ‡ Незаменимая аминокислота не может быть синтезирована в организме человека и поэтому должна поставляться в диета. Условно незаменимые аминокислоты обычно не требуются в рационе, но должны поставляться экзогенно конкретным популяциям, которые не синтезируют их в достаточных количествах.. Наличие аминокислот основано на 135 Archaea, 3775 Бактерии, 614 протеомов эукариот и протеом человека (21 006 белков) соответственно.
В масс-спектрометрии пептидов и белков, знание масс остатков Полезно. Масса пептида или белка представляет собой сумму масс остатков плюс масса воды (моноизотопная масса = 18,01056 Да; средняя масса = 18,0153 Да). Остаточные массы рассчитываются по табличным химическим формулам и атомным весам. В масс-спектрометрии ионы могут также включать один или несколько протонов (моноизотопная масса = 1,00728 Да; средняя масса = 1,0074 Да).
| Аминокислота | Короткая | Аббревиатура | Формула | Понедельник. масса §(Da ) | Сред. масса (Da ) |
|---|---|---|---|---|---|
| Аланин | A | Ala | C3H5NO | 71.03711 | 71.0779 |
| Цистеин | C | Cys | C3H5БДУ | 103.00919 | 103,1429 |
| аспарагиновая кислота | D | Asp | C4H5NO3 | 115.02694 | 115.0874 |
| глутаминовая кислота | E | Glu | C5H7NO3 | 129.04259 | 129.1140 |
| фенилаланин | F | Phe | C9H9NO | 147.06841 | 147.1739 |
| Глицин | G | Gly | C2H3NO | 57.02146 | 57.0513 |
| Гистидин | H | His | C6H7N3O | 137.05891 | 137.1393 |
| Изолейцин | I | Ile | C6H11NO | 113.08406 | 113.1576 |
| Лизин | K | Lys | C6H12N2O | 128.09496 | 128.1723 |
| Лейцин | L | Leu | C6H11NO | 113.08406 | 113.1576 |
| Метионин | M | Met | C5H9БДУ | 131.04049 | 131.1961 |
| Аспарагин | N | Asn | C4H6N2O2 | 114.04293 | 114.1026 |
| Пирролизин | O | Pyl | C12H19N3O2 | 237.14773 | 237.2982 |
| Пролин | P | Pro | C5H7NO | 97.05276 | 97.1152 |
| Глютамин | Q | Gln | C5H8N2O2 | 128.05858 | 128.1292 |
| Аргинин | R | Арг | C6H12N4O | 156.10111 | 156.1857 |
| Серин | S | Сер | C3H5NO2 | 87.03203 | 87.0773 |
| Треонин | T | Thr | C4H7NO2 | 101.04768 | 101.1039 |
| Селеноцистеин | U | Сек | C3H5NOSe | 150.95364 | 150.0489 |
| Валин | V | Val | C5H9NO | 99.06841 | 99.1311 |
| Триптофан | W | Trp | C11H10N2O | 186.07931 | 186.2099 |
| Тирозин | Y | Тир | C9H9NO2 | 163.06333 | 163.1733 |
В таблице ниже перечислены изобилие аминокислот в клетках E.coli и метаболические затраты (АТФ) на синтез аминокислот. Отрицательные числа указывают на то, что метаболические процессы являются энергетически благоприятными и не требуют затрат АТФ клетки. Обилие аминокислот включает аминокислоты в свободной форме и в форме полимеризации (белки).
| Аминокислота | Короткая | Аббревиатура | Изобилие. (количество молекул (× 10). на клетку E.coli ) | Стоимость АТФ в синтезе | |
|---|---|---|---|---|---|
| Аэробные. условия | Анаэробные. условия | ||||
| Аланин | A | Ala | 2,9 | -1 | 1 |
| Цистеин | C | Cys | 0,52 | 11 | 15 |
| Аспарагиновая кислота | D | Asp | 1,4 | 0 | 2 |
| Глутаминовая кислота | E | Glu | 1,5 | -7 | -1 |
| Фенилаланин | F | Phe | 1,1 | -6 | 2 |
| Глицин | G | Гли | 3,5 | -2 | 2 |
| Гистидин | H | His | 0,54 | 1 | 7 |
| Изолейцин | I | Иле | 1,7 | 7 | 11 |
| Лизин | K | Лиз | 2,0 | 5 | 9 |
| Лейцин | L | Лей | 2,6 | -9 | 1 |
| Метионин | M | Met | 0,88 | 21 | 23 |
| Аспарагин | N | Asn | 1,4 | 3 | 5 |
| Пирролизин | O | Пил | - | - | - |
| пролин | P | Pro | 1,3 | -2 | 4 |
| Глутамин | Q | Gln | 1,5 | -6 | 0 |
| Аргинин | R | Arg | 1,7 | 5 | 13 |
| Серин | S | Сер | 1,2 | -2 | 2 |
| Треонин | T | Th r | 1,5 | 6 | 8 |
| Селеноцистеин | U | сек | - | - | - |
| Валин | V | Val | 2,4 | -2 | 2 |
| Триптофан | W | Trp | 0,33 | -7 | 7 |
| Тирозин | Y | Тир | 0,79 | -8 | 2 |
| Аминокислота | Аббревиатура | Примечания | |
|---|---|---|---|
| Аланин | A | Ala | Очень распространен и очень универсален, он более жесткий, чем глицин, но достаточно мал, чтобы устанавливать лишь небольшие стерические пределы для конформации белка. Он ведет себя довольно нейтрально и может располагаться как в гидрофильных областях белка снаружи, так и в гидрофобных областях внутри. |
| Аспарагин или аспарагиновая кислота | B | Asx | Заполнитель, когда любая аминокислота может занимать положение |
| Цистеин | C | Cys | Атом серы легко связывается с ионами тяжелых металлов. В окислительных условиях два цистеина могут соединяться вместе дисульфидной связью с образованием аминокислоты цистина. Когда цистины являются частью белка, например, инсулина, третичная структура стабилизируется, что делает белок более устойчивым к денатурации ; поэтому дисульфидные связи являются обычным явлением в белках, которые должны функционировать в суровых условиях, включая пищеварительные ферменты (например, пепсин и химотрипсин ) и структурные белки (например, кератин ). Дисульфиды также обнаруживаются в пептидах, слишком малых для того, чтобы самостоятельно сохранять стабильную форму (например, инсулин ). |
| Аспарагиновая кислота | D | Asp | Asp ведет себя так же, как глутаминовая кислота, и несет гидрофильную кислотную группу с сильным отрицательным зарядом. Обычно он расположен на внешней поверхности белка, что делает его водорастворимым. Он связывается с положительно заряженными молекулами и ионами и часто используется в ферментах для фиксации иона металла. Находясь внутри белка, аспартат и глутамат обычно сочетаются с аргинином и лизином. |
| Глутаминовая кислота | E | Glu | Glu ведет себя так же, как аспарагиновая кислота, и имеет более длинную, немного более гибкую боковую цепь. |
| Фенилаланин | F | Phe | Необходимые для человека фенилаланин, тирозин и триптофан содержат большую жесткую ароматическую группу в боковой цепи. Это самые большие аминокислоты. Подобно изолейцину, лейцину и валину, они гидрофобны и имеют тенденцию ориентироваться внутрь свернутой белковой молекулы. Фенилаланин может превращаться в тирозин. |
| Глицин | G | Gly | Из-за наличия двух атомов водорода у α-углерода глицин не оптически активен. Это самая маленькая аминокислота, она легко вращается и добавляет гибкости белковой цепи. Он может поместиться в самые тесные пространства, например, в тройную спираль коллагена. Поскольку слишком большая гибкость обычно нежелательна, в качестве структурного компонента он встречается реже, чем аланин. |
| Гистидин | H | Его | Его необходим для людей. Даже в слабокислых условиях происходит протонирование азота, изменяющее свойства гистидина и полипептида в целом. Он используется многими белками как регуляторный механизм, изменяя конформацию и поведение полипептида в кислых областях, таких как поздняя эндосома или лизосома, обеспечивая изменение конформации ферментов. Однако для этого требуется всего несколько гистидинов, поэтому его относительно мало. |
| Изолейцин | I | Иле | Иле необходим для человека. Изолейцин, лейцин и валин имеют большие алифатические гидрофобные боковые цепи. Их молекулы жесткие, и их взаимные гидрофобные взаимодействия важны для правильной укладки белков, поскольку эти цепи имеют тенденцию располагаться внутри молекулы белка. |
| Лейцин или изолейцин | J | Xle | Заполнитель, когда любая аминокислота может занимать позицию |
| Лизин | K | Lys | Lys необходим для человека и ведет себя аналогично аргинину. Он содержит длинную гибкую боковую цепь с положительно заряженным концом. Гибкость цепи делает лизин и аргинин подходящими для связывания с молекулами со многими отрицательными зарядами на их поверхности. Например, ДНК -связывающие белки имеют свои активные области, богатые аргинином и лизином. Сильный заряд делает эти две аминокислоты склонными располагаться на внешних гидрофильных поверхностях белков; когда они обнаруживаются внутри, они обычно сочетаются с соответствующей отрицательно заряженной аминокислотой, например, аспартатом или глутаматом. |
| Лейцин | L | Leu | Leu необходим для человека и ведет себя аналогично изолейцину и валину. |
| Метионин | M | Мет | Мет необходим для человека. Всегда первая аминокислота, которая включается в белок, иногда ее удаляют после трансляции. Как и цистеин, он содержит серу, но с метильной группой вместо водорода. Эта метильная группа может быть активирована и используется во многих реакциях, когда новый атом углерода добавляется к другой молекуле. |
| Аспарагин | N | Asn | Подобно аспарагиновой кислоте, Asn содержит амидную группу, где Asp имеет карбоксил. |
| пирролизин | O | Pyl | Подобен лизину, но к нему присоединено кольцо пирролина. |
| Proline | P | Pro | Pro содержит необычное кольцо для N-концевой аминогруппы, которое заставляет амидную последовательность CO-NH принимать фиксированную конформацию. Он может разрушать структуры сворачивания белка, такие как α-спираль или β-лист, вызывая желаемый излом в белковой цепи. Распространенный в коллагене, он часто подвергается посттрансляционной модификации до гидроксипролина. |
| глутамина | Q | Gln | Подобно глутаминовой кислоте, Gln содержит амидная группа, где Glu имеет карбоксил. Используется в белках и в качестве хранилища аммиака, это самая распространенная аминокислота в организме. |
| Аргинин | R | Arg | Функционально подобен лизину. |
| Серин | S | Сер | Серин и треонин имеют короткую группу, оканчивающуюся гидроксильной группой. Его водород легко удалить, поэтому серин и треонин часто действуют как доноры водорода в ферментах. Оба они очень гидрофильны, поэтому внешние области растворимых белков, как правило, богаты ими. |
| Треонин | T | Thr | Необходим для человека, Thr ведет себя аналогично серину. |
| Селеноцистеин | U | Sec | селен аналог цистеина, в котором селен заменяет атом серы. |
| Валин | V | Вал | Важен для людей, Вал ведет себя аналогично изолейцину и лейцину. |
| Триптофан | W | Trp | Необходим для человека, Trp ведет себя аналогично фенилаланину и тирозину. Это предшественник серотонина и естественно флуоресцентный. |
| Неизвестно | X | Xaa | Заполнитель, когда аминокислота неизвестна или не важна. |
| Тирозин | Y | Tyr | Tyr ведет себя аналогично фенилаланину (предшественнику тирозина) и триптофану и является предшественником меланина, эпинефрина и гормоны щитовидной железы. Естественно флуоресцентный, его флуоресценция обычно гасится передачей энергии триптофанам. |
| Глутаминовая кислота или глутамин | Z | Glx | Заполнитель, когда любая аминокислота может занимать положение |
 Катаболизм аминокислот
Катаболизм аминокислот Аминокислоты могут быть классифицируются в соответствии со свойствами своих основных продуктов:
| На Wikimedia Commons есть носители, связанные с протеиногенными аминокислотами. |