 Масс-спектрометр, используемый для высокопроизводительного анализа белка.
Масс-спектрометр, используемый для высокопроизводительного анализа белка. Масс-спектрометрия белка относится к применению масс-спектрометрия к изучению белков. Масс-спектрометрия - важный метод точного определения массы и характеристики белков, и для его многочисленных применений были разработаны различные методы и приборы. Его приложения включают идентификацию белков и их посттрансляционных модификаций, выяснение белковых комплексов, их субъединиц и функциональных взаимодействий, а также глобальное измерение белков в протеомике. Его также можно использовать для локализации белков в различных органеллах и определения взаимодействий между различными белками, а также с липидами мембран.
Два основных метода, используемых для ионизации белка в масс-спектрометрии: ионизация электрораспылением (ESI) и лазерная десорбция / ионизация с использованием матрицы (MALDI). Эти методы ионизации используются вместе с масс-анализаторами, такими как тандемная масс-спектрометрия. Как правило, белок анализируется либо методом «сверху вниз », при котором белки анализируются неповрежденными, либо методом «снизу вверх », при котором белок сначала переваривается в фрагменты. Иногда также может использоваться промежуточный подход «середины вниз», в котором анализируются более крупные пептидные фрагменты.
Применение масс-спектрометрии для изучения белков стало популярным в 1980-е годы после разработки MALDI и ESI. Эти методы ионизации сыграли важную роль в характеристике белков. (MALDI) Матричная лазерная десорбционная ионизация была изобретена в конце 80-х годов Францем Хилленкампом и Майклом Карасом. Хилленкамп, Карас и их коллеги-исследователи смогли ионизировать аминокислоту аланин, смешав ее с аминокислотой триптофаном и облучив импульсным лазером с длиной волны 266 нм. Несмотря на важность, прорыв произошел только в 1987 году. В 1987 году Коичи Танака использовал метод «ультратонкий металл плюс жидкая матрица» и ионизированные биомолекулы размером 34 472 Да, протеин карбоксипептидаза-A.
В 1968 году Малкольм Доул сообщил о первом применении ионизации электрораспылением с масс-спектрометрией. Примерно в то же время, когда MALDI стала популярной, Джон Беннетт Фенн был назван за разработку ионизации электрораспылением. Коичи Танака получил Нобелевскую премию по химии в 2002 г. вместе с Джоном Фенном, а Курт Вютрих «за разработку методов идентификации и анализа структуры биологических макромолекул». Эти методы ионизации значительно облегчили изучение белков с помощью масс-спектрометрии. Следовательно, масс-спектрометрия белков теперь играет ведущую роль в характеристике белков.
Масс-спектрометрия белков требует, чтобы белки в растворе или твердом состоянии переводились в ионизированную форму в газовой фазе перед их введением и ускоряется в электрическом или магнитном поле для анализа. Двумя основными методами ионизации белков являются ионизация электрораспылением (ESI) и лазерная десорбция / ионизация с использованием матрицы (MALDI). В электроспрее ионы создаются из белков в растворе, и это позволяет хрупким молекулам ионизироваться в целости и сохранности, иногда сохраняя нековалентные взаимодействия. В MALDI белки встроены в матрицу, обычно в твердой форме, а ионы создаются импульсами лазерного света. Электрораспыление производит больше многозарядных ионов, чем MALDI, что позволяет измерять белки с высокой массой и улучшать фрагментацию для идентификации, в то время как MALDI работает быстро и с меньшей вероятностью подвержен влиянию загрязняющих веществ, буферов и добавок.
Масса цельного белка Анализ в первую очередь проводится с использованием либо времяпролетной (TOF) МС, либо ионно-циклотронного резонанса с преобразованием Фурье (FT-ICR). Эти два типа приборов здесь предпочтительны из-за их широкого диапазона масс, а в случае FT-ICR - его высокой точности измерения массы. Ионизация белка электрораспылением часто приводит к образованию нескольких заряженных частиц инструментов с ионной ловушкой с 800 < м / гц < 2000 and the resultant spectrum can be deconvoluted to determine the protein's average mass to within 50 ppm or better using TOF or .
Массовый анализ протеолитических пептидов - популярный метод характеристики белков, поскольку для характеристики можно использовать более дешевые конструкции приборов. Кроме того, подготовка образцов становится проще, когда целые белки перевариваются на более мелкие пептидные фрагменты. Наиболее широко используемым инструментом для анализа пептидной массы являются инструменты MALDI-TOF, поскольку они позволяют получать отпечатки пептидной массы (PMF) с высокой скоростью (1 PMF может быть проанализирован примерно за 10 секунд). Многоступенчатая квадрупольная времяпролетная ловушка и квадрупольная ионная ловушка также находят применение в этом приложении.
 Хроматографические кривые и спектры МС / МС пептида.
Хроматографические кривые и спектры МС / МС пептида. Тандемная масс-спектрометрия (МС / МС) используется для измерения спектров фрагментации и идентификации белков с высокой скоростью и точностью. Диссоциация, вызванная столкновением, используется в основных приложениях для создания набора фрагментов из определенного пептидного иона. Процесс фрагментации в первую очередь приводит к образованию продуктов расщепления, которые разрываются по пептидным связям. Из-за этой простоты фрагментации можно использовать наблюдаемые массы фрагментов для сопоставления с базой данных предсказанных масс для одной из многих заданных пептидных последовательностей. Тандемная МС ионов цельного белка была недавно исследована с использованием диссоциации с захватом электронов и продемонстрировала обширную информацию о последовательности в принципе, но это не является обычной практикой.
В соответствии с характеристиками и диапазоном масс доступных масс-спектрометров, для характеристики белков используются два подхода. В первом случае интактные белки ионизируются любым из двух описанных выше методов, а затем вводятся в масс-анализатор. Этот подход называется стратегией анализа белка «сверху вниз », поскольку он включает в себя начало всей массы и последующее ее разделение. Однако нисходящий подход в основном ограничивается низкопроизводительными исследованиями отдельных белков из-за проблем, связанных с обработкой целых белков, их неоднородностью и сложностью их анализа.
Во втором подходе, называемом «восходящий » МС, белки ферментативно расщепляются до более мелких пептидов с использованием протеазы, такой как трипсин. Затем эти пептиды вводят в масс-спектрометр и идентифицируют с помощью масс-спектрометрии пептидов или тандемной масс-спектрометрии. Следовательно, этот подход использует идентификацию на уровне пептидов, чтобы сделать вывод о существовании белков, собранных вместе, с обнаружением повторов de novo. Более мелкие и более однородные фрагменты легче анализировать, чем интактные белки, и их также можно определить с высокой точностью, поэтому этот подход «снизу вверх» является предпочтительным методом исследований в протеомике. Еще одним подходом, который начинает применяться, является промежуточный подход «середины вниз», при котором анализируются протеолитические пептиды, размер которых превышает размер типичных триптических пептидов.
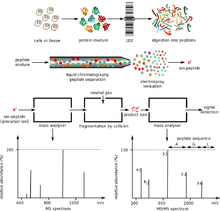 Протокол масс-спектрометрии
Протокол масс-спектрометрии Представляющие интерес белки обычно являются частью сложной смеси множества белков и молекул, сосуществующих в биологической среде. Это создает две важные проблемы. Во-первых, два метода ионизации, используемые для больших молекул, работают хорошо только тогда, когда смесь содержит примерно равные количества материала, тогда как в биологических образцах разные белки, как правило, присутствуют в сильно различающихся количествах. Если такая смесь ионизируется с использованием электроспрея или MALDI, более распространенные виды имеют тенденцию «заглушать» или подавлять сигналы от менее распространенных. Во-вторых, масс-спектр сложной смеси очень сложно интерпретировать из-за огромного количества компонентов смеси. Это усугубляется тем фактом, что ферментативное расщепление белка приводит к образованию большого количества пептидных продуктов.
В свете этих проблем для разделения белков широко используются методы одно- и двумерного гель-электрофореза и высокоэффективной жидкостной хроматографии. В первом способе целые белки фракционируются с помощью двумерного гель-электрофореза. Первое измерение 2D-геля - это изоэлектрическая фокусировка (IEF). В этом измерении белок разделен его изоэлектрической точкой (pI), а вторым измерением является электрофорез в SDS-полиакриламидном геле (SDS-PAGE). Этот размер разделяет белок в соответствии с его молекулярной массой. После завершения этого этапа происходит расщепление в геле. В некоторых ситуациях может потребоваться сочетание обоих этих методов. Пятна геля, обнаруженные на 2D-геле, обычно связаны с одним белком. Если требуется идентичность белка, обычно применяется метод расщепления в геле, когда интересующее белок пятно вырезается и протеолитически переваривается. Массы пептидов, полученные в результате расщепления, можно определить масс-спектрометрией с использованием массового снятия отпечатков пальцев. Если эта информация не позволяет однозначно идентифицировать белок, его пептиды могут быть подвергнуты тандемной масс-спектрометрии для секвенирования de novo. Небольшие изменения массы и заряда можно обнаружить с помощью 2D-PAGE. Недостатками этого метода являются его небольшой динамический диапазон по сравнению с другими методами, некоторые белки по-прежнему трудно разделить из-за их кислотности, основности, гидрофобности и размера (слишком большого или слишком малого).
Второй метод, высокоэффективная жидкостная хроматография используется для фракционирования пептидов после ферментативного расщепления. Определение характеристик белковых смесей с помощью ВЭЖХ / МС также называется протеомикой дробовика и MuDPIT (технология многомерной идентификации белков). Пептидную смесь, полученную в результате переваривания белковой смеси, фракционируют с помощью одной или двух стадий жидкостной хроматографии. Элюент со стадии хроматографии может быть либо непосредственно введен в масс-спектрометр посредством ионизации электрораспылением, либо нанесен на серию небольших пятен для последующего масс-анализа с использованием MALDI.
Существует два основных способа использования МС для идентификации белков. Массовый фингерпринт пептидов использует массы протеолитических пептидов в качестве входных данных для поиска в базе данных предсказанных масс, которые могут возникнуть в результате переваривания списка известных белков. Если последовательность белка в справочном списке дает значительное количество предсказанных масс, которые соответствуют экспериментальным значениям, есть некоторые свидетельства того, что этот белок присутствовал в исходном образце. Таким образом, этапы очистки ограничивают возможности метода массового снятия отпечатков пептидов. Фингерпринтинг пептидных масс может быть получен с помощью МС / МС.
МС также является предпочтительным методом для идентификации посттрансляционных модификаций в белках, поскольку он более выгоден, чем другие подходы, такие как Методы на основе антител.
Секвенирование пептида de novo для масс-спектрометрии обычно проводят без предварительного знания аминокислотной последовательности. Это процесс определения аминокислот из пептида фрагмента масс белка. Секвенирование de novo оказалось успешным для подтверждения и расширения результатов поиска в базе данных.
Поскольку секвенирование de novo основано на массе и некоторые аминокислоты имеют идентичные массы (например, лейцин и изолейцин ), точное ручное секвенирование может быть затруднено. Следовательно, может быть необходимо использовать приложение поиска гомологии последовательностей для работы в тандеме между поиском в базе данных и секвенированием de novo, чтобы устранить это внутреннее ограничение.
Поиск в базе данных имеет преимущество быстрого определения последовательностей, если они уже задокументированы в базе данных. Другие неотъемлемые ограничения поиска в базе данных включают модификации / мутации последовательностей (некоторые поиски в базе данных не учитывают адекватным образом изменения в «документированной» последовательности, поэтому может упустить ценную информацию), неизвестность (если последовательность не задокументирована, она не будет найдена.), ложных срабатываний, а также неполных и искаженных данных.
Аннотированная спектральная библиотека пептидов также может использоваться в качестве эталона для идентификации белков / пептидов. Он предлагает уникальную силу сокращенного пространства поиска и повышенной специфичности. Ограничения включают в себя то, что спектры, не включенные в библиотеку, не будут идентифицированы, спектры, собранные с разных типов масс-спектрометров, могут иметь довольно разные характеристики, а эталонные спектры в библиотеке могут содержать пики шума, что может привести к ложноположительной идентификации. Был описан ряд различных алгоритмических подходов для идентификации пептидов и белков с помощью тандемной масс-спектрометрии (MS / MS), секвенирования пептидов de novo и поиска на основе тегов последовательности.
 Количественная масс-спектрометрия.
Количественная масс-спектрометрия. Множественные методы позволяют проводить количественное определение белков с помощью масс-спектрометрии (количественная протеомика ), а недавние достижения позволили количественно определить тысячи белков в отдельных клетках. Как правило, стабильные (например, нерадиоактивные) более тяжелые изотопы углерода (C) или азота (N) включаются в один образец, в то время как другой помечен с соответствующими легкими изотопами (например, C и N). Два образца смешивают перед анализом. Пептиды, полученные из разных образцов, можно различить по разнице в массе. Отношение интенсивностей их пиков соответствует относительному содержанию пептидов (и белков). Наиболее популярными методами изотопного мечения являются SILAC (мечение стабильных изотопов аминокислотами в культуре клеток), O-мечение, катализируемое трипсином, ICAT (аффинное мечение с изотопным кодом), iTRAQ (изобарические метки для относительного и абсолютного количественного определения). «Полуколичественная» масс-спектрометрия может выполняться без маркировки образцов. Обычно это делается с помощью анализа MALDI (в линейном режиме). Интенсивность пика или площадь пика отдельных молекул (обычно белков) здесь коррелирует с количеством белка в образце. Однако индивидуальный сигнал зависит от первичной структуры белка, сложности образца и настроек прибора. Другие типы количественной масс-спектрометрии «без метки» используют спектральные подсчеты (или количества пептидов) расщепленных белков в качестве средства для определения относительных количеств белка.
Показательные характеристики 3-мерной структуры белков можно исследовать с помощью масс-спектрометрии различными способами. Используя химическое сшивание для соединения частей белка, которые расположены близко в пространстве, но далеко друг от друга по порядку, можно получить информацию об общей структуре. Следуя обмену амидных протонов на дейтерий из растворителя, можно исследовать доступность растворителя для различных частей белка. Водород-дейтериевый обмен масс-спектрометрия используется для изучения белков и их конформаций более 20 лет. Этот тип структурного анализа белков может быть подходящим для белков, которые сложно использовать другими структурными методами. Еще одно интересное направление исследований структуры белков - ковалентное мечение, индуцированное лазером. В этом методе открытые для растворителя участки белка модифицируются гидроксильными радикалами. Его комбинация с быстрым перемешиванием использовалась в исследованиях фолдинга белков.
В том, что сейчас обычно называют протеогеномикой, пептиды, идентифицированные с помощью масс-спектрометрии используются для улучшения аннотаций генов (например, стартовых сайтов генов) и аннотаций белков. Параллельный анализ генома и протеома облегчает обнаружение посттрансляционных модификаций и протеолитических событий, особенно при сравнении нескольких видов.