 | |
| Имена | |
|---|---|
| Название ИЮПАК Плутоний (IV) оксид | |
| Систематическое название ИЮПАК Оксид плутония (4+) | |
| Другие названия Диоксид плутония | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.031.840 |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБАЕТСЯ
| |
| Свойства | |
| Химическая формула | O2Pu |
| Молярная масса | 276 г · моль |
| Внешний вид | Темно-желтые кристаллы |
| Плотность | 11,5 г см |
| Точка плавления | 2744 ° C (4971 ° F; 3017 K) |
| Точка кипения | 2800 ° C (5070 ° F; 3070 K) |
| Структура | |
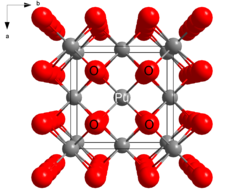
| Кристаллическая структура | Флюорит (кубический), cF12 |
| Пространственная группа | Fm3м, № 225 |
| Координационная геометрия | Тетраэдр (O); кубический (Pu) |
| Опасности | |
| Главная хаза rds | Радиоактивный |
| NFPA 704 (огненный алмаз) |  0 4 0 4 |
| Температура вспышки | негорючий |
| Если не указано иное, данные для материалов приведены в их стандарте состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Справочная информация в ink | |
Оксид плутония (IV) представляет собой химическое соединение с формулой PuO 2. Это твердое вещество с высокой температурой плавления является основным соединением плутония. Цвет может варьироваться от желтого до оливково-зеленого, в зависимости от размера частиц, температуры и метода производства.
PuO 2 кристаллизуется в мотиве флюорита с центры Pu, организованные в виде гранецентрированной кубической матрицы, и оксидные ионы, занимающие тетраэдрические дырки. PuO 2 обязан своей полезностью в качестве ядерного топлива тому факту, что вакансии в октаэдрических отверстиях оставляют место для продуктов деления. При делении ядра один атом плутония распадается на два. Вакансия октаэдрических отверстий обеспечивает место для нового продукта и позволяет монолиту PuO 2 сохранить свою структурную целостность.
Диоксид плутония - стабильный керамический материал с чрезвычайно низкой растворимостью в воде и высокой температурой плавления (2744 ° C). Температура плавления была повышена в 2011 году на несколько сотен градусов на основании данных исследований быстрого лазерного плавления, которые позволяют избежать загрязнения любым материалом контейнера.
Из-за радиоактивного альфа-распада плутония, PuO 2 теплый на ощупь. Как и все соединения плутония, он подлежит контролю в соответствии с Договором о нераспространении ядерного оружия.
Металлический плутоний спонтанно окисляется до PuO 2 в атмосфере кислорода. Диоксид плутония в основном производится прокаливанием оксалата плутония (IV), Pu (C 2O4)2· 6H 2 O, при 300 ° C.Оксалат плутония получают в течение переработка ядерного топлива по мере растворения плутония в HNO 3 / HF. Диоксид плутония также может быть извлечен из реакторов-размножителей с расплавом солей путем добавления карбоната натрия к топливной соли после удаления любого оставшегося урана из соли в виде его гексафторида.
 Таблетка PuO 2 светится от распада изотопа плутония-238, она содержит
Таблетка PuO 2 светится от распада изотопа плутония-238, она содержит PuO 2 вместе с UO2 используется в МОКС-топливе для ядерных реакторов. Диоксид плутония-238 используется в качестве топлива для нескольких космических кораблей дальнего космоса, таких как зонд Плутона «New Horizons», а также марсоход Curiosity на Марсе. Изотоп распадается, испуская α-частицы, которые затем выделяют тепло (см. радиоизотопный термоэлектрический генератор ). Существовали опасения, что случайное повторное попадание y в атмосферу Земли с орбиты может привести к разрушению и / или сгоранию космического корабля, что приведет к рассеянию плутония либо по большой площади поверхности планеты, либо в верхних слоях атмосферы. Однако, хотя по крайней мере два космических корабля с РИТЭГами из PuO 2 повторно вошли в атмосферу Земли и сгорели (Nimbus B-1 в мае 1968 года и лунный модуль Apollo 13 в апреле 1970 года), РИТЭГи обоих космических кораблей выдержали вход в атмосферу и не пострадали от удара, и ни в одном случае не было отмечено загрязнения окружающей среды; в любом случае, с середины 1960-х годов РИТЭГи проектировались таким образом, чтобы они оставались неповрежденными в случае входа в атмосферу и удара, после неудачного запуска в 1964 году Транзита 5-БН-3 (плутоний-металлический плутоний раннего поколения). РИТЭГ на борту распался при входе в атмосферу и выбросил радиоактивный материал в атмосферу к северу от Мадагаскара, что привело к изменению конструкции всех американских РИТЭГов, которые в то время использовались или находились в разработке. предложение Теда Тейлора продемонстрировало, что маломощное (1- килотонна ) ядерное оружие можно относительно легко изготовить из оксида плутония. Бомба из оксида плутония имела бы значительно большую критическую массу, чем бомба из металлического плутония (почти в три раза больше, даже с оксидом с максимальной кристаллической плотностью; если бы оксид был в форме порошка, как это часто бывает критическая масса будет намного выше) как из-за более низкой плотности плутония в PuO 2 по сравнению с металлическим плутонием, так и из-за добавленной инертной массы содержащегося кислорода.
Поведение оксида плутония в организме зависит от того, каким образом он попадает в организм. Поскольку он нерастворим, при проглатывании очень большой процент его довольно быстро выводится из организма с выделениями. В форме частиц оксид плутония с размером частиц менее 10 микрометров (0,01 мм) токсичен при вдыхании из-за его альфа-излучения.