«Фотоэлектрохимический элемент » является одним из два разных класса устройств. Первый вырабатывает электрическую энергию аналогично сенсибилизированному красителю фотоэлектрическому элементу, который соответствует стандартному определению фотоэлектрического элемента. Второй - это фотоэлектролитическая ячейка, то есть устройство, в котором используется свет, падающий на фотосенсибилизатор, полупроводник или водный металл, погруженный в воду. в электролитическом растворе, чтобы непосредственно вызвать химическую реакцию, например для получения водорода посредством электролиза воды.
Оба типа устройств являются разновидностями солнечного элемента, в что функция фотоэлектрохимического элемента заключается в использовании фотоэлектрического эффекта (или, очень похожего, фотоэлектрического эффекта ) для преобразования электромагнитного излучения (обычно солнечного света) либо непосредственно в в электрическую энергию или во что-то, что само по себе может быть легко использовано для производства электроэнергии (например, водород можно сжигать для создания электроэнергии, см. фотоводород ).
Стандартный фотоэлектрический эффект, как работает в стандартных фотоэлектрических элементах, включает возбуждение отрицательных носителей заряда (электронов) в полупроводниковой среде, и именно отрицательные носители заряда (свободные электроны) в конечном итоге извлекаются для выработки энергии. Классификация фотоэлектрохимических ячеек, которая включает ячейки Гретцеля, соответствует этому узкому определению, хотя носители заряда часто являются экситонными.
С другой стороны, ситуация внутри фотоэлектролитической ячейки совершенно иная. Например, в фотоэлектрохимической ячейке с расщеплением воды при возбуждении светом электрона в полупроводнике остается дыра, которая «вытягивает» электрон из соседней молекулы воды:
.
. В результате в растворе остаются носители положительного заряда (протоны, то есть ионы H +), которые затем должны связываться с одним другим протоном и соединяться с двумя электронами, чтобы образуют водород в соответствии с:

. A фотосинтетическая клетка - еще одна форма фотоэлектрического олитическая ячейка, на выходе которой вместо молекулярного водорода будут углеводы.
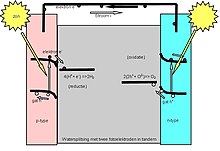 Полосная диаграмма фотоэлектролитической ячейки
Полосная диаграмма фотоэлектролитической ячейки Фотоэлектролитическая ячейка A (расщепляющая воду) электролизует воду на водород и кислород газ путем облучения анода электромагнитным излучением , то есть светом. Это получило название искусственного фотосинтеза и было предложено как способ хранения солнечной энергии в водороде для использования в качестве топлива.
Попадающий солнечный свет возбуждает свободные электроны у поверхности кремниевого электрода. Эти электроны проходят через провода к электроду из нержавеющей стали, где четыре из них вступают в реакцию с четырьмя молекулами воды с образованием двух молекул водорода и 4 групп ОН. Группы ОН протекают через жидкий электролит к поверхности кремниевого электрода. Там они взаимодействуют с четырьмя дырками, связанными с четырьмя фотоэлектронами, в результате чего образуются две молекулы воды и молекула кислорода. Освещенный кремний сразу начинает разъедать при контакте с электролитами. Коррозия приводит к расходу материала и нарушению свойств поверхностей и границ раздела внутри ячейки.
Два типа фотохимических систем работают через фотокатализ. В качестве катализаторов используются поверхности полупроводников. В этих устройствах поверхность полупроводника поглощает солнечную энергию и действует как электрод для разделения воды. В другой методике в качестве катализаторов используются комплексы металлов в растворе.
Фотоэлектролитические ячейки преодолели барьер 10% экономической эффективности. Коррозия полупроводников остается проблемой, учитывая их прямой контакт с водой. В настоящее время ведутся исследования по достижению срока службы 10000 часов, требования, установленного Министерством энергетики США.
Первые фотоэлектрические Ячейка из когда-либо созданных была также первой фотоэлектрохимической ячейкой. Он был создан в 1839 году Александром-Эдмоном Беккерелем, в возрасте 19 лет, в лаборатории своего отца.
Наиболее часто исследуемым современным фотоэлектрохимическим элементом в последние десятилетия был Grätzel. элемент, хотя в последнее время большое внимание переключилось с этой темы на перовскитные солнечные элементы из-за относительно высокой эффективности последних и сходства в методах осаждения из паровой фазы, обычно используемых при их создании.
Сенсибилизированные красителем солнечные элементы или элементы Гретцеля используют краситель- адсорбированный высокопористый нанокристаллический диоксид титана (nc-TiO. 2) для производства электроэнергии.
Водоразделительные фотоэлектрохимические (PEC) ячейки используют световую энергию для разложения воды на водород и кислород в двухэлектродном элементе. Теоретически существует три компоновки фотоэлектродов в сборке ФЭП:
К фотоэлектродным материалам в PEC 
 и
и 
В дополнение к этим требованиям, материалы должны быть недорогими и иметь много земли, чтобы стало возможным широкое внедрение разделения воды PEC.
Хотя перечисленные требования могут применяться в целом, фотоаноды и фотокатоды имеют несколько разные потребности. У хорошего фотокатода будет раннее начало реакции выделения кислорода (низкое перенапряжение), большой фототок при насыщении и быстрый рост фототока в начале. С другой стороны, хорошие фотоаноды будут иметь раннее начало реакции выделения водорода в дополнение к сильному току и быстрому росту фототока. Чтобы максимизировать ток, материалы анода и катода должны быть согласованы друг с другом; лучший анод для одного материала катода может не подойти для другого.
В 1967 году Акира Фудзисима открыл эффект Хонда-Фудзисимы (фотокаталитические свойства диоксида титана).
TiO. 2 и оксиды других металлов по-прежнему являются наиболее известными катализаторами по причинам эффективности. Включая SrTiO. 3 и BaTiO. 3, этот вид полупроводниковых титанатов, зона проводимости имеет в основном титановый 3D-характер, а валентная зона кислородный 2p символ. Полосы разделены широкой запрещенной зоной , составляющей по меньшей мере 3 эВ, так что эти материалы поглощают только УФ-излучение. Изменение микроструктуры TiO. 2также было исследовано с целью дальнейшего улучшения рабочих характеристик, таких как массивы нанопроволок TiO. 2или пористые нанокристаллические фотоэлектрохимические ячейки TiO. 2.
GaN - еще один вариант, потому что нитриды металлов обычно имеют узкую запрещенную зону, которая может охватывать почти весь солнечный спектр. GaN имеет более узкую запрещенную зону, чем TiO. 2, но все же достаточно большой, чтобы позволить расщеплению воды на поверхности. Нанопроволоки GaN показали лучшие характеристики, чем тонкие пленки GaN, потому что они имеют большую площадь поверхности и высокую монокристалличность, что обеспечивает более длительное время жизни электронно-дырочной пары. Между тем, другие неоксидные полупроводники, такие как GaAs, MoS. 2, WSe. 2и MoSe. 2, используются в качестве электродов n-типа из-за их химической и электрохимической стабильности. этапы реакций фотокоррозии.
В 2013 году ячейка с 2 нанометрами никеля на кремниевом электроде, соединенная с электродом из нержавеющей стали, погруженная в водный электролит и борат лития проработал 80 часов без заметной коррозии по сравнению с 8 часами для диоксида титана. В процессе было образовано около 150 мл газообразного водорода, что соответствует аккумулированию около 2 килоджоулей энергии.
Структурирование поглощающих материалов оказывает как положительное, так и отрицательное влияние на производительность элементов. Структурирование позволяет поглощать свет и собирать носители в разных местах, что снижает требования к чистым материалам и способствует катализу. Это позволяет использовать неблагородные и оксидные катализаторы, которые могут быть стабильными в более окислительных условиях. Однако эти устройства имеют более низкие потенциалы холостого хода, что может способствовать снижению производительности.
 Структура гематита
Структура гематита Исследователи тщательно исследовали использование гематита (α-Fe2O3) в расщеплении воды PEC устройств из-за невысокой стоимости, легирования n-типа и ширины запрещенной зоны (2,2 эВ). Однако производительность ухудшается из-за плохой проводимости и анизотропии кристаллов. Некоторые исследователи усилили каталитическую активность за счет образования на поверхности слоя сокатализаторов. Сокатализаторы включают фосфат кобальта и оксид иридия, который, как известно, является высокоактивным катализатором реакции выделения кислорода.
Оксид вольфрама (VI) (WO3), который проявляет несколько различных полиморфов при различных температурах, представляет интерес из-за своей высокой проводимости, но имеет относительно широкую непрямую запрещенную зону (~ 2,7 эВ), что означает, что он не может поглощать большую часть солнечного спектра. Хотя было предпринято множество попыток увеличить поглощение, они привели к плохой проводимости, и, таким образом, WO3, по-видимому, не является жизнеспособным материалом для расщепления воды PEC.
С более узкой прямой запрещенная зона (2,4 эВ) и правильное выравнивание полос с потенциалом окисления воды, моноклинная форма BiVO. 4 вызвала интерес исследователей. Со временем было показано, что V-образные и компактные пленки связаны с более высоким фототоком или более высокими характеристиками. Ванадат висмута также изучался на предмет солнечного 
Фотоэлектрохимическое окисление (PECO) - это процесс, с помощью которого свет позволяет полупроводнику способствовать реакции каталитического окисления. Хотя фотоэлектрохимический элемент обычно включает в себя как полупроводник (электрод), так и металл (противоэлектрод), при достаточно малых масштабах чистые полупроводниковые частицы могут вести себя как микроскопические фотоэлектрохимические ячейки. PECO находит применение в детоксикации воздуха и воды, производстве водорода и других применениях.
Процесс, посредством которого фотон непосредственно инициирует химическую реакцию, известен как фотолиз ; если этому процессу способствует катализатор, он называется фотокатализ. Если фотон имеет больше энергии, чем характерная ширина запрещенной зоны материала, он может освободить электрон при поглощении материалом. Оставшаяся положительно заряженная дырка и свободный электрон могут рекомбинировать, выделяя тепло, или они могут принимать участие в фотореакциях с соседними частицами. Если фотореакции с этими частицами приводят к регенерации электронодонорного материала, т. Е. Если материал действует как катализатор реакций, тогда реакции считаются фотокаталитическими. PECO представляет собой тип фотокатализа, при котором электрохимия на основе полупроводников катализирует реакцию окисления - например, окислительную деградацию переносимых по воздуху загрязнителей в системах очистки воздуха.
Основная цель фотоэлектрокатализа заключается в обеспечении низкоэнергетических путей активации для прохождения электронных носителей заряда через поверхность раздела электрод-электролит и, в частности, для фотоэлектрохимического образования химических продуктов. Что касается фотоэлектрохимического окисления, мы можем рассмотреть, например, следующую систему реакций, которые представляют собой окисление, катализируемое TiO 2.
Эта система показывает ряд путей образования окислительных частиц, которые облегчают окисление частиц RX, в дополнение к его прямому окислению самим возбужденным TiO 2. PECO касается такого процесса, при котором электронные носители заряда могут легко перемещаться через реакционную среду, тем самым до некоторой степени смягчая реакции рекомбинации, которые ограничивают окислительный процесс. «Фотоэлектрохимическая ячейка» в этом случае может быть такой же простой, как очень маленькая частица полупроводникового катализатора. Здесь на «светлой» стороне окисляется один компонент, а на «темной» стороне восстанавливается отдельный компонент.
Классическая макроскопическая фотоэлектрохимическая система состоит из полупроводника, находящегося в электрическом контакте с противоэлектродом. Для полупроводниковых частиц N-типа достаточно малых размеров частицы поляризуются в анодную и катодную области, эффективно формируя микроскопические фотоэлектрохимические ячейки. Освещенная поверхность частицы катализирует реакцию фотоокисления, в то время как «темная» сторона частицы способствует сопутствующему восстановлению.
Фотоэлектрохимическое окисление можно рассматривать как частный случай фотохимического окисления (PCO). Фотохимическое окисление влечет за собой образование радикалов, которые делают возможными реакции окисления, с электрохимическими взаимодействиями, участвующими в системах с полупроводниковыми катализаторами, которые происходят при фотоэлектрохимическом окислении, или без них.
PECO может быть полезен в обработки воздуха и воды.
В 1938 году Гудив и Китченер продемонстрировали «фотосенсибилизацию» TiO 2, например, о чем свидетельствует выцветание красок, содержащих это как пигмент. В 1969 году Кинни и Ивануски предположили, что различные оксиды металлов, включая TiO 2, могут катализировать окисление растворенных органических материалов (фенола, бензойной кислоты, уксусной кислоты, стеарата натрия и сахарозы) при освещении солнечные лампы. Дополнительная работа Carey et al. предположил, что TiO 2 может быть полезен для фотодехлорирования ПХБ.