В органической химии перициклическая реакция является типом органических реакция, в которой переходное состояние молекулы имеет циклическую геометрию, реакция протекает согласованным образом, и связывающие орбитали участвуют в реакции перекрываются в непрерывном цикле в переходном состоянии. Перициклические реакции отличаются от линейных реакций, охватывающих большинство органических превращений и протекающих через ациклическое переходное состояние, с одной стороны, и коарктатные реакции, которые протекают через дважды циклическое согласованное переходное состояние, с другой стороны. Перициклические реакции обычно представляют собой реакции перегруппировки или присоединения. Основные классы перициклических реакций приведены в таблице ниже (три наиболее важных класса выделены жирным шрифтом). Еные реакции и хелетропные реакции часто классифицируются как реакции группового переноса и циклоприсоединения / реверсии соответственно, в то время как диотропные реакции и реакции группового переноса (если исключены еновые реакции) встречаются редко.
| Имя | Изменения связи | |
|---|---|---|
| Sigma | Pi | |
| Электроциклическая реакция | + 1 | - 1 |
| Циклоприсоединение (и циклореверсия) | + 2 | - 2 |
| Сигматропная реакция | 0 | 0 |
| Реакция передачи группы | 0 | 0 |
| Еневая реакция | + 1 | - 1 |
| Хелетропная реакция | + 2 | - 1 |
| Диотропная реакция | 0 | 0 |
В общем, это считается равновесными процессами, хотя можно подтолкнуть реакцию в одном направлении, разработав реакцию, при которой продукт находится в значительном более низкий уровень энергии; это происходит из-за мономолекулярной интерпретации принципа Ле Шателье. Таким образом, возникает набор «ретро» перициклических реакций.
По определению, перициклические реакции протекают по согласованному механизму с участием одного циклического переходного состояния. Из-за этого до систематического понимания перициклических процессов с помощью принципа сохранения орбитальной симметрии они были шутливо названы «реакциями без механизма». Однако реакции, для которых можно применить перициклические механизмы, часто имеют связанные ступенчатые механизмы, протекающие через радикальные или диполярные промежуточные соединения, которые также жизнеспособны. Некоторые классы перициклических реакций, такие как [2 + 2] реакции циклоприсоединения кетена, могут быть «противоречивыми», потому что их механизм иногда точно не известен как согласованный (или может зависеть от реактивной системы). Более того, перициклические реакции также часто имеют аналоги, катализируемые металлами, хотя обычно они также не являются перициклическими с технической точки зрения, поскольку они протекают через промежуточные соединения, стабилизированные металлами, и поэтому не согласованы.
Несмотря на эти оговорки, теоретические представления о перициклических реакциях, вероятно, являются одними из самых сложных и хорошо разработанных во всей органической химии. Понимание того, как орбитали взаимодействуют в ходе перициклического процесса, привело к правилам Вудворда – Хоффмана, простому набору критериев для прогнозирования вероятности перициклического механизма реакции. или благоприятный. Например, эти правила предсказывают, что [4 + 2] циклоприсоединение бутадиена и этилена в термических условиях, вероятно, является перициклическим процессом, в то время как [2 + 2] циклоприсоединение двух молекул этилена - нет. Они согласуются с экспериментальными данными, подтверждая упорядоченное согласованное переходное состояние для первого и многоступенчатый радикальный процесс для последнего. Несколько эквивалентных подходов, описанных ниже, приводят к одним и тем же прогнозам.
Теория ароматического переходного состояния предполагает, что минимальная энергия переходного состояния для перициклического процесса является ароматическим, при этом определяется выбор топологии реакции. по количеству вовлеченных электронов. Для реакций с участием (4n + 2) -электронных систем (2, 6, 10,... электронов; нечетное число электронных пар) предложены переходные состояния топологии Hückel, в которых реактивная часть реагирующая молекула или молекулы имеют орбитали, взаимодействующие в непрерывном цикле с четным числом узлов. В 4n-электронных системах (4, 8, 12,... электронов; четное число электронных пар) предлагаются переходные состояния с топологией Мёбиуса, в которых реагирующие молекулы имеют орбитали, взаимодействующие в непрерывном закрученном цикле с нечетное количество узлов. Соответствующие (4n + 2) -электронные переходные состояния Мебиуса и 4n-электронные переходные состояния Хюккеля являются антиароматическими и, таким образом, являются сильно неблагоприятными. Теория ароматических переходных состояний приводит к особенно простой формулировке обобщенных правил Вудворда – Хоффмана: перициклическая реакция с участием нечетного числа электронных пар будет проходить через переходное состояние Хюккеля (четное число антарафациальных компонентов в терминологии Вудворда – Хоффмана), в то время как перициклическая реакция с участием четного числа электронных пар будет проходить через переходное состояние Мёбиуса (нечетное число антарафациальных компонентов).
Эквивалентно перициклические реакции были проанализированы с помощью корреляционных диаграмм, которые отслеживают эволюцию молекулярных орбиталей (известных как «коррелирующие» молекулярные орбитали) реагирующих молекул по мере их продвижения от реагентов. к продуктам через переходное состояние в зависимости от их свойств симметрии. Реакции благоприятны («разрешены»), если основное состояние реагентов коррелируют с основным состоянием продуктов, в то время как они неблагоприятны («запрещены»), если основное состояние реагентов коррелирует с возбужденным состоянием продуктов. Эта идея известна как сохранение орбитальной симметрии. Рассмотрение взаимодействий самых высоких занятых и самых низких незанятых молекулярных орбиталей (пограничный орбитальный анализ ) является другим подходом к анализу переходного состояния перициклической реакции.
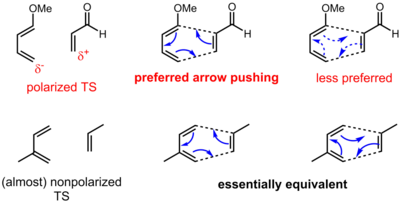
Соглашение о толкании стрелкой для перициклических реакций имеет несколько иное значение по сравнению с полярными (и радикальными) реакциями. Для перициклических реакций часто нет очевидного движения электронов от источника, богатого электронами, в сток с низким содержанием электронов. Скорее электроны перераспределяются вокруг циклического переходного состояния. Таким образом, электроны могут выталкиваться в любом из двух направлений для перициклической реакции. Однако для некоторых перициклических реакций существует определенная поляризация заряда в переходном состоянии из-за асинхронности (образование и разрыв связи в переходном состоянии не происходят в одинаковой степени). Таким образом, одно направление может быть предпочтительнее другого, хотя, возможно, оба изображения формально верны. В случае реакции Дильса-Альдера, показанной ниже, резонансные аргументы ясно показывают направление поляризации. Однако в более сложных ситуациях могут потребоваться подробные вычисления для определения направления и степени поляризации.
.
Тесно связанные с перициклическими процессами реакции псевдоперициклические . Хотя псевдоперициклическая реакция протекает через циклическое переходное состояние, две из задействованных орбиталей должны быть ортогональными и не могут взаимодействовать. Возможно, наиболее известным примером является гидроборирование олефина. Хотя это, по-видимому, процесс передачи группы с запрещенной топологией Хюккеля с 4 электронами, пустая p-орбиталь и sp-гибридизированная связь B – H ортогональны и не взаимодействуют. Следовательно, правила Вудворда-Хоффмана не применяются. (Тот факт, что гидроборирование, как полагают, протекает через начальное π-комплексообразование, также может иметь значение.)
Перициклические реакции также происходят в нескольких биологических процессах: