| Чрескожное коронарное вмешательство | |
|---|---|
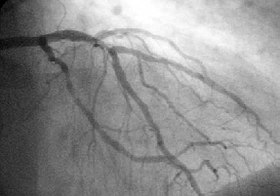 A коронарная ангиограмма, показывающая кровообращение в левая главная коронарная артерия и ее ветви. A коронарная ангиограмма, показывающая кровообращение в левая главная коронарная артерия и ее ветви. | |
| Другие названия | Чрескожная транслюминальная коронарная ангиопластика (ЧТКА), коронарная ангиопластика |
| ICD-9-CM | 36.09, 00.66 |
| [редактировать Викиданные ] | |
Чрескожное коронарное вмешательство (PCI ) - это нехирургическая процедура, используемая для лечения сужения коронарных артерий сердце, обнаруженное в ишемической болезни сердца. Этот процесс включает сочетание коронарной ангиопластики со стентированием, которое представляет собой введение постоянной проволочной сетки, которая либо выделяется лекарственным средством (DES), либо состоит из чистого металла (BMS). Баллон для доставки стента из катетера для ангиопластики надувается средой для обеспечения контакта между стойками стента и стенкой сосуда (наложение стента), таким образом увеличивая диаметр кровеносного сосуда. После получения доступа к кровотоку через бедренную или лучевую артерию процедура использует коронарную катетеризацию для визуализации кровеносных сосудов на рентгеновских изображениях. После этого интервенционный кардиолог может выполнить коронарную ангиопластику с помощью баллонного катетера, в котором спущенный баллон продвигается в закупоренную артерию и надувается для облегчения состояния. сужение; определенные устройства, такие как стенты, могут быть развернуты, чтобы держать кровеносный сосуд открытым. Также могут быть выполнены различные другие процедуры.
Первичное ЧКВ - это неотложное применение ЧКВ у людей с острым сердечным приступом, особенно если на электрокардиограмме есть свидетельства поражения сердца. ЧКВ также используется у людей после других форм инфаркта миокарда или нестабильной стенокардии, когда существует высокий риск дальнейших событий. Наконец, ЧКВ можно использовать у людей со стабильной стенокардией, особенно если симптомы трудно контролировать с помощью лекарств. ЧКВ является альтернативой аортокоронарному шунтированию (АКШ, часто называемому «шунтирование»), которое позволяет обходить стенозированные артерии путем пересадки сосудов из других частей тела. При определенных обстоятельствах, таких как обширная закупорка, фон диабет, АКШ может быть лучше.
Коронарная ангиопластика была впервые введена в 1977 г. Андреасом Грюнцигом в Швейцарии.
 Коронарная ангиография и ангиопластика при остром инфаркте миокарда (слева: ПКА закрыта, справа: ПКА успешно расширена)
Коронарная ангиография и ангиопластика при остром инфаркте миокарда (слева: ПКА закрыта, справа: ПКА успешно расширена)  Плотный критический стеноз (95%) проксимального отдела ПМЖВ у пациента с предупреждением Wellens
Плотный критический стеноз (95%) проксимального отдела ПМЖВ у пациента с предупреждением Wellens ЧКВ используется в первую очередь для открытия закупоренной коронарной артерии и восстановления артериального кровотока в ткани сердца без необходимости открытия -операция на сердце. У пациентов с суженной или заблокированной коронарной артерией ЧКВ может быть лучшим вариантом для восстановления кровотока, а также предотвращения стенокардии (боли в груди), инфаркта миокарда (сердечного приступа) и смерти. Сегодня ЧКВ обычно включает установку стентов, таких как стенты без покрытия, стенты с лекарственным покрытием и полностью рассасывающиеся сосудистые каркасы (или естественно растворяющиеся стенты). Было показано, что использование стентов важно в течение первых трех месяцев после ЧКВ; после этого артерия может оставаться открытой сама по себе. Это предпосылка для разработки биорезорбируемых стентов, которые растворяются естественным образом, когда они больше не нужны.
Целесообразность использования PCI зависит от многих факторов. ЧКВ может быть целесообразным для пациентов со стабильной ишемической болезнью сердца, если они соответствуют определенным критериям, таким как наличие коронарного стеноза более 50 процентов или наличие симптомов стенокардии, не поддающихся лечению. Хотя ЧКВ не может оказать большей помощи в предотвращении смерти или инфаркта миокарда по сравнению с пероральными препаратами для пациентов со стабильной ИБС, оно, вероятно, обеспечивает лучшее облегчение стенокардии.
У пациентов с острым коронарным синдромом может быть целесообразным ЧКВ. ; руководящие принципы и передовой опыт постоянно развиваются. У пациентов с тяжелой блокадой, такой как инфаркт миокарда с подъемом сегмента ST (ИМпST), ЧКВ может иметь решающее значение для выживания, поскольку оно снижает смертность, инфаркты миокарда и стенокардию по сравнению с лекарствами. Для пациентов с инфарктом миокарда без подъема сегмента ST (nSTEMI) или нестабильной стенокардией лечение медикаментами и / или ЧКВ зависит от оценки риска пациента. Время от двери до баллона используется в больницах в качестве критерия качества для определения своевременности первичного ЧКВ.
Использование ЧКВ в дополнение к лекарствам от стенокардии при стабильной стенокардии может снизить количество пациентов с приступами стенокардии на срок до 3 лет после терапии, но не снижает риск смерти, инфаркта миокарда в будущем или необходимости других вмешательств.
Коронарная ангиопластика широко практикуется и сопряжена с рядом рисков; однако серьезные процедурные осложнения случаются редко. Коронарная ангиопластика обычно выполняется с использованием инвазивных катетерных процедур интервенционным кардиологом, врачом, имеющим специальную подготовку в области лечения сердца.
Пациент обычно не спит во время ангиопластики и Во время процедуры может возникнуть дискомфорт в груди. Пациент не спит, чтобы следить за симптомами пациента. Если симптомы указывают на то, что процедура вызывает ишемию, кардиолог может изменить или прервать часть процедуры. Кровотечение из точки введения в пах (бедренная артерия) или запястье (лучевая артерия) является обычным явлением, отчасти из-за использования антиагрегантов. Таким образом, можно ожидать появления некоторых синяков, но иногда может образовываться гематома. Это может задержать выписку из больницы, так как поток из артерии в гематому может продолжаться (псевдоаневризма), что требует хирургического вмешательства. Инфекция в месте прокола кожи встречается редко, и расслоение (разрыв) доступного кровеносного сосуда встречается редко. Возможна аллергическая реакция на используемый контрастный краситель, но ее можно уменьшить с помощью новых агентов. Ухудшение функции почек может произойти у пациентов с уже существующим заболеванием почек, но почечная недостаточность, требующая диализа, встречается редко. Осложнения сосудистого доступа менее распространены и менее серьезны, если процедура проводится через лучевую артерию.
Наиболее серьезными рисками являются смерть, инсульт, желудочковый фибрилляция (неустойчивая желудочковая тахикардия часто), инфаркт миокарда (сердечный приступ, ИМ) и расслоение аорты. Инфаркт во время или вскоре после процедуры возникает в 0,3% случаев; для этого может потребоваться экстренная операция по аортокоронарному шунтированию. Повреждение сердечной мышцы, характеризующееся повышенными уровнями CK-MB, тропонина I и тропонина T, может наблюдаться до 30% всех процедур ЧКВ. Повышенные ферменты были связаны с более поздними клиническими исходами, такими как более высокий риск смерти, последующий ИМ и необходимость повторных процедур реваскуляризации. Ангиопластика, проведенная вскоре после инфаркта миокарда, может вызвать инсульт, но это меньше, чем риск инсульта после тромболитической терапии.
Как и при любой процедуре, затрагивающей сердце, Иногда, хотя и редко, осложнения могут стать причиной смерти. Летальность при ангиопластике - 1,2%. Иногда во время ангиопластики может возникнуть боль в груди, поскольку баллон на короткое время перекрывает кровоснабжение сердца. Риск осложнений выше у:
Термин баллонная ангиопластика обычно используется для описания надувания баллона в коронарной артерии с целью раздавить бляшку на стенки артерии. Хотя баллонная ангиопластика по-прежнему проводится как часть почти всех чрескожных коронарных вмешательств, она редко бывает единственной выполняемой процедурой.
Другие процедуры, выполняемые во время чрескожного коронарного вмешательства, включают:
Процедура ангиопластики обычно состоит из большинства следующих шагов и выполняется группой, состоящей из врачей, помощников врача, практикующих медсестер, медсестер, рентгенологи и эндоваскулярные специалисты; все они имеют обширную специализированную подготовку по этим типам процедур.
 A коронарный стент устанавливаются путем чрескожного коронарного вмешательства.
A коронарный стент устанавливаются путем чрескожного коронарного вмешательства. Традиционные металлические стенты (BMS) представляют собой механический каркас, который удерживает стенку артерии открытой, предотвращая стеноз или сужение коронарных артерий.
Более новые стенты с лекарственным покрытием (DES) представляют собой традиционные стенты с полимерным покрытием, содержащим лекарственные средства, предотвращающие пролиферацию клеток. Антипролиферативные препараты высвобождаются медленно с течением времени, чтобы помочь предотвратить рост ткани, который может возникнуть в ответ на стент, который может заблокировать артерию. Было показано, что эти типы стентов помогают предотвратить рестеноз артерии с помощью физиологических механизмов, которые зависят от подавления роста ткани в месте стента и локальной модуляции воспалительных и иммунных реакций организма. Первые два стента с лекарственным покрытием, которые были использованы, были стент с покрытием паклитакселом и стент с покрытием сиролимус, оба из которых получили одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США. Большинство современных одобренных FDA стентов с лекарственным покрытием используют сиролимус (также известный как рапамицин), эверолимус и зотаролимус. Стенты с лекарственным покрытием Biolimus A9, в которых используются биоразлагаемые полимеры, одобрены за пределами США
Однако в 2006 году клинические испытания показали возможную связь между стентами с лекарственным покрытием и событием, известным как «поздний тромбоз стента», когда свертывание крови внутри стента может происходить через один или несколько лет после имплантации стента. Поздний тромбоз стента возникает у 0,9% пациентов и заканчивается летальным исходом примерно в одной трети случаев, когда возникает тромбоз. Повышенное внимание к продолжительности приема антиагрегантов и стентам нового поколения (например, стентам, выделяющим эверолимус) резко снизило опасения по поводу позднего тромбоза стентов.
Технологии PCI нового поколения направлены на снижение риска позднего тромбоза стента или других долгосрочных нежелательных явлений. Некоторые продукты DES продают биоразлагаемое полимерное покрытие, полагая, что стойкие полимерные покрытия DES способствуют долгосрочному воспламенению. Другие стратегии: в более недавнем исследовании предполагается, что в случае популяции с сахарным диабетом - группы особого риска - лечение баллонным препаратом с паклитакселом с последующим введением БМС может снизить частоту коронарного рестеноза или инфаркта миокарда по сравнению с применением только БМС.
После установки стента или каркаса пациенту необходимо в течение нескольких месяцев принимать два антитромбоцитарных препарата (аспирин и один из нескольких других вариантов), чтобы предотвратить образование тромбов. Время, в течение которого пациенту необходимо пройти двойную антитромбоцитарную терапию, зависит от индивидуального риска ишемических событий и риска кровотечения.
При первичном ЧКВ ангиография может демонстрируют тромб (сгустки крови) внутри коронарных артерий. Были проведены различные исследования, чтобы определить, полезна ли аспирация этих сгустков (аспирация тромба или ручная тромбэктомия). На данный момент нет доказательств того, что обычная аспирация сгустка улучшает результаты.
Чрескожная коронарная ангиопластика - одна из наиболее распространенных процедур, выполняемых во время пребывания в больнице США; на его долю приходилось 3,6% всех операций в операционных, выполненных в 2011 году. Однако с 2001 по 2011 год его объем снизился на 28%, с 773 900 операционных процедур, выполненных в 2001 году, до 560 500 процедур в 2011 году.
Большинство исследований показали, что АКШ предлагает преимущества в снижении смертности и инфаркта миокарда у людей с многососудистой блокадой по сравнению с ЧКВ. Различные исследования по моделированию пришли к противоположным выводам об относительной экономической эффективности ЧКВ и АКШ у людей с ишемией миокарда, которая не улучшается при лечении.
Коронарная ангиопластика, также известная как чрескожная транслюминальная коронарная ангиопластика (ЧТКА), поскольку она проводится через кожу и через просвет артерии, была впервые разработана в 1977 году Андреасом Грунцигом. Первая процедура была проведена в пятницу, 16 сентября 1977 г., в Цюрих, Швейцария. Принятие процедуры ускорилось после переезда Грюнцига в Университет Эмори в США. Первым сотрудником Грюнцига в Эмори был Меррил Кнудтсон, который к 1981 году уже представил его в Калгари, Альберте, Канаде. К середине 1980-х годов многие ведущие медицинские центры по всему миру применяли эту процедуру для лечения ишемической болезни сердца.
Ангиопластика иногда называлась «точечным», после интервенционный радиолог, Доктор Чарльз Теодор Доттер, который вместе с доктором Мелвином П. Джудкинсом впервые описал ангиопластику в 1964 году. По мере расширения диапазона процедур, выполняемых на коронарной артерии просвет, название процедура была изменена на чрескожное коронарное вмешательство.
Текущие концепции признают, что через три месяца артерия адаптировалась и зажила и больше не нуждается в стенте. Полная реваскуляризация всех стенозированных коронарных артерий после ИМпST более эффективна с точки зрения серьезных неблагоприятных сердечных событий и общей смертности, но при этом безопаснее, чем подход с использованием только виновных сосудов.
В 2007 г. Медицинский журнал Новой Англии опубликовал результаты исследования COURAGE. В исследовании сравнивали стентирование, используемое при ЧКВ, и только медикаментозную терапию при стабильной симптоматической ишемической болезни сердца (ИБС). Это показало, что при стабильной ИБС не было преимущества в отношении смертности по сравнению со стентированием, хотя было более раннее облегчение симптомов, которое выровнялось на пять лет. После этого испытания были широко опубликованы отчеты отдельных врачей, выполняющих ЧКВ пациентам, которые не соответствовали никаким традиционным критериям. Метаанализ 2014 года показал, что может быть снижена смертность с помощью стентов второго поколения с лекарственным покрытием, которые не были доступны во время исследования COURAGE. С тех пор медицинские общества выпустили рекомендации относительно того, когда целесообразно проводить чрескожное коронарное вмешательство. В ответ на это было замечено, что частота несоответствующего стентирования снизилась в период с 2009 по 2014 год. Опубликованные статистические данные, касающиеся тенденций в госпитальных процедурах в США, показали снижение общего числа ЧКВ, выполненных в период с 2001 по 2011 год, на 28%. наибольшее снижение, заметное с 2007 года.
Исследование ORBITA 2017 года также вызвало много споров, поскольку оно обнаружило, что после чрескожного коронарного вмешательства не было статистически значимой разницы во времени выполнения упражнений по сравнению с медикаментозной терапией. Авторы исследования считают, что облегчение стенокардии с помощью ЧКВ во многом является эффектом плацебо. Другие отметили небольшой размер выборки, недостаточную мощность для выявления различий в результатах и короткую 6-недельную продолжительность испытания. 85% пациентов из группы медикаментозной терапии выбрали ЧКВ в конце исследования.
Исследование ISCHEMIA 2019 подтвердило, что инвазивные процедуры (ЧКВ или АКШ) не снижают смертность или сердечные приступы по сравнению с медицинскими только терапия стабильной стенокардии. У пациентов со стенокардией улучшилось качество жизни после ЧКВ по сравнению с медикаментозной терапией.