 Цинкоорганическое соединение
Цинкоорганическое соединение Цинковоорганическое соединение в органической химии содержат углерод с цинком химическими связями. Химия цинка - это наука о цинкорганических соединениях, описывающая их физические свойства, синтез и реакции.
Цинкоорганические соединения были одними из первых металлоорганических соединений. Они менее реакционны, чем многие другие аналогичные металлоорганические реагенты, такие как реактивы Гриньяра и литийорганические реагенты. В 1848 году Эдвард Франкленд получил первое цинкорганическое соединение, диэтилцинк, путем нагревания этилйодида в присутствии металлического цинка. В результате этой реакции образуется летучая бесцветная жидкость, которая самовоспламеняется при контакте с воздухом. Из-за их пирофорной природы цинкорганические соединения обычно получают с использованием безвоздушных технологий. Они нестабильны по отношению к протонным растворителям. Для многих целей их получают in situ, а не изолированно, но многие из них были выделены как чистые вещества и тщательно охарактеризованы.
Оцинкованные органические соединения можно разделить на категории по количеству связанных углеродных заместителей к металлу.
В его согласовании завершено xes цинк (II) принимает несколько координационных геометрий, обычно октаэдрическую, тетраэдрическую и различные пятикоординированные геометрии. Эту структурную гибкость можно отнести к электронной конфигурации [Ar] 3d4s цинка. 3D-орбиталь заполнена, и поэтому эффекты поля лиганда отсутствуют. Таким образом, координационная геометрия во многом определяется электростатическими и стерическими взаимодействиями. Цинкоорганические соединения обычно являются двух- или трехкоординатными, что отражает сильное донорское свойство карбанионных лигандов.
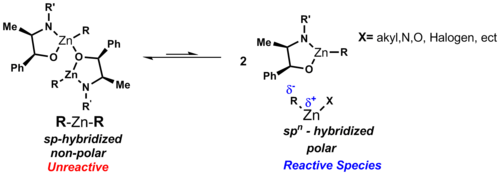
Типичные комплексы диорганоцинка имеют формулу R 2 Zn. Соединения диалкилцинка являются мономерными с линейной координацией у атома цинка. Между углеродом и цинком существует полярная ковалентная связь, которая поляризована по отношению к углероду из-за различий в значениях электроотрицательности (углерод: 2,5 и цинк: 1,65). дипольный момент симметричных диорганоцинковых реагентов можно рассматривать как ноль в этих линейных комплексах, что объясняет их растворимость в неполярных растворителях, таких как циклогексан. В отличие от других бинарных алкилов металлов, разновидности диорганоцинка проявляют низкое сродство к комплексообразованию с эфирным растворителем. Связывание в R 2 Zn описано как использование sp- гибридизированных орбиталей на Zn.
Эти структуры заставляют цинк иметь две связывающие d-орбитали и три низкорасположенных несвязывающие d-орбитали (см. несвязывающие орбитали ), которые доступны для связывания. Когда в цинке отсутствуют электронодонорные лиганды, он не может достичь координационного насыщения, что является следствием большого атомного радиуса и низкого электронного дефицита цинка. Следовательно, мостиковые алкильные или арильные группы возникают редко из-за слабого дефицита электронов у атома цинка. Хотя это действительно происходит в некоторых случаях, таких как Ph 2 Zn (показано ниже) и галогены, являющиеся цинкорганическими соединениями, могут образовывать металлические кластеры (см. химия кластеров ). Когда к атому цинка добавляется лиганд галогена, акцепторный и донорный характер цинка усиливается, обеспечивая агрегацию.
 Насыщенные диорганоцинковые реагенты с мостиковыми арильными группами
Насыщенные диорганоцинковые реагенты с мостиковыми арильными группами Существует несколько методов получения цинкорганических соединений. Коммерчески доступными соединениями диорганцинка являются диметилцинк, диэтилцинк и дифенилцинк. Эти реагенты дороги и с ними сложно обращаться. В одном исследовании активное цинкорганическое соединение получают из гораздо более дешевых предшественников броморганического соединения :
 | (2.1) |
Первоначальный синтез диэтилцинка Франклендом включает реакцию этилиодида с металлическим цинком. Цинк должен быть активирован, чтобы облегчить эту окислительно-восстановительную реакцию. Одной из таких активированных форм цинка, используемых Франкландом, является пара цинк-медь.
| 2 EtI + 2 Zn → Et. 2Zn + ZnI. 2 | (2.2) |
цинк Рике, произведенный восстановлением ZnCl 2 калием in situ является другой активированной формой цинка. Эта форма оказалась полезной для таких реакций, как связывание Негиси и связывание Фукуямы. Образование цинкорганических реагентов облегчается для алкил- или арилгалогенидов, содержащих электроноакцепторные заместители, например, нитрилы и сложные эфиры.
![{\displaystyle {\ce {{ZnCl2}+2K->[{\ ce {THF}}] [{\ ce {-2KCl}}]} } \ overbrace {\ ce {Zn ^ {0}}} ^ {\ ce {Riecke \ zinc}} + {\ ce {RX ->[{\ ce {THF}}] [20-60 ^ {\ circ} {\ ce {C}}] R-Zn-I}} \ qquad {\ begin {cases} \ mathbf {R}: {\ text {Аллил, Арил, Акил, Бензил}} \\\ mathbf {X} : {\ text {Бромид, йод}} \ end {cases}}}]( https://wikimedia.org/api/rest_v1/media/math / render / svg / c23dfc1433cc2a8cd14e74cabb75231ea1618cd8 ) | (2.3) |
 | (2.4) |
Две наиболее распространенные реакции взаимопревращения функциональных групп цинка связаны с галогенидами и бором, которые катализируются йодидом меди (CuI) или основанием. Промежуточное соединение бора синтезируют с помощью начальной реакции гидроборирования с последующей обработкой диэтилцинком. Этот синтез показывает полезность цинкорганических реагентов, демонстрируя высокую селективность в отношении наиболее реактивного сайта в молекуле, а также создавая полезных партнеров для связывания.
 | (2.5) |
Эту реакцию переноса группы можно использовать в аллилировании или другие реакции сочетания (такие как сочетание Негиши).
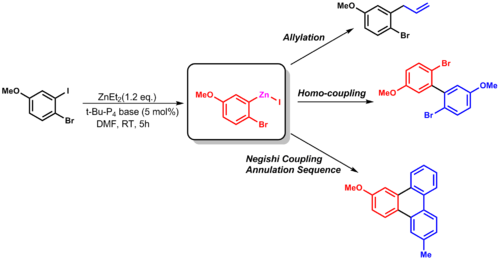 | (2.6) |
Одним из основных недостатков алкилирования диорганоцинка является то, что только один из двух алкильные заместители переносятся. Эта проблема может быть решена путем использования Me 3 SiCH 2 - (TMSM), который является непередаваемой группой.
![{\displaystyle {\begin{array}{l}{}\\{\ce {{R2Zn}+(TMSM)2Zn}}\ {\overset {\ce {THF}}{\ce {<=>>}}} \ {\ ce {2R (TMSM) Zn}} \\ {} \\ {\ ce {{RZnI} + (TMSM) Li ->[{\ ce {THF}}] [- 80 ^ {\ circ} \! {\ ce {C}}] {R (TMSM) Zn} + LiI}} \\ {} \ end {array}} }]( https://wikimedia.org/api/rest_v1/media/math/render/svg/0fdd1941ffd29949716def994df7c380dd816d96 ) | (2.7) |
Трансметаллирование аналогично взаимопревращениям, указанным выше, цинк может обмениваться с другими металлами, такими как ртуть, литий, медь и т. Д. Одним из примеров этой реакции является реакция дифенилртути с металлический цинк с образованием дифенилцинка и металлической ртути :
| HgPh 2 + Zn → ZnPh 2 + Hg | (2.8) |
Преимущество трансметаллирования в цинк: часто более устойчиво к другим функциональным группам в молекуле из-за низкой реакционной способности, которая увеличивает селективность.
 | (2.9) |
Цинкорганический цинк можно получить непосредственно из металлического цинка:
 | (2.10) |
Во многих своих реакциях цинкорганические соединения появляются как промежуточные соединения.
Эту органическую реакцию можно использовать для преобразования α-галогенэфира и кетона или альдегида до β-гидроксиэфира. Кислота необходима для протонирования образующегося алкоксида во время обработки. Первым этапом является окислительное добавление металлического цинка к связи углерод-галоген с образованием енолята углерод-цинк. Этот енолят C-Zn затем может перегруппироваться в енолят кислород-цинк посредством координации. Как только он образуется, другой карбонилсодержащий исходный материал будет координироваться, как показано ниже, и давать продукт после протонирования. Преимущества реакции Реформатского по сравнению с традиционными протоколами альдольной реакции заключаются в следующем:
Ниже показано шестичленное переходное состояние модели Циммермана-Тракслера (Chelation Control, см. Альдольная реакция ), в которой R меньше, чем R.
 | (3.1) |
Реакция Реформатского использовалась во многих общих синтезах, таких как синтез C (16), C (18) - бис-эпи-цитохалазин D:
 | (3.2) |
Реакция Реформатского допускает это даже с гомоэнолатами цинка. Модификацией реакции Реформатского является реакция Блейза.
 | (3.3) |
Реагент Симмонса – Смита используется для получения циклопропанов из олефинов. с использованием метиленйодида в качестве источника метилена. Взаимодействие происходит с цинком. Ключевым образующимся промежуточным цинком является карбеноид (йодметил) иодид цинка, который реагирует с алкенами с образованием циклопропанированного продукта. Скорость образования активных частиц цинка увеличивается с помощью обработки ультразвуком, так как первоначальная реакция происходит на поверхности металла.
 | (3.4) |
 | (3.5) |
Хотя механизм не был полностью разработан, предполагается, что цинкорганическое промежуточное соединение представляет собой металл- карбеноид. Промежуточное соединение считается трехцентровым "типа бабочки". Это промежуточное соединение может быть направлено заместителями, такими как спиртов, чтобы доставить циклопропан на та же сторона молекулы. Цинк-медная пара обычно используется для активации цинка.
 | (3.6) |
цинкорганические соединения, полученные из метиленбромида или иодид может электрофильно присоединяться к карбонильным группам с образованием концевых алкенов. Реакция механически связана с реакцией Теббе и может катализироваться различными кислотами Льюиса (например, TiCl 4 или Al2Me6 ). Реакция используется для введения дейтерия в молекулы для изотопного мечения или в качестве альтернативы реакции Виттига.
Это мощное углеродное соединение. углеродная связь, образующая реакции перекрестного сочетания, объединяет органический галогенид и галогенид цинка в присутствии никелевого или палладиевого катализатора. Органический галогенидный реагент может представлять собой алкенил, арил, аллил или пропаргил. Сочетание алкилцинка с алкилгалогенидами, такими как бромиды и хлориды, также сообщалось с активными катализаторами, такими как предкатализаторы Pd-PEPPSI, которые сильно сопротивляются отщеплению бета-гидрида (обычное явление для алкильных заместителей). Либо диорганические соединения, либо галогениды цинка можно использовать в качестве партнеров для связывания на стадии трансметаллирования в этой реакции. Несмотря на низкую реакционную способность цинкорганических реагентов по отношению к органическим электрофилам, эти реагенты являются одними из самых сильных нуклеофилов металлов по отношению к палладию.
Алкилцинковые соединения требуют присутствия, по крайней мере, стехиометрического количества галогенид-ионов в растворе для образования "цинката". "разновидность формы RZnX 3, прежде чем она сможет претерпеть трансметалляцию в центр палладия. Такое поведение сильно контрастирует со случаем арилцинка. Ключевым этапом каталитического цикла является трансметаллирование, в котором галогенид цинка обменивает свой органический заместитель на другой галоген с металлическим центром.
Элегантным примером сочетания Негиси является синтез Фурстнера амфидинолида T1:
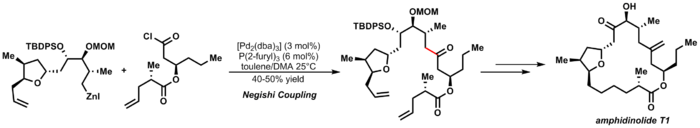 | (3.7) |
Сочетание Фукуямы представляет собой реакцию, катализируемую палладием. включающий сочетание арила, алкила, аллила или α, β-ненасыщенного тиоэфира соединения. Это сложное тиоэфирное соединение может быть связано с широким спектром цинкорганических реагентов для выявления соответствующего кетонового продукта. Этот протокол полезен из-за его чувствительности к функциональным группам, таким как кетон, ацетат, ароматические галогениды и даже альдегиды. Наблюдаемая хемоселективность указывает на то, что образование кетона происходит более легко, чем окислительное добавление палладия к этим другим фрагментам.
(3.8) |
Еще одним примером этого метода сочетания является синтез (+) - биотина. В этом случае соединение Фукуямы происходит с тиолактоном:
 | (3.9) |
реакция Барбье включает нуклеофильное присоединение карбанион, эквивалентный карбонилу. Превращение аналогично реакции Гриньяра. Цинкорганический реагент образуется в результате окислительного присоединения к алкилгалогениду. В результате реакции образуется первичный, вторичный или третичный спирт посредством 1,2-присоединения. Реакция Барбье выгодна, потому что это процесс в одной емкости: цинкорганический реагент образуется в присутствии карбонильного субстрата. Цинкоорганические реагенты также менее чувствительны к воде, поэтому эту реакцию можно проводить в воде. Подобно реакции Гриньяра, применяется равновесие Шленка, в котором может образовываться более реактивный диалкилцинк.
 | (3.10) |
Механизм напоминает реакцию Гриньяра в алкоксид металла может быть получен по радикальному ступенчатому пути, посредством переноса одного электрона или согласованной реакции путем через циклическое переходное состояние. Примером этой реакции является синтез циклопропарадицикола Данишефски. При использовании условий реакции присоединения цинка другие функциональные группы диенона и алкина допускаются:
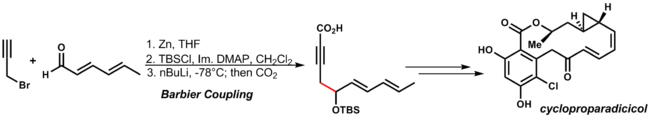 . . | (3.11) |
Образование ацетилида цинка протекает через промежуточность диалкинилцинка (обмен функциональной группой). Были разработаны каталитические процессы, такие как процесс эфедрина компании Merck. Пропаргиловые спирты можно синтезировать из ацетилидов цинка. Эти универсальные промежуточные соединения затем можно использовать для широкого диапазона химических превращений, таких как реакции кросс-сочетания, гидрирование и перициклические реакции.
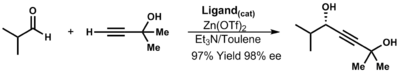 | (3.12) |
В отсутствие лигандов реакция протекает медленно и неэффективно. В присутствии хиральных лигандов реакция протекает быстро и дает высокую конверсию. Нойори определил, что комплекс моноцинк-лиганд является активным веществом.
 | (3.13) |
Диастереоселективность для добавления цинкорганических реагентов в альдегиды можно предсказать с помощью следующая модель Нойори и Дэвида А. Эванса :
 | (3.14) |
Цинк-ацетилиды используются в ВИЧ-1 ингибитор обратной транскриптазы эфавиренз, а также в производных Merck эфедрина.
 | (3.15) |
первый цинкорганический комплекс (органоцинкат ) был описан в 1858 году Джеймсом Альфредом Ванклином, помощником Франкленда и касался реакции элементарного натрия с диэтилцинком :
| 2 Na + 3 ZnEt 2 → 2 N aZnEt 3 + Zn | (4.1) |
Цинкорганические соединения, обладающие сильной кислотой Льюиса, уязвимы для нуклеофильной атаки щелочными металлами, такими как натрия и, таким образом, образуют эти «еловые соединения». Различают два типа цинкорганических соединений: тетраорганцинкаты ([R 4 Zn] M 2), которые являются дианионными, и триорганоцинкаты ([R 3 Zn] M)., которые являются моноанионными. Их структуры, которые определяются лигандами, подробно охарактеризованы.
Тетраорганцинкаты, такие как [Me 4 Zn] Li 2 может быть получен смешиванием Me 77 2 27 Zn и MeLi в молярном соотношении компонентов 1: 2. Другой пример синтетического пути образования сприоциклических органоцинкатов показан ниже:
 | (4.2) |
Триорганоцинкаты соединения образуются обработкой диорганоцинка, такого как (Me 3 SiCH 2)2Zn, щелочной металл (K) или щелочноземельный металл (Ba, Sr или Ca). Одним из примеров является [(Me 3 SiCH 2)3Zn ] K. Триэтилцинкат разлагается до гидридоэтилцинката (II) натрия в результате отщепления бета-гидрида :
| 2 NaZnEt 3 → Na 2Zn2H2Et4+ 2 C 2H4 | (4.3) |
Продукт представляет собой битетраэдрическую структуру с общими краями, с мостиковыми гидридными лигандами.
Хотя цинкорганические соединения менее изучены, они часто обладают повышенной реакционной способностью и селективностью по сравнению с нейтральными Соединения диорганоцинка. Они были полезны в стереоселективном алкилировании кетонов и родственных карбонилов, реакциях раскрытия цикла. Арилтриметилцинкаты участвуют в реакциях образования CC, опосредованных ванадием.
 | (4.4) |
Низкое Валент Орга Также известны соединения ноцинка, имеющие связь Zn – Zn. О первом таком соединении, декаметилдизинкоцене, было сообщено в 2004 году.