Химия органических соединений железа - это химия соединений железа, содержащих углерод - к- железо химическая связь. Железоорганические соединения используются в органическом синтезе в качестве реагентов, таких как пентакарбонил железа, нонакарбонил дижелеза и тетракарбонилферрат динатрия. Железо принимает степени окисления от Fe (-II) до Fe (VII). Хотя железо обычно менее активно во многих каталитических приложениях, оно дешевле и «экологичнее », чем другие металлы. Железоорганические соединения содержат широкий спектр лигандов, которые поддерживают связь Fe-C; как и другие металлоорганические соединения, эти поддерживающие лиганды в значительной степени включают фосфины, монооксид углерода и циклопентадиенил, но используются жесткие лиганды, такие как амины также.
 Пентакарбонил железа.
Пентакарбонил железа.Важными карбонилами железа являются три нейтральных бинарных карбонила, пентакарбонил железа, нонакарбонил дижелеза и додекакарбонил трижелеза. Один или несколько карбонильных лигандов в этих соединениях могут быть заменены множеством других лигандов, включая алкены и фосфины. Готовят комплекс железа (-II), тетракарбонилферрат динатрия (Na 2 [Fe (CO) 4 ]), также известный как «реагент Коллмана». восстановлением пентакарбонила железа металлическим натрием. Высоконуклеофильный анионный реагент может быть алкилирован и карбонилирован с образованием ацильных производных, которые подвергаются протонолизу с получением альдегидов:
Подобные ацилы железа можно получить, обрабатывая пентакарбонил железа литийорганическими соединениями:
В этом случае карбанион атакует лиганд CO. В дополнительной реакции можно использовать реагент Коллмана для преобразования ацилхлоридов в альдегиды. Аналогичные реакции могут быть достигнуты с солями [HFe (CO) 4 ].
 (Бутадиен) трикарбонил железа.
(Бутадиен) трикарбонил железа.Пентакарбонил железа фотохимически реагирует с алкенами с образованием Fe (CO) 4 (алкен).
Диен железа комплексы обычно получают из Fe (CO) 5 или Fe 2 (CO) 9. Известны производные обычных диенов, таких как циклогексадиен, норборнадиен и циклооктадиен, но даже циклобутадиен может быть стабилизирован. В комплексе с бутадиеном диен принимает цис-конформацию. Карбонилы железа используются в качестве защитной группы для диенов в гидрогенизациях и реакциях Дильса-Альдера. Циклобутадиен-трикарбонил железа получают из 3,4-дихлорциклобутена и Fe 2 (CO) 9.
циклогексадиенов, многие из которых являются производными березового восстановления ароматических соединений, образуют производные (диен) Fe (CO) 3. Сродство звена Fe (CO) 3 к сопряженным диенам проявляется в способности карбонилов железа катализировать изомеризацию 1,5-циклооктадиена в 1,3-циклооктадиен. Комплексы циклогексадиена претерпевают отщепление гидрида с образованием циклогексадиенильных катионов, которые добавляют нуклеофилы. Отщепление гидрида от комплексов циклогексадиен-железа (0) дает производные железа.
Еноновый комплекс (бензилиденацетон) трикарбонил железа служит источником Fe (CO) 3 субъединица и используется для получения других производных. Он используется аналогично Fe 2 (CO) 9.
Алкины реагируют с карбонилами железа с образованием большого разнообразия производных. Производные включают ферролы (Fe 2(C4R4) (CO) 6), (p- хинон ) Fe (CO) 3, (циклобутадиен) Fe (CO) 3 и многие другие.
Стабильные железосодержащие комплексы с лигандами CO и без них известны широким спектром полиненасыщенные углеводороды, например циклогептатриен, азулен и буллвален. В случае циклооктатетраена (COT), производные включают Fe (COT) 2, Fe 3 (COT) 3 и несколько смешанные COT-карбонилы (например, Fe (COT) (CO) 3 и Fe 2 (COT) (CO) 6).
 Бис (циклооктатетраен) железо представляет собой комплекс Fe (0), не содержащий лигандов CO.
Бис (циклооктатетраен) железо представляет собой комплекс Fe (0), не содержащий лигандов CO. Поскольку Fe (II) представляет собой обычную степень окисления для Fe известны многие железоорганические (II) соединения. Соединения Fe (I) часто имеют связи Fe-Fe, но бывают исключения, такие как [Fe (антрацен) 2].

Быстрый рост металлоорганической химии в 20-м веке можно отнести к открытие ферроцена, очень стабильного соединения, которое предвосхитило синтез многих родственных сэндвич-соединений. Ферроцен образуется в результате реакции циклопентадиенида натрия с хлоридом железа (II) :
Ферроцен проявляет разнообразную реакционную способность, локализованную на циклопентадиенильных лигандах, включая реакции Фриделя-Крафтса и литацию. Однако некоторые реакции электрофильной функционализации протекают через начальную атаку в центре Fe с образованием изгиба [Cp 2 Fe –Z] (которые формально представляют собой Fe (IV)). Например, HF: PF 5 и Hg (OTFA) 2 дают выделяемые или спектроскопически наблюдаемые комплексы [Cp 2 Fe – H] PF 6 и Cp 2 Fe – Hg (OTFA) 2 соответственно.
Ферроцен - это также структурно необычный каркас, о чем свидетельствует популярность лигандов, таких как 1,1'-бис (дифенилфосфино) ферроцен, которые используются в катализе. Обработка ферроцена трихлоридом алюминия и бензолом дает катион [CpFe (C 6H6)]. Окисление ферроцена дает голубую разновидность 17e ферроцений. Производные o f фуллерен может также действовать как сильно замещенный циклопентадиенильный лиганд.
Fe (CO) 5 реагируют с циклопентадиеном с образованием дикарбонилдикарбонилдимера циклопентадиенил железа ([ FeCp (CO) 2]2), называемый Fp 2. Пиролиз Fp 2 дает кубовидный кластер [FeCp (CO)] 4.
. Восстановление Fp 2 натрием дает «NaFp», содержащий мощный нуклеофил и предшественник многих производных типа CpFe (CO) 2 R. Производное [FpCH 2 S (CH 3)2] было использовано в циклопропанировании. Комплекс Cp (CO 2) Fe (η- виниловый эфир ] представляет собой замаскированный винилкатион.
Соединения Fp-R являются прохиральными, и исследования использовали хиральные производные CpFe (PPh 3) (CO) ацил.
Простые пералкильные и перарильные комплексы железа менее многочисленны, чем производные Cp и CO. Одним из примеров является тетрамезитилдиирон.
 тетрамезитилдиирон является редким примером нейтрального перорганического комплекса железа.
тетрамезитилдиирон является редким примером нейтрального перорганического комплекса железа. Соединения типа [(η-аллил) Fe (CO) 4 ] X представляют собой аллил катион синтоны в аллильном замещении. Напротив, соединения типа [(η-C 5H5) Fe (CO) 2 (CH 2 CH = CHR)], содержащие η-аллильные группы, аналогичны видам аллилметаллов основной группы (M = B, Si, Sn и т.д.) и реагируют с углеродными электрофилами с образованием продуктов аллилирования с S Селективность E 2 '. Аналогично, алленил (циклопентадиенил железо) дикарбонильные комплексы проявляют реакционную способность, аналогичную свойствам алленилметаллов основной группы, и служат в качестве нуклеофильных пропаргилсинтонов.
Комплексы типа Fe2(SR) 2 (CO) 6 и Fe 2 (PR 2)2(CO) 6 образуются обычно в результате реакции тиолов и вторичных фосфинов с карбонилами железа. Тиолаты также могут быть получены из тетраэдрана Fe 2S2(CO) 6.
Некоторые железоорганические (III) соединения получают окислением железоорганических соединений (II). Давно известным примером является ферроцений [(C 5H5)2Fe]. Множество порфириновых комплексов с железоорганическими соединениями (III).
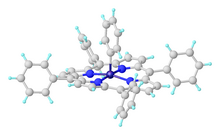 Структура Fe (тетрафенилпорфирин )C6H5.
Структура Fe (тетрафенилпорфирин )C6H5.В Fe (норборнил) 4 Fe (IV) стабилизируется алкильным лигандом, который сопротивляется отщеплению бета-гидрида. Двухэлектронное окисление декаметилферроцена дает дикатион [Fe (C 5Me5)2], который образует карбонильный комплекс, [Fe (C 5Me5)2(CO)]] (SbF 6)2.
В промышленном катализе комплексы железа используются редко, в отличие от кобальта и никеля. Из-за низкой стоимости и низкой токсичности его солей железо является привлекательным стехиометрическим реагентом. В некоторых областях исследования включают:
В области биоорганической химии органическое железо обнаруживается в активных центрах трех ферментов гидрогеназы, а также дегидрогеназы монооксида углерода.