| Нуклеопорин 133/155, N-концевой | |||||||||
|---|---|---|---|---|---|---|---|---|---|
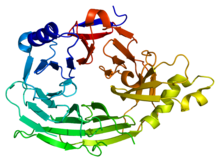 Этот домен имеет структуру бета-винта с 7 лопастями (PDB 1XKS). Этот домен имеет структуру бета-винта с 7 лопастями (PDB 1XKS). | |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | Nucleoporin_N | ||||||||
| Pfam | PF08801 | ||||||||
| ИнтерПро | IPR014908 | ||||||||
| SCOP2 | 1XKS / SCOPe / SUPFAM | ||||||||
| |||||||||
| Нуклеопорин 133/155, С-концевой (ACE2) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
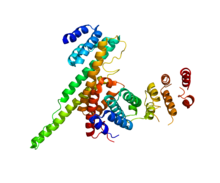 NUP133 (этот домен; справа) взаимодействует с NUP107 (PDB 3CQC). NUP133 (этот домен; справа) взаимодействует с NUP107 (PDB 3CQC). | |||||||||||
| Идентификаторы | |||||||||||
| Условное обозначение | Нуклеопорин_С | ||||||||||
| Pfam | PF03177 | ||||||||||
| ИнтерПро | IPR007187 | ||||||||||
| |||||||||||
| FG повтор | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Условное обозначение | Nucleoporin_FG | ||||||||
| Pfam | PF13634 | ||||||||
| Клан пфам | CL0647 | ||||||||
| ИнтерПро | IPR025574 | ||||||||
| |||||||||
Нуклеопорины представляют собой семейство белков, которые являются составными строительными блоками комплекса ядерных пор (NPC). Комплекс ядерных пор представляет собой массивную структуру, встроенную в ядерную оболочку в местах слияния внутренней и внешней ядерных мембран, образуя ворота, которые регулируют поток макромолекул между ядром клетки и цитоплазмой. Ядерные поры обеспечивают пассивный и облегченный перенос молекул через ядерную оболочку. Нуклеопорины, семейство из примерно 30 белков, являются основными компонентами комплекса ядерных пор в эукариотических клетках. Нуклеопорин 62 - самый распространенный член этого семейства. Нуклеопорины способны переносить молекулы через ядерную оболочку с очень высокой скоростью. Один NPC может каждую минуту переносить 60 000 белковых молекул через ядерную оболочку.
Нуклеопорины опосредуют транспорт макромолекул между ядром клетки и цитоплазмой у эукариот. Некоторые члены семейства нуклеопоринов образуют структурную основу комплекса ядерных пор. Однако нуклеопорины в основном функционируют путем взаимодействия с транспортными молекулами, известными как кариоферины, также известные как Kaps. Эти кариоферины взаимодействуют с нуклеопоринами, которые содержат повторяющиеся последовательности аминокислот фенилаланина (F) и повторов пептида глицина (G) FG. При этом кариоферины могут перемещать свой груз через ядерную оболочку. Нуклеопорины необходимы только для транспорта крупных гидрофильных молекул с массой более 40 кДа, поскольку более мелкие молекулы проходят через ядерные поры посредством пассивной диффузии. Нуклеопорины играют важную роль в транспорте мРНК из ядра в цитоплазму после транскрипции. В зависимости от их функции определенные нуклеопорины локализуются либо на цитозольной, либо на нуклеоплазматической стороне комплекса ядерных пор. Другие нуклеопорины могут быть найдены с обеих сторон. Недавно было показано, что нуклеопорины FG обладают специфическими эволюционно консервативными особенностями, закодированными в их последовательностях, которые дают представление о том, как они регулируют транспорт молекул через комплекс ядерных пор (NPC).
Нуклеопорины объединяются, образуя комплекс ядерных пор, восьмиугольное кольцо, пересекающее ядерную оболочку. Кольцо состоит из восьми субкомплексов каркаса с двумя структурными слоями COPII- подобного покрытия, покрывающего некоторые белки, выстилающие поры. От цитоплазмы до нуклеоплазмы три слоя кольцевого комплекса называются кольцами цитоплазмы, внутренней поры и нуклеоплазмы соответственно. Различные наборы белков связаны с каждым кольцом, и некоторые трансмембранные белки закрепляют сборку на липидном бислое.
В субкомплексе каркаса и цитоплазма, и кольца нуклеоплазмы состоят из Y-комплексов, белкового комплекса, построенного, среди прочего, из NUP133 и NUP107. На каждом конце каждого из восьми каркасов есть два Y-комплекса, добавляющих до 32 комплексов на пору. Взаимосвязь кривизны мембраны ядерной поры с Y-комплексами может рассматриваться как аналогия образования почкующихся пузырьков, покрытых COPII. Белки, выстилающие внутреннюю пору, составляют комплекс NUP62.
На стороне нуклеоплазмы дополнительные белки, связанные с кольцом, образуют «ядерную корзину», комплекс, способный связывать нуклеопорин с ядерной пластиной и даже с определенными частями генома. Цитоплазматический конец менее сложен, с восемью нитями, выступающими в цитоплазму. Похоже, они не играют никакой роли в ядерном импорте.
Мембранные нуклеопорины связываются как с каркасом, так и с ядерной мембраной. Некоторые из них, например GP210, пересекают всю мембрану, другие (например, NUP98 ) действуют как гвозди со структурными частями для облицовки, а также частями, которые врезаются в мембрану. Ранее считалось, что NUP98 является FG-нуклеопорином, пока не было продемонстрировано, что «FG» в нем имеет складку в виде спиральной спирали.
Некоторые нуклеопорины содержат FG-повторы. Названные в честь фенилаланина и глицина, FG-повторы представляют собой небольшие гидрофобные сегменты, которые расщепляют длинные участки гидрофильных аминокислот. Эти гибкие части образуют развернутые или неупорядоченные сегменты без фиксированной структуры. Они образуют массу цепочек, которые позволяют более мелким молекулам диффундировать, но исключают крупные гидрофильные макромолекулы. Эти большие молекулы способны пересекать ядерную пору только в том случае, если они сопровождаются сигнальной молекулой, которая временно взаимодействует с сегментом FG-повтора нуклеопорина. FG-нуклеопорины также содержат глобулярную часть, которая служит якорем для прикрепления к комплексу ядерной поры.
Было показано, что нуклеопорины образуют различные субкомплексы друг с другом. Наиболее распространенным из этих комплексов является комплекс nup62, который представляет собой сборку, состоящую из NUP62, NUP58, NUP54 и NUP45. Другой пример такого комплекса - комплекс Y (NUP107-160), состоящий из множества различных нуклеопоринов. Комплекс NUP107-160 локализован в кинетохорах и играет роль в митозе.
Многие структурные нуклеопорины содержат соленоидные белковые домены, домены, состоящие из повторов, которые могут быть сложены вместе как объемные строительные блоки. Есть бета-пропеллерный домен, сходный с повторами WD40, и, что более интересно, уникальные типы повторов альфа-соленоидов (пучки спиралей), которые образуют собственный класс, предковые коатомерные элементы (ACE). На сегодняшний день идентифицировано два класса ACE. ACE1 представляет собой 28-спиральный домен, обнаруженный во многих нуклеопротеинах каркаса, а также в SEC31, компоненте COPII. ACE2, показанный в информационном окне, обнаружен в дрожжах Nup157 / Nup170 (человеческий Nup155) и Nup133. В любом случае общие домены, как следует из их названий, указывают на общее происхождение как внутри нуклеопротеидов, так и между нуклеопротеинами и котамерами.
Все живые эукариоты разделяют многие важные компоненты NPC, что указывает на то, что у их общего предка присутствует полный комплекс.
Нуклеопорины регулируют транспорт макромолекул через ядерную оболочку посредством взаимодействия с молекулами-переносчиками кариоферинов. Кариоферины связываются со своим грузом и обратимо взаимодействуют с FG-повторами нуклеопоринов. Кариоферины и их груз передаются между FG-повторами, пока они не диффундируют вниз по градиенту их концентрации и через комплекс ядерных пор. Кариоферины могут служить импортином (транспортировать белки в ядро) или экспортином (транспортировать белки из ядра). Высвобождение кариоферинов своего груза управляется Ran, G-белком. Ran достаточно мал, чтобы диффундировать через ядерные поры вниз по градиенту концентрации, не взаимодействуя с нуклеопоринами. Ран будет связываться либо с GTP, либо с GDP и имеет возможность изменять сродство кариоферина к своему грузу. Внутри ядра RanGTP заставляет импортин кариоферин изменять конформацию, позволяя высвобождать его груз. RanGTP может также связываться с экспортными кариоферинами и проходить через ядерную пору. Как только он достиг цитозоля, RanGTP может быть гидролизован до RanGDP, позволяя высвободить груз экспортина.
Некоторые заболевания связаны с патологиями нуклеопоринов, особенно с диабетом, первичным билиарным циррозом, болезнью Паркинсона и болезнью Альцгеймера. Было показано, что сверхэкспрессия генов, кодирующих различные нуклеопорины, связана с образованием раковых опухолей.
Было показано, что нуклеопорины очень чувствительны к изменениям концентрации глюкозы. Следовательно, люди, страдающие диабетом, часто обнаруживают повышенное гликозилирование нуклеопоринов, особенно нуклеопорина 62.
Аутоиммунные состояния, такие как антитела против p62, которые ингибируют комплексы p62, связаны с первичным билиарным циррозом, который разрушает желчные протоки печени.
Снижение продукции комплекса p62 характерно для многих нейродегенеративных заболеваний. Модификация промотора p62 путем окисления коррелирует с болезнью Альцгеймера, болезнь Хантингтона и болезнь Паркинсона среди других нейродегенеративных расстройств.
Повышенная экспрессия гена NUP88, который кодирует нуклеопорин 88, обычно обнаруживается при предраковых дисплазиях и злокачественных новообразованиях.
Нуклеопориновый белок аладин является компонентом комплекса ядерных пор. Мутации в гене аладина ответственны за синдром тройного А, аутосомно- рецессивное нейроэндокринологическое заболевание. Мутантный аладин вызывает избирательное нарушение импорта ядерного белка и гиперчувствительность к окислительному стрессу. Импорт репарации ДНК белков aprataxin и ДНК - лигазы I селективно уменьшается, и это может повысить уязвимость клетки ДНК к окислительному стрессу, индуцированные повреждениям, что смерть клеток триггера.
Каждый отдельный нуклеопорин назван в соответствии с его молекулярной массой (в килодальтонах ). Ниже приведены несколько примеров белков семейства нуклеопоринов: