 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название IUPAC Тетракарбонилникель | |||
| Другие имена Никель тетракарбонил. Карбонил никеля | |||
| Идентификаторы | |||
| Номер CAS | |||
| 3D-модель (JSmol ) | |||
| Ссылка Beilstein | 6122797 | ||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.033.322 | ||
| Номер EC |
| ||
| Справочник Гмелина | 3135 | ||
| PubChem CID | |||
| номер RTECS |
| ||
| UNII | |||
| номер ООН | 1259 | ||
| CompTox Dashboard (EPA ) | |||
InChI
| |||
УЛЫБАЕТСЯ
| |||
| Свойства | |||
| Химическая формула | Ni (CO) 4 | ||
| Молярная масса | 170,73 г / моль | ||
| Внешний вид | бесцветная жидкость uid. | ||
| Запах | затхлый, как кирпичная пыль | ||
| Плотность | 1,319 г / см | ||
| Температура плавления | -17,2 ° C (1,0 ° F; 256,0 K) | ||
| Точка кипения | 43 ° C (109 ° F; 316 K) | ||
| Растворимость в воде | 0,018 г / 100 мл (10 ° C) | ||
| Растворимость | смешивается с большинство органических растворителей. растворимы в азотной кислоте, царской водке | ||
| Давление пара | 315 мм рт.ст. (20 ° C) | ||
| вязкость | 3,05 x 10 Па · с | ||
| Структура | |||
| Координационная геометрия | Тетраэдрическая | ||
| Молекулярная форма | Тетраэдрическая | ||
| Дипольный момент | ноль | ||
| Термохимия | |||
| Стандартная молярная. энтропия (S 298) | 320 ДжК моль | ||
| Стандартная энтальпия. образования (ΔfH298) | −632 кДж / моль | ||
| Стандартная энтальпия. горения (ΔcH298) | −1180 кДж / моль | ||
| Опасности | |||
| Паспорт безопасности | ICSC 0064 | ||
| Пиктограммы GHS |     | ||
| Предупреждения об опасности GHS | H225, H300, H310, H330, H351, H360D, H400, H410 | ||
| Меры предосторожности GHS | P201, P202, P210, P233, P240, P241, P242, P243, P260, P2 71, P273, P280, P281, P284, P303 + 361 + 353, P304 + 340, P308 + 313, P310, P320, P370 + 378, P391, P403 + 233, P403 + 235, P405, P501 | ||
| NFPA 704 (огненный алмаз) |  3 4 3 3 4 3 | ||
| Температура вспышки | 4 ° C (39 ° F; 277 K) | ||
| Самовоспламенение. температура | 60 ° C (140 ° F; 333 K) | ||
| Пределы взрываемости | 2–34% | ||
| Смертельная доза или концентрация (LD, LC): | |||
| LC50(средняя концентрация ) | 266 частей на миллион (кошка, 30 минут). 35 частей на миллион (кролик, 30 минут). 94 частей на миллион (мышь, 30 минут). 10 частей на миллион (мышь, 10 минут) | ||
| LCLo(самый низкий из опубликованных ) | 360 ppm (собака, 90 мин). 30 ppm (человек, 30 мин). 42 ppm (кролик, 30 мин). 7 ppm (мышь, 30 мин) | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
| PEL (допустимый) | TWA 0,001 ppm (0,007 мг / м) | ||
| REL (рекомендуется) | TWA 0,001 ppm (0,007 мг / м) | ||
| IDLH (Непосредственная опасность) | Ca [2 ppm] | ||
| Родственные соединения | |||
| Родственные карбонилы металлов | Пентакарбонил железа. Дикобальт октакарбонил | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки в ink | |||
Карбонил никеля (IUPAC название: тетракарбонилникель ) - это никельорганический продукт. фунт по формуле Ni (CO) 4. Эта бесцветная жидкость является основным карбонилом никеля. Он является промежуточным звеном в процессе Монда для получения очень высокой чистоты никеля и реагентом в металлоорганической химии, хотя процесс Монда вышел из общего использования. из-за опасности для здоровья при работе с компаундом. Карбонил никеля - одно из наиболее опасных веществ, встречающихся в химии никеля, из-за его очень высокой токсичности, высокой летучести и быстрого поглощения кожей.
В тетракарбониле никеля степень окисления никеля принимается равной нулю. Формула соответствует правилу 18-электронов. Молекула является тетраэдрической с четырьмя карбонильными (монооксидом углерода ) лигандами. Электронная дифракция была проведена на этой молекуле, и расстояния Ni – C и C – O были рассчитаны и составили 1,838 (2) и 1,141 (2) ангстрем соответственно.
Ni (CO) 4 был впервые синтезирован в 1890 году Людвигом Мондом путем прямой реакции металлического никеля с CO. Эта новаторская работа предвосхитила существование многих других карбонильные соединения металлов, включая соединения V, Cr, Mn, Fe и Co. К концу XIX века он также применялся в промышленности для очистки никеля.
При 323 K (50 ° C; 122 ° F), окись углерода проходит через нечистый никель. Оптимальная скорость достигается при 130 ° С.
Ni (CO) 4 коммерчески недоступны. Его обычно получают в лаборатории путем карбонилирования коммерчески доступного бис (циклооктадиен) никеля (0). Его также можно получить восстановлением аммиачных растворов сульфата никеля дитионитом натрия в атмосфере CO.
 Сферы никеля, полученные по процессу Монда
Сферы никеля, полученные по процессу Монда При умеренном нагревании Ni (CO) 4 разлагается до монооксида углерода и металлического никеля. В сочетании с легким образованием CO и даже очень загрязненного никеля, это разложение является основой для процесса Mond для очистки никеля или нанесения покрытия на поверхности. Термическое разложение начинается около 180 ° C и увеличивается при более высокой температуре.
Подобно карбонилам других низковалентных металлов, Ni (CO) 4 подвержен атаке нуклеофилов. Атака может происходить по центру никеля, что приводит к замещению лигандов CO, или по CO. Таким образом, донорные лиганды, такие как трифенилфосфин, реагируют с образованием Ni (CO) 3 (PPh 3) и Ni (CO) 2 (PPh 3)2. бипиридин и родственные лиганды ведут себя аналогичным образом. Монозамещение тетракарбонила никеля другими лигандами можно использовать для определения Tolman электронный параметр, мера способности данного лиганда отдавать или отводить электроны.
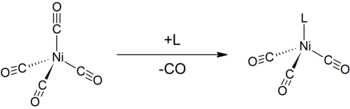
Обработка гидроксидами дает кластеры, такие как [Ni 5 (CO) 12 ] и [Ni 6 (CO) 12 ]. Эти соединения также могут быть получены восстановлением карбонила никеля.
Таким образом, обработка Ni (CO) 4 с нуклеофилами углерода (Nu) приводит к ацильным производным, таким как [Ni (CO) 3 C (O) Nu)].
Карбонил никеля может быть окислен. Хлор окисляет карбонил никеля до NiCl 2, выделяя газообразный CO. Аналогично ведут себя и другие галогены. Эта реакция представляет собой удобный метод осаждения никелевой части токсичного соединения.
Реакции Ni (CO) 4 с алкил и арилгалогенидами часто приводят к карбонилированным органическим продуктам. Виниловые галогениды, такие как PhCH = CHBr, превращаются в ненасыщенные сложные эфиры при обработке Ni (CO) 4, а затем метоксидом натрия. Такие реакции также, вероятно, протекают через окислительное присоединение. Аллильные галогениды дают соединения π-аллилникеля, такие как (аллил) 2Ni2Cl2:
Опасности, связанные с Ni (CO) 4 намного больше, чем подразумевается в его содержании CO, отражая эффекты никеля, если он высвобождается в организме. Карбонил никеля может быть смертельным при всасывании через кожу или, что более вероятно, при вдыхании из-за его высокой летучести. Его LC50 для 30-минутного воздействия оценивается на уровне 3 ppm, а концентрация, которая является немедленно смертельной для человека, будет 30 ppm. Некоторые субъекты, подвергшиеся воздействию затяжек до 5 ppm, описали запах затхлый или сажистый, но поскольку это соединение чрезвычайно токсично, его запах не обеспечивает надежного предупреждения о потенциально смертельном воздействии.
Пары Ni (CO) 4 могут самовозгорание. Пар быстро разлагается на воздухе с периодом полураспада около 40 секунд.
Карбюратор никеля Отравление онилом характеризуется двухэтапным течением болезни. Первый состоит из головных болей и боли в груди, продолжающихся несколько часов, обычно с последующей короткой ремиссией. Вторая фаза - это химический пневмонит, который обычно начинается через 16 часов с симптомов кашля, одышки и сильной усталости. Они достигают наибольшей степени тяжести через четыре дня, что может привести к смерти от кардиореспираторного заболевания или острого повреждения почек. Выздоровление часто бывает чрезвычайно длительным, часто осложняется истощением, депрессией и одышкой при физической нагрузке. Постоянное поражение органов дыхания - явление необычное. канцерогенность Ni (CO) 4 является предметом дискуссий, но предполагается, что она значительна.
Он классифицируется как чрезвычайно опасное вещество в Соединенных Штатах, как определено в разделе 302 США Закона США о чрезвычайном планировании и праве на информацию (42 USC 11002) и подчиняется строгим требованиям отчетности со стороны предприятий, которые производят, хранят или используют его в значительных количествах.
Реквием по жизни (1978), эпизод из Куинси, ME, изображает отравленного умирающего криминального авторитета, который просит доктора Куинси провести вскрытие его еще живого тела. Куинси определяет яд - карбонил никеля.