| Ариламин-N-ацетилтрансфераза 2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 3D-изображение человеческой N-ацетилтрансферазы 2 3D-изображение человеческой N-ацетилтрансферазы 2 | |||||||||
| Идентификаторы | |||||||||
| EC номер | 2.3.1.5 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | Запись BRENDA | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| KEGG | запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
N-ацетилтрансфераза (NAT) - это фермент, который катализирует перенос ацетильных групп от ацетил-СоА до ариламинов, арилгидроксиламинов и арилгидразинов. Они обладают широкой специфичностью в отношении ароматических аминов, особенно серотонина, а также могут катализировать перенос ацетила между ариламинами без CoA. N-ацетилтрансферазы - это цитозольные ферменты, обнаруженные в печени и многих тканях большинства видов млекопитающих, за исключением собак и лисиц, которые не могут ацетилировать ксенобиотики. Ацетильные группы играют важную роль в конъюгации метаболитов из печени, обеспечивая выведение побочных продуктов (метаболизм II фазы ). Это особенно важно при метаболизме и выведении лекарственных продуктов (метаболизм лекарств ).
Ферменты NAT различаются по наличию консервативной каталитической триады, которая благоприятствует субстратам ароматического амина и гидразина. NAT катализируют ацетилирование небольших молекул посредством реакции двойного замещения, называемой реакцией пинг-понг-би-би. Механизм состоит из двух последовательных реакций. В реакции один ацетил-КоА сначала связывается с ферментом и ацетилирует Cys. Во второй реакции после высвобождения ацетил-CoA акцептор ацетила взаимодействует с ацетилированным ферментом с образованием продукта. Эта вторая реакция не зависит от донора ацетила, поскольку она покидает фермент до связывания акцептора ацетила. Однако, как и во многих реакциях пинг-понг би би, возможно, существует конкуренция между донором ацетила и акцептором ацетила за неацетилированный фермент. Это приводит к субстрат-зависимому ингибированию при высоких концентрациях.
 Описание механизма фермента N-ацетилтрансферазы.
Описание механизма фермента N-ацетилтрансферазы. 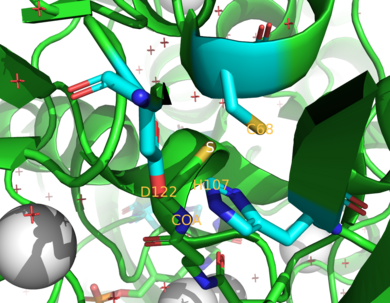 Трехмерное изображение активного центра NAT2 и каталитической триады.
Трехмерное изображение активного центра NAT2 и каталитической триады. Два фермента NAT у людей это NAT1 и NAT2. Мыши и крысы экспрессируют три фермента: NAT1, NAT2 и NAT3. Было обнаружено, что NAT1 и NAT2 тесно связаны между собой у исследованных видов, поскольку эти два фермента имеют 75-95% общей аминокислотной последовательности. Оба также имеют активный сайт остаток цистеина (Cys) в N-концевой области. Кроме того, все функциональные ферменты NAT содержат триаду каталитически необходимых остатков, состоящую из этого цистеина, гистидина и аспарагина. Была выдвинута гипотеза, что каталитические эффекты рака груди лекарства цисплатин связаны с Cys. Инактивация NAT1 цисплатином вызывается необратимым образованием аддукта цисплатина с остатком цистеина в активном центре. С-конец помогает связывать ацетил-КоА и отличается среди NAT, включая прокариотические гомологи.
NAT1 и NAT2 имеют разные, но перекрывающиеся субстратные специфичности. Человеческий NAT1 преимущественно ацетилирует 4-аминобензойную кислоту (PABA), 4-аминосалициловую кислоту, сульфаметоксазол и сульфаниламид. Человеческий NAT2 предпочтительно ацетилирует изониазид (лечение туберкулеза ), гидралазин, прокаинамид, дапсон, аминоглутетимид и сульфаметазин.
NAT2 участвует в метаболизме ксенобиотиков, что может приводить как к инактивации наркотики и образование токсичных метаболитов, которые могут быть канцерогенными. Биотрансформация ксенобиотиков может происходить в три фазы. В фазе I реактивные и полярные группы вводятся в подложки. В фазе II происходит конъюгация ксенобиотиков с заряженными частицами, а в фазе III вносятся дополнительные модификации с механизмами оттока, ведущими к экскреции переносчиками. Исследование общегеномной ассоциации (GWAS) идентифицировало человеческий NAT2 как главный сигнал для инсулинорезистентности, ключевой маркер диабета и главный фактор риска сердечно-сосудистых заболеваний и было показано, что она связана с инсулинорезистентностью всего тела у мышей с нокаутом NAT1 . Считается, что NAT1 играет эндогенную роль, вероятно, связанную с фундаментальным клеточным метаболизмом. Это может быть связано с тем, почему NAT1 более широко распространен среди тканей, чем NAT2.
Каждый человек метаболизирует ксенобиотики с разной скоростью, что является результатом полиморфизма генов метаболизма ксенобиотиков . И NAT1, и NAT2 кодируются двумя высокополиморфными генами, расположенными на хромосоме 8. Полиморфизм NAT2 был одним из первых вариантов, объясняющих эту межиндивидуальную вариабельность метаболизма лекарственного средства. Эти полиморфизмы изменяют стабильность и / или каталитическую активность ферментов, которые изменяют скорость ацетилирования лекарств и ксенобиотиков, что называется ацетилирующим фенотипом. Для NAT2 фенотип ацетилирования описывается как медленный, промежуточный или быстрый. Помимо изменения ферментативной активности, эпидемиологические исследования обнаружили связь полиморфизма NAT2 с различными видами рака, вероятно, из-за различных канцерогенов окружающей среды.
Действительно, NAT2 является высокополиморфным в нескольких популяциях людей. Полиморфизмы NAT2 включают одиночные аминокислотные замены R64Q, I114T, D122N, L137F, Q145P, R197Q и G286E. Они классифицируются как медленные ацетилирующие вещества, тогда как NAT2 дикого типа классифицируется как быстрый ацетилирующий агент. Медленные ацетилирующие вещества, как правило, связаны с токсичностью лекарств и предрасположенностью к раку. Например, генотип медленного ацетилирования NAT2 связан с повышенным риском рака мочевого пузыря, особенно среди курильщиков сигарет. Однонуклеотидные полиморфизмы (SNP) NAT1 включают R64W, V149I, R187Q, M205V, S214A, D251V, E26K и I263V и связаны с генетической предрасположенностью к раку, врожденными дефектами и другими заболеваниями. Эффект медленных ацетилирующих SNP в кодирующей области преимущественно действует через создание нестабильного белка, который агрегируется внутриклеточно до убиквитинирования и деградации.
50% британских у населения наблюдается дефицит N-ацетилтрансферазы печени. Это известно как отрицательный статус ацетилирования. При этом действуют следующие лекарственные средства:
Побочные эффекты от этого дефицита включают периферическая невропатия и гепатоксичность. Самый медленный ацетилирующий гаплотип, NAT2 * 5B (самая сильная ассоциация с раком мочевого пузыря ), по-видимому, был выбран за последние 6500 лет у жителей Западной и Центральной Евразии, что предполагает медленное ацетилирование. эволюционное преимущество для этой популяции, несмотря на недавние неблагоприятные эпидемиологические данные о состоянии здоровья.
Ниже приводится список человеческих генов, которые кодируют ферменты N-ацетилтрансферазы:
| Символ | Название |
|---|---|
| AANAT | аралкиламин N-ацетилтрансфераза |
| ARD1A | гомолог A ARD1, N-ацетилтрансфераза (S. cerevisiae) |
| глюкозамин-фосфат N-ацетилтрансфераза 1 | |
| HGSNAT | гепаран-альфа-глюкозаминид N-ацетилтрансфераза |
| гомолог MAK10, аминокислотная субъединица N-ацетилтрансферазы (S. cerevisiae) | |
| NAT1 | N-ацетилтрансфераза 1 (ариламин-N-ацетилтрансфераза) |
| NAT2 | N-ацетилтрансфераза 2 (ариламин-N-ацетилтрансфераза) |
| NAT5 | N-ацетилтрансфераза 5 (связанная с GCN5, предположительно) |
| NAT6 | N-ацетилтрансфераза 6 (связанная с GCN5) |
| NAT8 | N-ацетилтрансфераза 8 (связанная с GCN5, предположительно) |
| N-ацетилтрансфераза 8-подобная (связанная с GCN5, предположительно) | |
| NAT9 | N-ацетилтрансфераза 9 (связанная с GCN5, предположительно) |
| NAT10 | N-ацетилтрансфераза 10 (связанная с GCN5) |
| N-ацетилтрансфераза 11 (связанная с GCN5, предположительно) | |
| N-ацетилтрансфераза 12 (GCN5 -связанная, предположительно) | |
| N-ацетилтрансфераза 13 (связанная с GCN5) | |
| N-ацетилтрансфераза 14 (связанная с GCN5, предположительно) | |
| N-ацетилтрансфераза 15 (связанная с GCN5, предположительно) |