Массивы микроэлектродов (MEAs ) (также называемые массивами многоэлектродов) - это устройства, содержащие несколько (от десятков до тысяч) микроэлектроды, через которые нейронные сигналы получают или доставляют, по существу служащие в качестве нейронных интерфейсов, соединяющих нейроны с электронными схемами. Существует два основных класса MEA: имплантируемые MEA, используемые in vivo, и неимплантируемые MEA, используемые in vitro.
Нейроны и мышечные клетки создают ионные токи через свои мембраны при возбуждении, вызывая изменение напряжения между внутренней и внешней стороной ячейки. При записи электроды на MEA преобразовывают изменение напряжения из окружающей среды, переносимое ионами , в токи, переносимые электроны (электронные токи). При стимуляции электроды преобразуют электронные токи в ионные токи через среду. Это запускает потенциалзависимые ионные каналы на мембранах возбудимых клеток, заставляя клетку деполяризоваться и запускать потенциал действия если это нейрон, или подергивание, если это мышечная клетка.
Размер и форма записанного сигнала зависят от нескольких факторов: природы среды, в которой находится клетка или клетки (например, электропроводность среды, емкость и однородность ); характер контакта между элементами и электродом МЭБ (например, площадь контакта и герметичность); характер самого электрода MEA (например, его геометрия, импеданс и шум); обработка аналогового сигнала (например, системное усиление, полоса пропускания и поведение за пределами частот среза ); и свойства выборки данных (например, частота выборки и обработка цифрового сигнала ). Для записи одиночной ячейки, которая частично покрывает плоский электрод, напряжение на контактной площадке приблизительно равно напряжению области перекрытия ячейки и электрода, умноженному на отношение поверхности площадь перекрывающейся области до площади всего электрода, или:
при условии, что область вокруг электрода хорошо изолирована и имеет очень небольшую емкость, связанную с этим. Вышеприведенное уравнение, однако, основано на моделировании электрода, ячеек и их окружения как эквивалентной принципиальной схемы. Альтернативным средством прогнозирования поведения электрода и ячейки является моделирование системы с использованием геометрического анализа конечных элементов в попытке обойти ограничения чрезмерного упрощения системы в виде сосредоточенной элементной схемы.
MEA можно использовать для выполнения электрофизиологических экспериментов на срезах ткани или. В случае острых срезов ткани связи между клетками внутри срезов ткани до экстракции и посева более или менее сохраняются, в то время как межклеточные связи в диссоциированных культурах разрушаются до посева. С диссоциированными культурами нейронов нейроны спонтанно образуют сети.
. Можно видеть, что напряжение амплитуда, которое испытывает электрод, обратно пропорционально расстоянию, с которого клетка деполяризуется.. Таким образом, может потребоваться культивирование клеток или размещение иным способом как можно ближе к электродам. В случае срезов ткани вокруг места разреза образуется слой электрически пассивных мертвых клеток из-за отека. Способом справиться с этим является изготовление МЭБ с трехмерными электродами, изготовленными путем маскировки и химического травления. Эти трехмерные электроды проникают в слой мертвых клеток ткани среза, уменьшая расстояние между живыми клетками и электродами. В диссоциированных культурах правильная адгезия клеток к субстрату MEA важна для получения надежных сигналов.
Первыми имплантируемыми решетками были решетки из микропроводов, разработанные в 1950-х годах. Первый эксперимент с использованием набора плоских электродов для записи данных из культивируемых клеток был проведен в 1972 году C.A. Томас-младший и его коллеги. В экспериментальной установке использовалась матрица 2 x 15 из золотых электродов, покрытых платино-черным, каждый на расстоянии 100 мкм друг от друга. Миоциты, собранные от эмбриональных цыплят, диссоциировали и культивировали на MEAs, и регистрировали сигналы с высокой амплитудой до 1 мВ. MEA были сконструированы и использовались для независимого изучения электрофизиологии ганглиев улитки и его коллегами из Центра сетевой нейробиологии в 1977 году без предварительного знания работы Томаса и его коллег. В 1982 году Гросс наблюдал спонтанную электрофизиологическую активность диссоциированных нейронов спинного мозга и обнаружил, что активность очень зависит от температуры. Амплитуды сигнала ниже 30 ° C быстро уменьшаются до относительно небольшого значения при комнатной температуре.
. До 1990-х годов для новых лабораторий, которые стремились проводить исследования MEA, существовали значительные входные барьеры из-за пользовательских MEA. изготовление и программное обеспечение, которое они должны были разработать. Однако с появлением доступных вычислительных мощностей и коммерческого оборудования и программного обеспечения MEA многие другие лаборатории смогли проводить исследования с использованием MEA. Этот неинвазивный электрофизиологический лабораторный метод может быть более эффективным, чем метод патч-зажим.
Массивы микроэлектродов можно разделить на подкатегории в зависимости от их потенциального использования: массивы in vitro и in vivo.
 МЭА in vitro
МЭА in vitro Стандартный тип МЭА in vitro состоит из электродов 8 x 8 или 6 x 10. Электроды обычно состоят из оксида индия и олова или титана и имеют диаметр от 10 до 30 мкм. Эти массивы обычно используются для одноклеточных культур или острых срезов головного мозга.
Одной из проблем среди МЭА in vitro было получение изображений с помощью микроскопов, в которых используются линзы с большим увеличением, требующие низкого порядка микрометров. Чтобы избежать этой проблемы, были созданы «тонкие» -MEA с использованием покровного стекла. Эти массивы имеют размер примерно 180 мкм, что позволяет использовать их с линзами большой мощности.
В другой специальной конструкции 60 электродов разделены на группы 6 × 5, разделенные 500 мкм. Электроды в группе разделены на 30 мкм при диаметрах 10 мкм. Такие массивы используются для изучения локальных ответов нейронов, а также для изучения функциональной связности органотипических срезов.
Пространственное разрешение является одним из ключевых преимуществ MEAs и позволяет принимать сигналы, отправленные на большие расстояния, с более высокой точностью. точность при использовании МЭБ высокой плотности. Эти массивы обычно имеют квадратную сетку из 256 электродов, которые покрывают площадь 2,8 на 2,8 мм.
Повышенное пространственное разрешение обеспечивается матрицами микроэлектродов высокой плотности на основе КМОП с тысячами электродов, а также встроенным считывающим устройством и схемы стимуляции на компактных чипах размером с ноготь. Было продемонстрировано даже разрешение сигналов, распространяющихся по одиночным аксонам.
Для получения качественных сигналов электроды и ткань должны находиться в тесном контакте друг с другом. Перфорированная конструкция МЭБ прикладывает отрицательное давление к отверстиям в подложке, так что срезы ткани могут быть размещены на электродах для улучшения контакта и регистрируемых сигналов.
Другой подход к снижению импеданса электрода - это путем модификации материала интерфейса, например, с использованием углеродных нанотрубок, или путем модификации структуры электродов, например, с помощью золотых наностолбиков или нанополостей.
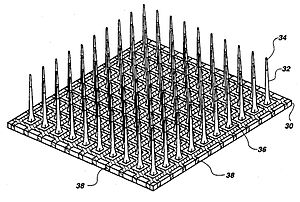 Схема электродной матрицы in vivo «Юта»
Схема электродной матрицы in vivo «Юта» Три основных категории имплантируемых МЭБ: микропровода, на основе кремния и гибкие матрицы микроэлектродов. Микропровода MEA в основном изготовлены из нержавеющей стали или вольфрама, и их можно использовать для оценки положения отдельных зарегистрированных нейронов с помощью триангуляции. Матрицы микроэлектродов на основе кремния включают две конкретные модели: матрицы Мичигана и Юты. Матрицы Michigan обеспечивают более высокую плотность сенсоров для имплантации, а также более высокое пространственное разрешение, чем микропроволочные MEA. Они также позволяют получать сигналы по длине стержня, а не только на концах стержня. В отличие от решеток из Мичигана, в Юте массивы трехмерны и состоят из 100 проводящих кремниевых игл. Однако в матрице Utah сигналы принимаются только от кончиков каждого электрода, что ограничивает объем информации, которую можно получить за один раз. Кроме того, массивы Utah производятся с заданными размерами и параметрами, в то время как массив Michigan обеспечивает большую свободу проектирования. Гибкие матрицы, изготовленные из полиимида, парилена или бензоциклобутена, имеют преимущество перед жесткими матрицами микроэлектродов, поскольку они обеспечивают более точное механическое соответствие, как Модуль Юнга кремния намного больше, чем у ткани мозга, что способствует воспалению, вызванному сдвигом.
Фундаментальной единицей связи нейронов является, по крайней мере, электрическая, потенциал действия. Этот феномен «все или ничего» возникает на бугре аксона, что приводит к деполяризации внутриклеточной среды, которая распространяется вниз по аксону . Этот ионный поток через клеточную мембрану вызывает резкое изменение напряжения во внеклеточной среде, что в конечном итоге и обнаруживают электроды MEA. Таким образом, подсчет и сортировка скачков напряжения часто используются в исследованиях для характеристики сетевой активности. Анализ пикового шлейфа также может сэкономить время обработки и вычислительную память по сравнению с измерениями напряжения. Временные метки всплесков определяются как моменты времени, когда напряжение, измеренное отдельным электродом, превышает пороговое значение (часто определяемое стандартными отклонениями от среднего значения периода бездействия). Эти временные метки могут быть дополнительно обработаны для идентификации всплесков (множественные всплески в непосредственной близости). Дальнейший анализ этих последовательностей может выявить организацию спайков и временные закономерности.
В целом, основные сильные стороны массивов in vitro по сравнению с более традиционными методами, такими как как фиксация патча включает:
Кроме того, массивы in vitro неинвазивны по сравнению с фиксацией пластыря, поскольку они не требуют нарушения клеточной мембраны.
Однако по отношению к массивам in vivo основным преимуществом перед фиксацией заплат является высокое пространственное разрешение. Имплантируемые массивы позволяют получать сигналы от отдельных нейронов, обеспечивая такую информацию, как положение или скорость двигательного движения, которые можно использовать для управления протезом устройством. Крупномасштабные параллельные записи с десятками имплантированных электродов возможны, по крайней мере, у грызунов, во время поведения животных. Это делает такие внеклеточные записи методом выбора для идентификации нейронных цепей и изучения их функций. Однако однозначная идентификация зарегистрированного нейрона с использованием многоэлектродных внеклеточных массивов до сих пор остается проблемой.
МЭА in vitro менее подходят для регистрации и стимуляции отдельных клеток из-за их низкого пространственного разрешения по сравнению с патч-зажимом и системами. Сложность сигналов, которые электрод MEA может эффективно передавать другим ячейкам, ограничена по сравнению с возможностями динамических зажимов.
Существует также несколько биологических реакций на имплантацию матрицы микроэлектродов, особенно в отношении хронической имплантации. Наиболее заметными среди этих эффектов являются потеря нейрональных клеток, рубцевание глии и уменьшение количества функционирующих электродов. Реакция ткани на имплантацию зависит от многих факторов, включая размер стержней MEA, расстояние между стержнями, состав материала MEA и период времени введения. Ответ ткани обычно делится на краткосрочный и долгосрочный. Кратковременный ответ возникает в течение нескольких часов после имплантации и начинается с увеличения популяции астроцитов и глиальных клеток, окружающих устройство. Рекрутированная микроглия затем инициирует воспаление, и начинается процесс фагоцитоза чужеродного материала. Со временем астроциты и микроглия, набранные на устройство, начинают накапливаться, образуя оболочку, окружающую матрицу, которая простирается на десятки микрометров вокруг устройства. Это не только увеличивает пространство между электродными зондами, но также изолирует электроды и увеличивает измерения импеданса. Проблемы с хронической имплантацией массивов стали движущей силой в исследовании этих устройств. В одном новом исследовании изучались нейродегенеративные эффекты воспаления, вызванного хронической имплантацией. Иммуногистохимические маркеры показали неожиданное присутствие гиперфосфорилированного тау-белка, индикатора болезни Альцгеймера, рядом с место записи электродов. Фагоцитоз электродного материала также ставит под сомнение вопрос о реакции биосовместимости, которая, как показывают исследования, была незначительной и практически отсутствовала через 12 недель in vivo. Исследования, направленные на минимизацию негативных последствий введения устройства, включают покрытие поверхности устройств белками, которые способствуют прикреплению нейронов, такими как ламинин или лекарственные элюирующие вещества.
Природа диссоциированных нейронных сетей, по-видимому, не меняет или не уменьшает характер его фармакологического ответа по сравнению с in vivo модели, предполагающие, что MEAs можно использовать для изучения фармакологического воздействия на диссоциированные культуры нейронов в более простой контролируемой среде. Ряд фармакологических исследований с использованием MEAs на диссоциированных нейронных сетях, например исследования с этанолом.
Кроме того, был проведен значительный объем работ по различным биофизическим аспектам сетевой функции путем сведения явлений, обычно изучаемых на поведенческом уровне, к уровню диссоциированной корковой сети. Например, способность таких сетей извлекать пространственные и временные характеристики различных входных сигналов, динамику синхронизации, чувствительность к нейромодуляции и кинетику обучения с использованием режимов замкнутого цикла. Наконец, сочетание технологии MEA с конфокальной микроскопией позволяет изучать взаимосвязь между сетевой активностью и синаптическим ремоделированием.
MEA используются для взаимодействия нейронных сетей с небиологическими системами в качестве контроллера. Например, нейро-компьютерный интерфейс может быть создан с использованием MEA. Диссоциированные корковые нейроны крысы были интегрированы в замкнутую петлю обратной связи «стимул-ответ» для управления аниматом в виртуальной среде. Система замкнутого цикла «стимул-ответ» также была построена с использованием MEA Поттером, Мандхаваном и ДеМарсом, а также Марком Хаммондом, Кевином Уорвиком и Беном Уолли в статье Университет Ридинга. Около 300000 диссоциированных нейронов крысы помещали на MEA, который был подключен к двигателям и ультразвуковым датчикам на роботе и был подготовлен для избежания препятствий при обнаружении. В этом направлении Шимон Маром и его коллеги из Техниона подключили диссоциированные нейронные сети, растущие на MEA, к роботу Lego Mindstorms ; поле зрения робота было классифицировано сетью, и команды были доставлены на колеса робота, так что он полностью избегал столкновения с препятствиями. Этот «автомобиль Брайтенберга» использовался для демонстрации неопределенности обратной нейроинженерии, показывая, что даже в простой настройке с практически неограниченным доступом к каждой части соответствующей информации невозможно было вывести с уверенностью конкретную схему нейронного кодирования, которая использовалась для управления поведением роботов.
MEAs были использованы для наблюдения за сетевым возбуждением в гиппокампе срезов.
В настоящее время существует несколько имплантируемых интерфейсов, доступных для использования потребителями. включая стимуляторы глубокого мозга, кохлеарные имплантаты и кардиостимуляторы. Стимуляция глубокого мозга (DBS) была эффективна при лечении двигательных нарушений, таких как болезнь Паркинсона, а кохлеарные имплантаты помогли многим улучшить их слух, стимулируя слуховой нерв. Благодаря своему замечательному потенциалу, MEAs являются важной областью исследований в области нейробиологии. Исследования показывают, что MEAs могут дать представление о таких процессах, как формирование памяти и восприятие, а также могут иметь терапевтическую ценность для таких состояний, как эпилепсия, депрессия и обсессивно-компульсивное расстройство. Клинические испытания с использованием интерфейсных устройств для восстановления моторного контроля после травмы спинного мозга или для лечения БАС были начаты в рамках проекта под названием BrainGate (см. Видеодемонстрацию: BrainGate ). MEA обеспечивают высокое разрешение, необходимое для записи изменяющихся во времени сигналов, что дает им возможность использовать как для управления, так и для получения обратной связи от протезных устройств, как показали Кевин Уорвик, Марк Гассон и Питер Киберд. Исследования показывают, что использование MEA может помочь в восстановлении зрения за счет стимуляции оптического пути.
Раз в два года научные встречи пользователей проводятся в Ройтлингене, организованный Институтом естественных и медицинских наук (NMI) при Тюбингенском университете. На встречах предлагается всесторонний обзор всех аспектов, связанных с новыми разработками и текущими приложениями микроэлектродных массивов в фундаментальной и прикладной нейробиологии, а также в области промышленных лекарств, фармакологии безопасности и нейротехнологии. Конференция, проводимая два раза в год, превратилась в международную площадку для ученых, разрабатывающих и использующих МПС как в промышленности, так и в академических кругах, и признана качественным научным форумом, насыщенным информацией. Вклады в собрание доступны в виде сборников с открытым доступом.
Помимо использования в научных целях, МПС использовались в современном искусстве для исследования философских вопросов о взаимосвязи между технологией и биологией. Традиционно в западной мысли биология и технология были разделены на две отдельные категории: bios и technê. В 2002 году MEART: The Semi-live Artist был создан как совместное искусство и наука. проект между SymbioticA в Университете Западной Австралии в Перте и лабораторией Поттера в Технологическом институте Джорджии в Атланта, чтобы поставить под сомнение связь между биологией и технологиями. MEART состоял из нейронов коры головного мозга крысы, выращенных in vitro на MEA в Атланте, пневматической руки робота, способной рисовать ручками на бумаге в Перте, и программного обеспечения для управления связью между ними. Сигналы от нейронов передавались по замкнутому контуру между Пертом и Атлантой, когда MEA стимулировал пневматическую руку. MEART был впервые представлен публике на выставке Biofeel в Пертском институте современного искусства в 2002 году.