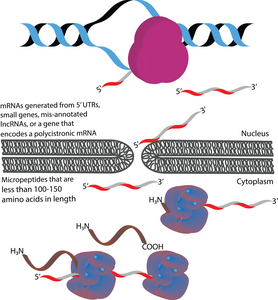
 Микропептиды можно транскрибировать из 5'UTR, малых генов, полицистронных мРНК или неправильно аннотированной днРНК. 413>Микропептиды (также называемые микропротеинами) - это полипептиды длиной менее 100-150 аминокислот, которые кодируются короткими открытыми рамками считывания (кОРС). В этом отношении они отличаются от многих других активных малых полипептидов, которые продуцируются посттрансляционным расщеплением более крупных полипептидов. По размеру микропептиды значительно короче «канонических» белков, которые имеют среднюю длину 330 и 449 аминокислот у прокариот и эукариот соответственно. Иногда микропептиды называют в соответствии с их геномным расположением. Например, транслированный продукт открытой рамки считывания (uORF) может называться кодируемым uORF пептидом (uPEP). У микропептидов отсутствуют N-концевые сигнальные последовательности, что позволяет предположить, что они, вероятно, локализованы в цитоплазме. Однако некоторые микропептиды были обнаружены в других компартментах клетки, на что указывает наличие трансмембранных микропептидов. Они обнаруживаются как у прокариот, так и у эукариот. КОРС, из которых транслируются микропептиды, могут кодироваться в 5 'UTR, малыми генами или полицистронными мРНК. Некоторые гены, кодирующие микропептиды, изначально были неправильно аннотированы как длинные некодирующие РНК (днРНК).
Микропептиды можно транскрибировать из 5'UTR, малых генов, полицистронных мРНК или неправильно аннотированной днРНК. 413>Микропептиды (также называемые микропротеинами) - это полипептиды длиной менее 100-150 аминокислот, которые кодируются короткими открытыми рамками считывания (кОРС). В этом отношении они отличаются от многих других активных малых полипептидов, которые продуцируются посттрансляционным расщеплением более крупных полипептидов. По размеру микропептиды значительно короче «канонических» белков, которые имеют среднюю длину 330 и 449 аминокислот у прокариот и эукариот соответственно. Иногда микропептиды называют в соответствии с их геномным расположением. Например, транслированный продукт открытой рамки считывания (uORF) может называться кодируемым uORF пептидом (uPEP). У микропептидов отсутствуют N-концевые сигнальные последовательности, что позволяет предположить, что они, вероятно, локализованы в цитоплазме. Однако некоторые микропептиды были обнаружены в других компартментах клетки, на что указывает наличие трансмембранных микропептидов. Они обнаруживаются как у прокариот, так и у эукариот. КОРС, из которых транслируются микропептиды, могут кодироваться в 5 'UTR, малыми генами или полицистронными мРНК. Некоторые гены, кодирующие микропептиды, изначально были неправильно аннотированы как длинные некодирующие РНК (днРНК).
Учитывая их небольшой размер, кОРС изначально не принимали во внимание. Однако сотни тысяч предполагаемых микропептидов были идентифицированы различными методами у множества организмов. Только небольшая часть из них с кодирующим потенциалом получила подтверждение своей экспрессии и функции. Те, которые были функционально охарактеризованы, как правило, играют роль в передаче сигналов клеток, органогенезе и клеточной физиологии. Чем больше обнаруживается микропептидов, тем больше их функций. Одной из регуляторных функций является функция пептопереключателей, которые ингибируют экспрессию нижестоящих кодирующих последовательностей, задерживая рибосомы посредством их прямой или косвенной активации небольшими молекулами.
Существуют различные экспериментальные методы для идентификации потенциальных s ORF и продуктов их трансляции. Эти методы полезны только для идентификации кОРС, которая может продуцировать микропептиды, но не для прямой функциональной характеристики.
Одним из методов обнаружения потенциальных кОРС и, следовательно, микропептидов является секвенирование РНК (RNA-Seq ). RNA-Seq использует секвенирование следующего поколения (NGS), чтобы определить, какие РНК экспрессируются в данной клетке, ткани или организме в определенный момент времени. Этот набор данных, известный как транскриптом, может затем использоваться в качестве ресурса для поиска потенциальных кОРС. Из-за высокой вероятности случайного возникновения кОРС менее 100 а.о. необходимы дальнейшие исследования для определения достоверности данных, полученных с помощью этого метода.
Профилирование рибосом используется для выявления потенциальных микропептидов у растущего числа организмов, включая плодовых мушек, рыбок данио, мышей и людей. В одном методе используются такие соединения, как харрингтонин, пуромицин или лактимидомицин, для остановки рибосом в сайтах инициации трансляции. Это указывает, где происходит активный перевод. Ингибиторы удлинения трансляции, такие как эметин или циклогексимид, также можно использовать для получения следов рибосомы, которые с большей вероятностью приведут к транслированной ORF. Если рибосома связана с кОРС или рядом с ней, она предположительно кодирует микропептид.
Масс-спектрометрия (MS) является золотым стандартом для идентификации и секвенирования белков. Используя этот метод, исследователи могут определить, действительно ли полипептиды транслируются с кОРС.
Протеогеномика объединяет протеомику, геномику и транскиптомику. Это важно при поиске потенциальных микропептидов. Один из методов использования протеогеномики предполагает использование данных RNA-Seq для создания настраиваемой базы данных всех возможных полипептидов. Для получения информации о последовательностях продуктов трансляции проводят жидкостную хроматографию с последующей тандемной масс-спектрометрией (LC-MS / MS). Сравнение транскриптомных и протеомных данных может быть использовано для подтверждения присутствия микропептидов.
Филогенетическая консервация может быть полезным инструментом, особенно при просмотре большой базы данных кОРС. Вероятность того, что кОРС приведет к образованию функционального микропептида, более высока, если он сохраняется у многих видов. Однако это не сработает для всех кОРС. Например, те, которые кодируются lncRNA, с меньшей вероятностью будут консервативными, поскольку сами lncRNA не обладают высокой консервативностью последовательности. Необходимы дальнейшие эксперименты, чтобы определить, действительно ли продуцируется функциональный микропептид.
Пользовательские антитела, нацеленные на интересующий микропептид, могут быть полезны для количественной оценки экспрессии или определения внутриклеточной локализации. Как и в случае с большинством белков, низкая экспрессия может затруднить обнаружение. Небольшой размер микропептида также может привести к трудностям в разработке эпитопа, из которого нацелено антитело.
может использоваться для добавления FLAG / MYC или других небольших пептидные метки к эндогенной кОРС, тем самым создавая слитые белки. В большинстве случаев этот метод выгоден тем, что его можно выполнить быстрее, чем разработка собственного антитела. Он также полезен для микропептидов, для которых нельзя нацелить эпитоп.
Этот процесс включает клонирование полноразмерной кДНК микропептида в плазмиду, содержащую промотор Т7 или SP6. В этом методе используется бесклеточная система синтеза белка в присутствии S-метионина для получения интересующего пептида. Затем продукты могут быть проанализированы с помощью гель-электрофореза, а S-меченный пептид визуализирован с помощью авторадиографии.
Существует несколько репозиториев и баз данных, которые были созданы как для кОРС, так и для микропептидов.. Репозиторий небольших ORF, обнаруженных с помощью профилирования рибосом, можно найти на сайте sORFs.org. Репозиторий предполагаемых кодируемых кОРС пептидов в Arabidopsis thaliana можно найти в ARA-PEPs. Базу данных малых белков, особенно кодируемых некодирующими РНК, можно найти на SmProt.
На сегодняшний день большинство микропептидов идентифицировано в прокариотических организмах. Хотя большинство из них еще предстоит полностью охарактеризовать, многие из них, по-видимому, имеют решающее значение для выживания этих организмов. Из-за своего небольшого размера прокариоты особенно восприимчивы к изменениям в окружающей их среде, и поэтому они разработали методы, обеспечивающие их существование.
Микропептиды, экспрессируемые в E. coli, служат примером бактериальной адаптации к окружающей среде. Большинство из них было разделено на три группы: лидерные пептиды, рибосомные белки и токсичные белки. Белки-лидеры регулируют транскрипцию и / или трансляцию белков, участвующих в метаболизме аминокислот, когда аминокислот не хватает. Рибосомные белки включают L36 (rpmJ) и L34 (rpmH), два компонента 50S субъединицы рибосомы. Токсичные белки, такие как ldrD, токсичны на высоких уровнях и могут убивать клетки или подавлять рост, что снижает жизнеспособность клетки-хозяина.
In S.. enterica фактор вирулентности MgtC участвует в адаптации к средам с низким содержанием магния. Гидрофобный пептид MgrR связывается с MgtC, вызывая его расщепление под действием протеазы FtsH.
Микропептид Sda из 46 аминокислотных остатков, экспрессируемый B. subtilis, подавляет споруляцию при нарушении инициации репликации. Ингибируя гистидинкиназу KinA, Sda предотвращает активацию фактора транскрипции Spo0A, который необходим для споруляции.
У S. aureus есть группа микропептидов, 20-22 а.о., которые выделяются во время инфекции хозяина, разрушая мембраны нейтрофилов, вызывая лизис клеток. Эти микропептиды позволяют бактерии избежать деградации под действием основных защитных сил иммунной системы человека.
Микропептиды были обнаружены в эукариотических организмах от Arabidopsis thaliana до человека. Они играют разнообразные роли в развитии тканей и органов, а также в поддержании и функционировании после полного развития. Хотя многие из них еще не охарактеризованы функционально и, вероятно, еще предстоит открыть, ниже приводится краткое изложение недавно идентифицированных функций эукариотических микропептидов.
Ген POLARIS (PLS) кодирует микропептид из 36 аминокислотных остатков. Это необходимо для правильного формирования сосудистого рисунка листка и расширения клеток в корне. Этот микропептид взаимодействует с онтогенетическими белками PIN, образуя критическую сеть для гормонального взаимодействия между ауксином, этиленом и цитокинином.
ROTUNDIFOLIA (ROT4) у A. thaliana кодирует пептид из 53 аминокислот, который локализуется на плазматической мембране клетки листа. Механизм функции ROT4 не совсем понятен, но мутанты имеют короткие округлые листья, что указывает на то, что этот пептид может играть важную роль в морфогенезе листа.
Brick1 (Brk1) кодирует микропептид из 76 аминокислот, который является высококонсервативным как у растений, так и у животных. У Z. mays было обнаружено, что он участвует в морфогенезе эпителия листа, способствуя множественным актин-зависимым событиям поляризации клеток в развивающемся эпидермисе листа. Zm401p10 представляет собой микропептид из 89 аминокислотных остатков, который играет роль в нормальном развитии пыльцы тапетума. После митоза он также играет важную роль в деградации тапетума. Zm908p11 представляет собой микропептид длиной 97 а.о., кодируемый геном Zm908, который экспрессируется в зрелых пыльцевых зернах. Он локализуется в цитоплазме пыльцевых трубок, где способствует их росту и развитию.
Эволюционно законсервированный ген полированного риса (pri), известный как tarsal -less (tal) у D. melanogaster участвует в дифференцировке эпидермиса. Этот полицистронный транскрипт кодирует четыре похожих пептида, длина которых составляет от 11 до 32 аминокислот. Они работают, чтобы усечь фактор транскрипции Shavenbaby (Svb). Это превращает Svb в активатор, который непосредственно регулирует экспрессию целевых эффекторов, включая миниатюрные (m) и бритоидные (sha), которые вместе ответственны за образование трихома.
Ген Toddler (tdl) считается важным для эмбриогенеза и специфически экспрессируется на поздних стадиях бластулы и гаструлы. Во время гаструляции это имеет решающее значение для стимулирования интернализации и движения мезэндодермальных клеток, направленного на анимальный полюс. После гаструляции он выражается в латеральной мезодерме, энтодерме, а также в передней и задней хорде. Несмотря на то, что она аннотирована как днРНК у рыбок данио, мышей и человека, кОРС из 58 аминокислотных остатков оказалась высококонсервативной у позвоночных.
(Mln) кодируется геном, первоначально аннотированным как днРНК. Mln экспрессируется во всех 3 типах скелетных мышц и работает аналогично микропептидам фосфоламбан (Pln) в сердечной мышце и сарколипин (Sln) в медленных (тип I) скелетных мышцах.. Эти микропептиды взаимодействуют с Са-АТФазой саркоплазматического ретикулума (SERCA), мембранным насосом, ответственным за регулирование поглощения кальция в саркоплазматическом ретикулуме (SR). Ингибируя поглощение Са в SR, они вызывают расслабление мышц. Точно так же гены (ELN) и (ALN) кодируют трансмембранные микропептиды, которые содержат мотив связывания SERCA и консервативны у млекопитающих.
(Mymx) кодируется геном Gm7325, мышечно-специфическим пептидом, 84 а.о. в длину, что играет роль во время эмбриогенеза в слиянии и формировании скелетных мышц. Он локализуется на плазматической мембране, связываясь с белком слияния мембран (Mymk). У людей ген, кодирующий Mymx, аннотируется как не охарактеризованный LOC101929726. Ортологи также обнаружены в геномах черепах, лягушек и рыб.
У человека (неаннотированный диссоциирующий полипептид P-тельца) - 68 аминокислотных остатков. микропептид был обнаружен в длинно промежуточной некодирующей РНК (lincRNA) LINC01420. Он имеет высокую сохранность последовательности у млекопитающих и локализуется в Р-тельцах. Он обогащает белки, связанные с декапированием 5 ’мРНК. Считается, что он напрямую взаимодействует с (EDC4).
Ген C7orf49, консервативный у млекопитающих, при альтернативном сплайсинге предсказывается, что он продуцирует три микропептида. Ранее было обнаружено, что МРТ-1 является модулятором ретровирусной инфекции. Второй предсказанный микропептид, MRI-2, может быть важным в негомологичном соединении концов (NHEJ) двухцепочечных разрывов ДНК. В экспериментах по коиммунопреципитации МРТ-2 связывался с Ku70 и Ku80, двумя субъединицами Ku, которые играют важную роль в пути NHEJ.
Микропептид из 24 аминокислот, Humanin (HN), взаимодействует с индуцирующим апоптоз белком Bcl2-ассоциированным X-белком (Bax). В активном состоянии Bax претерпевает конформационные изменения, которые открывают домены, нацеленные на мембрану. Это заставляет его перемещаться из цитозоля на митохондриальную мембрану, где он вставляет и высвобождает апоптогенные белки, такие как цитохром c. Взаимодействуя с Bax, HN предотвращает нацеливание Bax на митохондрии, тем самым блокируя апоптоз.
Было обнаружено, что микропептид 90aa, ‘’ или SPAAR, кодируется днРНК LINC00961. Он сохраняется у человека и мыши и локализуется в поздних эндосомах / лизосомах. SPAAR взаимодействует с четырьмя субъединицами комплекса v-АТФаза, ингибируя транслокацию mTORC1 на поверхность лизосомы, где он активируется. Подавление этого микропептида делает возможной активацию mTORC1 за счет стимуляции аминокислот, способствуя регенерации мышц.
![]() Эта статья была адаптирована из следующего источника под лицензией CC BY 4.0 () (отчеты рецензента ): Мария Э. Соуза; Майкл Х. Фаркас (2018), «Микропептид», PLOS Genetics, 14 (12): e1007764, doi : 10.1371 / JOURNAL.PGEN.1007764, PMC 6292567, PMID 30543625, Wikidata Q60017699
Эта статья была адаптирована из следующего источника под лицензией CC BY 4.0 () (отчеты рецензента ): Мария Э. Соуза; Майкл Х. Фаркас (2018), «Микропептид», PLOS Genetics, 14 (12): e1007764, doi : 10.1371 / JOURNAL.PGEN.1007764, PMC 6292567, PMID 30543625, Wikidata Q60017699