Транспортеры магния - это белки, которые переносят магний через клеточную мембрану. Все формы жизни нуждаются в магнии, но молекулярные механизмы поглощения Mg 2+ из окружающей среды и распределения этого жизненно важного элемента в организме выясняются очень медленно.
Функция АТФазы MgtA сильно зависит от кардиолипина и, как было показано, обнаруживает свободный магний в диапазоне мкМ.
У бактерий Mg 2+, вероятно, в основном поставляется белком CorA, а в отсутствие белка CorA - белком MgtE. В дрожжах начальное поглощение происходит через белки Alr1p и Alr2p, но на этой стадии идентифицирован единственный внутренний белок, распределяющий Mg 2+, - это Mrs2p. Среди простейших идентифицирован только один транспортер Mg 2+ (XntAp). У метазоа были идентифицированы гомологи Mrs2p и MgtE, а также две новые транспортные системы Mg 2+ TRPM6 / TRPM7 и PCLN-1. Наконец, у растений было идентифицировано семейство гомологов Mrs2p вместе с другим новым белком, AtMHX.
Эволюция транспорта Mg 2+ оказалась довольно сложной. Белки, очевидно, на основе MgtE, присутствуют в бактериях и многоклеточных животных, но отсутствуют в грибах и растениях, тогда как белки, очевидно связанные с CorA, присутствуют во всех этих группах. Два активных транспортных транспортера, присутствующие в бактериях, MgtA и MgtB, по-видимому, не имеют гомологии у высших организмов. Существуют также транспортные системы Mg 2+, которые встречаются только у высших организмов.
Еще предстоит идентифицировать большое количество белков, транспортирующих Mg 2+. Даже в наиболее изученных эукариотах, дрожжах, Borrelly сообщил об обменнике Mg 2+ / H + без ассоциированного белка, который, вероятно, локализован в Golgi. По крайней мере, еще один основной транспортер Mg 2+ в дрожжах все еще не учтен, тот, который влияет на транспорт Mg 2+ в дрожжевую вакуоль и из нее. Кажется, что у высших многоклеточных организмов многие белки, транспортирующие Mg 2+, ждут открытия.
Транспортеры Mg 2+, содержащие CorA-домен (CorA, Alr-подобные и Mrs2-подобные), имеют сходный, но не идентичный набор сродства к двухвалентным катионам. Фактически, это наблюдение можно распространить на все идентифицированные транспортеры Mg 2+. Это сходство предполагает, что основные свойства Mg 2+ сильно влияют на возможные механизмы распознавания и транспорта. Однако это наблюдение также предполагает, что использование ионов других металлов в качестве индикаторов для поглощения Mg 2+ не обязательно даст результаты, сравнимые со способностью переносчика транспортировать Mg 2+. В идеале Mg 2+ следует измерять напрямую.
Поскольку 28 Mg 2+ практически невозможно получить, большую часть старых данных придется переосмыслить с помощью новых инструментов для измерения переноса Mg 2+, если необходимо напрямую сравнивать разные переносчики. Новаторская работа Колисека и Фрошауэра с использованием маг-фуры 2 показала, что свободный Mg 2+ может быть надежно измерен in vivo в некоторых системах. Вернувшись к анализу CorA с помощью этого нового инструмента, мы получили важную основу для анализа новых транспортных систем Mg 2+ по мере их обнаружения. Однако важно, чтобы количество переносчика, присутствующего в мембране, было точно определено, если необходимо провести сравнение транспортной способности. Эта бактериальная система может также оказаться полезной для анализа эукариотических транспортных белков Mg 2+, но различия в биологических системах прокариот и эукариот необходимо будет учитывать в любом эксперименте.
Сравнение функций охарактеризованных транспортных белков Mg 2+ в настоящее время практически невозможно, даже несмотря на то, что белки были исследованы в различных биологических системах с использованием различных методологий и технологий. Создание системы, в которой все белки можно было бы сравнивать напрямую, было бы большим достижением. Если можно было бы показать, что белки функциональны у бактерий ( S. typhimurium), тогда комбинация методов маг-фуры 2, количественного определения белка в оболочке мембраны и структуры белков (рентгеновский кристалл или криогенный анализ) ТЕМ) может позволить определить основные механизмы, участвующие в распознавании и транспорте иона Mg 2+. Однако, возможно, лучшим достижением будет разработка методов, позволяющих измерять функцию белка в системе патч-зажим с использованием искусственных мембран.
В 1968 году Ласк описал ограничение роста бактерий ( Escherichia coli) на средах с низким содержанием Mg 2+, предположив, что бактериям требуется Mg 2+ и, вероятно, они будут активно брать этот ион из окружающей среды. В следующем году та же группа и другая группа, Сильвер, независимо описали поглощение и отток Mg 2+ в метаболически активных клетках E. coli с использованием 28 Mg 2+. К концу 1971 года были опубликованы две статьи, описывающие влияние Co 2+, Ni 2+ и Mn 2+ на транспорт Mg 2+ в E. coli и в Aerobacter aerogenes и Bacillus megaterium. В последней крупной разработке перед клонированием генов, кодирующих переносчики, было обнаружено, что существует вторая система захвата Mg 2+, которая показала сходное сродство и кинетику переноса с первой системой, но имела другой диапазон чувствительности к мешающим катионам.. Эта система также подавлялась высокими внеклеточными концентрациями Mg 2+.
Ген CorA и соответствующий ему белок являются наиболее изученной транспортной системой Mg 2+ в любом организме. Большая часть опубликованной литературы о гене CorA принадлежит лаборатории М.Э. Магуайра. Недавно группа RJ Schweyen оказала значительное влияние на понимание транспорта Mg 2+ с помощью CorA. Первоначально ген был назван в честь фенотипа устойчивости к кобальту у E. coli, который был вызван инактивацией гена.
Ген был генетически идентифицирован у E. coli Park et al., но не был клонирован до Hmiel et al. изолировали гомолог серовара Typhimurium ( S. typhimurium) Salmonella enterica. Позже Смит и Магуайр показали, что ген CorA присутствует в 17 грамотрицательных бактериях. Благодаря большому количеству полных геномных последовательностей, доступных в настоящее время для прокариот, было показано, что CorA практически повсеместен среди эубактерий, а также широко распространен среди архей. Локус CorA в E. coli содержит единственную открытую рамку считывания из 948 нуклеотидов, производящую белок из 316 аминокислот. Этот белок хорошо сохраняется среди эубактерий и архей. Между E.coli, и S. Typhimurium, белки 98% идентичны, но в более отдаленно родственных видов, сходство падает между 15 и 20%. В более отдаленных генах сходство часто ограничивается С-концевой частью белка, и короткий аминокислотный мотив GMN в этой области очень консервативен. Домен CorA, также известный как PF01544 в базе данных консервативных белковых доменов pFAM ( http://webarchive.loc.gov/all/20110506030957/http%3A//pfam.sanger.ac.uk/ ), дополнительно присутствует в широкий спектр высших организмов, и эти переносчики будут рассмотрены ниже.
Ген CorA конститутивно экспрессируется в S. typhimurium в широком диапазоне внешних концентраций Mg 2+. Однако недавние данные свидетельствуют о том, что активность белка может регулироваться двухкомпонентной регуляторной системой PhoPQ. Этот датчик реагирует на низкие внешние концентрации Mg 2+ во время процесса заражения S. typhimurium у людей. Сообщалось, что в условиях низкого внешнего Mg 2+ система PhoPQ подавляет функцию CorA, и ранее было показано, что в этих условиях активируется транскрипция альтернативных транспортеров Mg 2+ MgtA и MgtB. Чамнонгпол и Гройсман предполагают, что это позволяет бактериям избежать токсичности ионов металлов, вызванной переносом других ионов, особенно Fe (II), с помощью CorA в отсутствие Mg 2+. Папп и Магуайр предлагают противоречивый отчет об источнике токсичности.
 Первоначально опубликованная топология TM белка CorA
Первоначально опубликованная топология TM белка CorA На рисунке (не в масштабе) показана первоначально опубликованная топология трансмембранного (TM) домена белка CorA S. typhimurium, который, как утверждается, имеет три мембранных области в С-концевой части белка (показаны синим), как определено Smith et al.. Доказательства того, что CorA действует как гомотетрамер, были опубликованы Warren et al. в 2004 г. В декабре 2005 г. кристаллическая структура канала CorA была размещена в базе данных структуры белков RSCB. Результаты показали, что белок имеет два ТМ домена и существует как гомопентамер, что прямо противоречит предыдущим сообщениям. Перейдите по этой ссылке, чтобы увидеть структуру в 3D. Растворимые внутриклеточные части белка сильно заряжены и содержат 31 положительно заряженных и 53 отрицательно заряженных остатка. Напротив, TM-домены содержат только одну заряженную аминокислоту, которая, как было показано, не важна для активности переносчика. Из экспериментов по мутагенезу выясняется, что химия транспорта Mg 2+ зависит от гидроксильных групп, выстилающих внутреннюю часть транспортной поры; Также существует абсолютное требование к мотиву GMN (показано красным).
Прежде чем активность CorA могла быть изучена in vivo, любые другие транспортные системы Mg 2+ в бактериальном хозяине должны быть идентифицированы и инактивированы или удалены (см. Ниже). Был сконструирован штамм S. typhimurium, содержащий функциональный ген CorA, но лишенный MgtA и MgtB (также см. Ниже), и была проанализирована кинетика поглощения переносчиком. Этот штамм показал почти нормальные скорости роста на стандартной среде (50 мкМ Mg 2+), но удаление всех трех генов привело к созданию бактериального штамма, которому для нормального роста требовалось 100 мМ внешнего Mg 2+.
Mg 2+ транспортируется в клетки, содержащие только транспортную систему CorA с кинетикой и чувствительностью к катионам, подобной поглощению Mg 2+, описанному в предыдущих статьях, и дополнительно количественно определено (см. Таблицу). Было замечено, что поглощение Mg 2+ выходит на плато, как и в более ранних исследованиях, и хотя фактический механизм снижения транспорта не был определен, поэтому было сделано предположение, что белок инактивирован. Co 2+ и Ni 2+ токсичны для клеток S. typhimurium, содержащих функциональный белок CorA, и эта токсичность связана с блокированием поглощения Mg 2+ (конкурентное ингибирование) и накоплением этих ионов внутри клетки. Было показано, что Co 2+ и Ni 2+ переносятся CorA с помощью анализа радиоактивных индикаторов, хотя с более низкими сродством (км) и скоростью (Vmax), чем для Mg 2+ (см. Таблицу). Значения km для Co 2+ и Ni 2+ значительно превышают ожидаемые для клеток в их нормальной окружающей среде, поэтому маловероятно, что транспортная система CorA опосредует поглощение этих ионов в естественных условиях. На сегодняшний день доказательства транспорта Mn 2+ с помощью CorA ограничены E. coli.
| Мг 2+ | Co 2+ | Ni 2+ | |
|---|---|---|---|
| км (мкМ) | 15 | 30 | 240 |
| Vmax (пмоль / мин / 10 8 клеток) | 250 | 500 | 360 |
| Ki (мкМ) - Mg | - | - | 10 |
| Ki (мкМ) - Co | 50 | - | 20 |
| Ki (мкМ) - Mn | 30 | - | - |
| Ki (мкМ) - Ni | 300 | - | 300 |
В таблице приведена кинетика переноса транспортной системы CorA Mg 2+. Эта таблица составлена на основе публикаций Snavely et al. (1989b), Гибсон и др. (1991) и Smith et al. (1998a) и суммирует кинетические данные для транспортного белка CorA, экспрессируемого с промотора дикого типа в бактериях, лишенных MgtA и MgtB. km и Vmax были определены при 20 ° C, поскольку поглощение Mg 2+ при 37 ° C было слишком быстрым для точного измерения.
Недавно Mg 2+ -зависимая флуоресценция маг-фуры 2 была использована для измерения содержания свободного Mg 2+ в клетках S. typhimurium в ответ на внешний Mg 2+, что показало, что CorA является основной системой поглощения Mg 2+ в бактерии. Авторы также впервые показали, что изменения электрического потенциала (ΔΨ) через плазматическую мембрану клетки влияют как на скорость поглощения Mg 2+, так и на содержание свободного Mg 2+ в клетке; деполяризация подавляла транспорт, в то время как гиперполяризация увеличивала транспорт. Кинетика транспорта определялась только скоростью изменения свободного Mg 2+ внутри клеток (250 мкМ с -1). Поскольку количественная оценка количества белка CorA в мембране не проводилась, это значение нельзя сравнивать с другими экспериментами с переносчиками Mg 2+.
Отток Mg 2+ из бактериальных клеток был впервые обнаружен Lusk и Kennedy (1969) и опосредован транспортной системой CorA Mg 2+ в присутствии высоких внеклеточных концентраций Mg 2+. Отток также может быть вызван Co 2+, Mn 2+ и Ni 2+, хотя и не в такой степени, как Mg 2+. Никакого оттока Co 2+ через транспортную систему CorA не наблюдалось. Процесс оттока Mg 2+ дополнительно требует одного из генов CorB, CorC или CorD. Мутация любого одного из этих генов приводит к устойчивости к Со 2+, которая немногим меньше половины той, которая обеспечивается мутантом CorA. Этот эффект может быть связан с ингибированием потери Mg 2+, которая в противном случае происходила бы в присутствии высоких уровней Co 2+. В настоящее время неизвестно, является ли Mg 2+ более токсичным при удалении генов CorBCD.
Было высказано предположение, что ион Mg 2+ первоначально будет взаимодействовать с любым транспортным белком через его гидратную оболочку. Гексааммин кобальта (III), Co (III) Hex, является ковалентно связанным (нелабильным) аналогом первой оболочки гидратации для нескольких двухвалентных катионов, включая Mg 2+. Радиус молекулы Co (III) Hex составляет 244 пм, что очень похоже на радиус 250 пм первой гидратной оболочки Mg 2+. Этот аналог является мощным ингибитором транспортной системы CorA в большей степени, чем Mg 2+, Co 2+ или Ni 2+. Дополнительная сила ингибирования Co (III) Hex может происходить из-за блокирования транспортной поры из-за неспособности белка «дегидратировать» субстрат. Было также показано, что Co (III) Hex не переносится в клетки, что позволяет предположить, что для транспорта нормального субстрата (Mg 2+) потребуется по крайней мере частичная дегидратация. Гексааммин никеля (II) с радиусом 255 мкм не ингибировал транспортную систему CorA, что позволяет предположить, что существует предел максимального размера для связывания иона субстрата CorA. Эти результаты предполагают, что важным свойством, участвующим в распознавании Mg 2+ CorA, является размер иона с его первой гидратной оболочкой. Следовательно, обычно указываемое изменение объема от чистого до гидратированного иона Mg 2+ более чем в 500 раз, включая вторую сферу гидратации, может не иметь биологического значения и может быть причиной изменения объема первой сферы на 56%. сложите, чтобы использовать его чаще.
Присутствие этих двух генов было впервые заподозрено, когда Нельсон и Кеннеди (1972) показали, что в E. coli существуют Mg 2+ -репрессивные и не репрессивные системы захвата Mg 2+. Нерепрессируемое поглощение Mg 2+ опосредуется белком CorA. В конечном итоге было показано, что у S. typhimurium репрессируемое поглощение Mg 2+ осуществляется через белки MgtA и MgtB.
И MgtA, и MgtB регулируются системой PhoPQ и активно транскрибируются в процессе инфицирования людей S. typhimurium. Хотя ни один ген не требуется для патогенности, белок MgtB действительно увеличивает долгосрочную выживаемость патогена в клетке. Гены также активируются in vitro, когда концентрация Mg 2+ падает ниже 50 мкМ (Snavely et al., 1991a). Хотя белки имеют значения km, аналогичные CorA, и скорость транспорта примерно в 10 раз меньше, гены могут быть частью системы поглощения Mg 2+. Chamnongpol and Groisman (2002) представляют доказательства того, что роль этих белков может заключаться в компенсации инактивации белка CorA регулятором PhoPQ. Авторы предполагают, что белок CorA инактивирован, чтобы избежать токсичности металлов через белок в среде с низким содержанием Mg 2+, которой клетки S. typhimurium подвергаются после заражения.
Обе белки являются АТФазами P-типа, и ни один ген не обнаруживает никакого сходства с CorA. Белки MgtA и MgtB похожи на 75% (идентичны на 50%), хотя кажется, что MgtB мог быть получен путем горизонтального переноса генов как часть Salmonella Pathogenicity Island 3. Топология TM белка MgtB была экспериментально определена, что показало, что белок имеет десять спиралей, охватывающих ТМ, с концами белка в цитоплазме (см. рисунок). MgtA присутствует в разнообразных бактериях, но не так распространен, как CorA, в то время как MgtB, по-видимому, имеет довольно ограниченное распространение. Гипотез о необычном распределении не выдвигалось.
 Топология TM белка MgtB
Топология TM белка MgtB Рисунок, адаптированный из Smith et al. (1993b), показывает экспериментально определенную топологию мембраны белка MgtB у S. typhimurium. Домены ТМ показаны светло-синим цветом, и указана ориентация в мембране и положения N- и C-концов. Фигурка выполнена не в масштабе.
Хотя белки MgtA и MgtB очень похожи, они действительно демонстрируют незначительные различия в активности. MgtB очень чувствителен к температуре, теряя всякую активность (в отношении транспорта Mg 2+) при температуре 20 ° C. Кроме того, MgtB и MgtA ингибируются различными диапазонами катионов (Таблица A10.1).
В таблице приведены характеристики транспорта катионов белков MgtA и MgtB в S. typhimurium, а также кинетические данные для белков транспорта MgtA и MgtB при 37 ° C. В скобках указаны значения Vmax для поглощения при 20 ° C. Ингибирование транспорта Mg 2+ с помощью Mn 2+ через MgtA показало необычную кинетику (см. Рисунок 1 Snavely et al., 1989b).
| Мг 2+ | Co 2+ | ||||
|---|---|---|---|---|---|
| км (мкМ) | Vmax (пмоль / мин / 10 8 клеток) | Ki (мкМ) | |||
| Co 2+ | Mn 2+ | Ni 2+ | |||
| MgtA | 29 | 115 (24) | 40 | Икс | 30 |
| MgtB | 6 | 75 (lt;2) | 8 | 40 | 13 |
Белки MgtA и MgtB представляют собой АТФазы, использующие одну молекулу АТФ за цикл транспортировки, тогда как захват Mg 2+ через CorA просто электрохимически благоприятен. Chamnongpol и Groisman (2002) предположили, что белки MgtA и MgtB являются частью системы предотвращения токсичности металлов. В качестве альтернативы, поскольку большинство АТФаз P-типа функционируют как переносчики, опосредующие отток, было высказано предположение, что белки MgtA и MgtB действуют как белки оттока для в настоящее время неидентифицированного катиона, а транспорт Mg 2+ либо неспецифичен, либо обменивается для поддержания электрического -нейтральность транспортного процесса. Для определения физиологической функции этих белков потребуются дальнейшие эксперименты.
| MgtE | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристаллическая структура транспортера магния MgtE. PDB 2zy9 Кристаллическая структура транспортера магния MgtE. PDB 2zy9 | |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | MgtE | ||||||||
| Pfam | PF01769 | ||||||||
| ИнтерПро | IPR006667 | ||||||||
| TCDB | 1.A.26 | ||||||||
| Белок OPM | 2yvx | ||||||||
| |||||||||
В двух статьях описан MgtE, четвертый белок, поглощающий Mg 2+, у бактерий, не связанных с MgtA / B или CorA. Этот ген был секвенирован, и предполагается, что белок размером 312 аминокислот будет содержать четыре или пять перекрывающих ТМ доменов, которые близко расположены в С-концевой части белка (см. Рисунок). Этот участок белка был идентифицирован в базе данных Pfam как консервативный домен белка (PF01769), и виды, содержащие белки, которые имеют этот домен белка, примерно одинаково распределены среди Eubacteria и Archaea, хотя это довольно редко по сравнению с распределением CorA. Однако разнообразие белков, содержащих домен, значительно больше, чем у домена CorA. В базе данных Pfam перечислены семь отдельных групп белков, содержащих домен MgtE, шесть из которых содержат архаичный или эубактериальный член. Экспрессия MgtE часто контролируется консервативной структурой РНК, лидером YkoK или M-боксом.
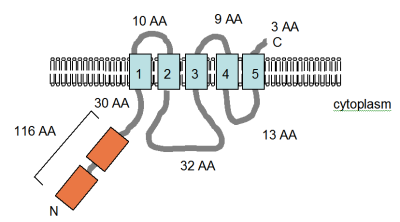 Прогнозируемая топология TM белка MgtE
Прогнозируемая топология TM белка MgtE Рисунок (справа), адаптированный из Smith et al. (1995) и запись в базе данных PFAM, показывает предсказанную компьютером топологию мембраны белка MgtE в Bacillus firmus OF4. Домены TM показаны голубым цветом. В области CBS, названные в честь белка они были определены в, цистатионин-бета - синтазы, показаны оранжевым цветом, определены в базе данных Pfam как регуляторных областей, но механизм действия еще не были описаны. Они обнаружены в нескольких хлоридных каналах, управляемых напряжением. Указаны ориентация в мембране и положения N- и C-концов. Эта фигура не в масштабе. Структура этого транспортера недавно была решена с помощью рентгеновской кристаллографии.
Ген MgtE был впервые идентифицирован Smith et al. (1995) во время скрининга CorA-подобных белков в бактериях и дополняет штамм MM281 S. typhimurium с дефицитом поглощения Mg 2+ (corA mgtA mgtB), восстанавливая рост дикого типа на стандартных средах. Кинетика транспорта Mg 2+ для белка не определялась, так как 28 Mg 2+ был недоступен. В качестве замены было измерено поглощение 57 Co 2+, и было показано, что км составляет 82 мкМ, а Vmax составляет 354 пмоль мин -1 10 8 клеток -1. Mg 2+ был конкурентный ингибитор с Ki 50 мкМ-Кий из Mg 2+ ингибировании 60 Co 2+ поглощение через Cora составляет 10 мкМ. Сравнение имеющихся кинетических данных для MgtA и CorA показано в таблице. Очевидно, что MgtE не переносит Co 2+ в той же степени, что и CorA, и ингибирование транспорта с помощью Mg 2+ также менее эффективно, что позволяет предположить, что сродство MgtE к Mg 2+ ниже, чем сродство CorA. Самым сильным ингибитором поглощения Co 2+ был Zn 2+ с Ki 20 мкМ. Транспорт Zn 2+ этим белком может быть таким же важным, как и транспорт Mg 2+.
| Мг 2+ | Co 2+ | ||||
|---|---|---|---|---|---|
| км (мкМ) | Vmax (пмоль / мин / 10 8 клеток) | км (мкМ) | Vmax (пмоль / мин / 10 8 клеток) | Ki (Mg 2+) (мкМ) | |
| MgtE | - | - | 82 (при 37 ° С) | 354 (при 37 ° С) | 50 (при 37 ° С) |
| CorA | 15 (при 20 ° С) | 250 (при 20 ° С) | 30 (при 22 ° С) | 500 (при 22 ° C) | 10 (при 22 ° C) |
В таблице показано сравнение кинетики переноса MgtE и CorA, а также перечислены ключевые значения кинетических параметров для них. Как показано, данные были получены при различных температурах инкубации. km и Ki существенно не изменяются из-за разницы в температуре инкубации. Напротив, Vmax показывает сильную положительную корреляцию с температурой, следовательно, значение Co 2+ Vmax для MgtE напрямую не сопоставимо со значениями для CorA.
Самое раннее исследование, показывающее, что дрожжи поглощают Mg 2+, было проведено Schmidt et al. (1949). Однако эти авторы показали только измененное содержание Mg 2+ в дрожжах в таблице в документе, и выводы отчета полностью касались метаболизма фосфата. Серия экспериментов Ротштейна сместила акцент больше на поглощение катионов металлов, показав, что дрожжи поглощают катионы со следующей серией аффинности; Mg 2+, Co 2+, Zn 2+ gt; Mn 2+ gt; Ni 2+ gt; Ca 2+ gt; Sr 2+. Кроме того, было высказано предположение, что транспорт различных катионов опосредуется одной и той же транспортной системой - ситуация очень похожа на ситуацию с бактериями.
В 1998 году МакДиармид и Гарднер наконец идентифицировали белки, ответственные за наблюдаемый фенотип транспорта катионов у Saccharomyces cerevisiae. Гены, участвующие в этой системе, и вторая митохондриальная транспортная система Mg 2+, функционально идентифицированная значительно после клонирования гена, описаны в разделах ниже.
Два гена, ALR1 и ALR2, были выделены при скрининге на устойчивость (устойчивость) к Al 3+ у дрожжей. Конструкции со сверхэкспрессией, содержащие геномную ДНК дрожжей, вводили в дрожжи дикого типа, и трансформанты проверяли на рост на токсические уровни Al 3+. Плазмиды, содержащие ALR1 и ALR2, обеспечивали рост дрожжей в этих условиях.
Белки Alr1p и Alr2p состоят из 859 и 858 аминокислот соответственно и на 70% идентичны. В области на С-конце половина этих белков слабо похожа на полный белок CorA. Компьютерная топология TM Alr1p показана на рисунке. Присутствие третьего домена TM было предложено МакДиармидом и Гарднером (1998) на основании гомологии последовательностей, а совсем недавно Ли и Гарднером (2006) на основе исследований мутагенеза, сделавших топологию TM этих белков более точной. как у CorA (см. рисунок). Кроме того, Alr1p содержит консервативный мотив GMN на внешнем конце TM 2 (TM 2 '), и мутация метионина (M) в этом мотиве в лейцин (L) привела к потере транспортной способности.
На рисунке показаны две возможные топологии TM Alr1p. Часть A рисунка показывает предсказанную компьютером топологию мембраны белка Alr1p у дрожжей, а часть B показывает топологию Alr1p на основе экспериментальных результатов Lee and Gardner (2006). Расположение мотива GMN указано красным, а домены TM - голубым. Указаны ориентация в мембране и положения N- и C-концов, различные размеры растворимых доменов указаны в аминокислотах (AA), а TM-домены пронумерованы по их сходству с CorA. Если какой-либо домен TM отсутствует, оставшиеся домены нумеруются штрихами. Фигурка выполнена не в масштабе. Третий ALR-подобный ген присутствует в S. cerevisiae, и есть два гомологичных гена как у Schizosaccharomyces pombe, так и у Neurospora crassa. Эти белки содержат мотив GMN, как у CorA, за исключением второго гена N. crassa. Никаких ALR-подобных генов не было идентифицировано у видов, не относящихся к грибам.
Исследования мембранного фракционирования и слияния зеленого флуоресцентного белка (GFP) установили, что Alr1p локализован на плазматической мембране. Было обнаружено, что локализация Alr1p интернализуется и разрушается в вакуоли в ответ на внеклеточные катионы. Mg 2+ при очень низких внеклеточных концентрациях (100 мкМ; lt;10% содержания Mg 2+ в стандартной среде) и Co 2+ и Mn 2+ при относительно высоких концентрациях (gt; 20 × стандартные среды) вызвали изменение Локализация белка Alr1p, и эффект зависел от функционального убиквитинирования, эндоцитоза и деградации вакуолей. Этот механизм был предложен для регулирования поглощения Mg 2+ дрожжами. Однако недавний отчет показывает, что некоторые из наблюдений, сделанных Stadler et al. не воспроизводились. Например, регуляция накопления мРНК ALR1 за счет поступления Mg 2+ не наблюдалась, и стабильность белка Alr1 не снижалась при воздействии избытка Mg 2+. Первоначальное наблюдение Mg-зависимого накопления белка Alr1 в устойчивых условиях с низким содержанием Mg было воспроизведено, но было показано, что этот эффект является артефактом, вызванным добавлением небольшого пептида (эпитопа) к белку, что позволяет его обнаруживать.. Несмотря на эти проблемы, было продемонстрировано, что активность Alr1 реагирует на поставку Mg, предполагая, что активность белка регулируется напрямую, как это наблюдалось для некоторых бактериальных белков CorA.
Функциональный Alr1p (дикий тип) или Alr2p (сверхэкспрессия) необходим для роста S. cerevisiae в стандартных условиях (4 мМ Mg 2+), а Alr1p может поддерживать нормальный рост при таких низких концентрациях Mg 2+, как 30 мкМ. 57 Co 2+ поглощается дрожжами через белок Alr1p с km 77-105 мкМ (; C. MacDiarmid и RC Gardner, неопубликованные данные), но Ki для ингибирования этого транспорта Mg 2+ в настоящее время неизвестен. Транспорт других катионов белком Alr1p оценивали по ингибированию роста дрожжей. Сверхэкспрессия Alr1p привела к повышенной чувствительности к Ca 2+, Co 2+, Cu 2+, La 3+, Mn 2+, Ni 2+ и Zn 2+, массиву катионов, аналогичных тем, которые, как было показано, переносятся в дрожжи. транспортной системой типа CorA. Предполагается, что повышенная токсичность катионов в присутствии переносчика происходит из-за повышенного накопления катиона внутри клетки.
Доказательством того, что Alr1p является в первую очередь переносчиком Mg 2+, является то, что потеря Alr1p приводит к снижению общего содержания в клетках Mg 2+, но не других катионов. Кроме того, два электрофизиологических исследования, в которых Alr1p продуцировался в дрожжах или ооцитах Xenopus, показали Mg 2+ -зависимый ток в присутствии белка; Salih et al., в стадии подготовки.
Кинетика поглощения Mg 2+ Alr1p была исследована электрофизиологическими методами на целых клетках дрожжей. Результаты показали, что Alr1p, скорее всего, действует как ионоселективный канал. В той же статье авторы сообщили, что транспорт Mg 2+ с помощью Alr1p варьируется от 200 до 1500 пА при среднем токе 264 пА. Количественная оценка количества белка, производящего ток, не была представлена, поэтому результаты не могут быть сопоставимы с бактериальными транспортными белками Mg 2+.
Альтернативные методы анализа радиоактивных индикаторов 28 Mg 2+ и маг-фуры 2 для измерения поглощения Mg 2+ еще не использовались с Alr1p. 28 Mg 2+ в настоящее время недоступен, и система маг-фура 2 вряд ли предоставит простые данные о поглощении дрожжами. Клетка дрожжей поддерживает гетерогенное распределение Mg 2+, что позволяет предположить, что несколько систем внутри дрожжей транспортируют Mg 2+ в отсеки для хранения. Этот внутренний транспорт, скорее всего, замаскирует процесс поглощения. Экспрессия ALR1 в S. typhimurium без генов захвата Mg 2+ может быть альтернативой, но, как указывалось ранее, необходимо принимать во внимание эффекты гетерологичной системы экспрессии.
Ген MNR2 кодирует белок, тесно связанный с белками Alr, но включает консервативные особенности, которые определяют отдельную подгруппу белков CorA в геномах грибов, предполагая особую роль в гомеостазе Mg 2+. Подобно мутанту alr1, рост мутанта mnr2 был чувствителен к условиям дефицита Mg 2+, но наблюдалось, что мутант mnr2 накапливает больше Mg 2+, чем штамм дикого типа в этих условиях. Эти фенотипы предполагают, что Mnr2 может регулировать хранение Mg 2+ во внутриклеточном компартменте. В соответствии с этой интерпретацией белок Mnr2 был локализован на мембране вакуоли, внутреннем компартменте, участвующем в хранении излишков минеральных питательных веществ дрожжами. Прямая роль Mnr2 в транспорте Mg 2+ была подтверждена наблюдением, что повышенная экспрессия Mnr2, которая перенаправляла часть белка Mnr2 на клеточную поверхность, также подавляла потребность в Mg 2+ двойного мутантного штамма alr1 alr2. Мутация mnr2 также изменила накопление других двухвалентных катионов, предполагая, что эта мутация может увеличивать экспрессию гена Alr или активность белка. Недавняя работа поддержала эту модель, показав, что активность Alr1 была увеличена в мутантном штамме mnr2 и что мутация была связана с индукцией активности Alr1 при более высокой внешней концентрации Mg, чем наблюдалась для штамма Mnr2 дикого типа. Эти эффекты наблюдались без каких-либо изменений в накоплении белка Alr1, что снова указывает на то, что активность Alr1 может регулироваться непосредственно концентрацией Mg внутри клетки.
Подобно генам ALR, ген MRS2 был клонирован и секвенирован до того, как он был идентифицирован как переносчик Mg 2+. Ген MRS2 был идентифицирован в ядерном геноме дрожжей при скрининге супрессоров мутации сплайсинга РНК митохондриального гена, и был клонирован и секвенирован Wiesenberger et al. (1992). Mrs2p не был идентифицирован как предполагаемый переносчик Mg 2+ до Bui et al. (1999). Gregan et al. (2001a) идентифицировали LPE10 по гомологии с MRS2 и показали, что как LPE10, так и мутанты MRS2 изменяют содержание Mg 2+ в митохондриях дрожжей и влияют на активность сплайсинга РНК в органеллах. Было показано, что транспорт Mg 2+ напрямую опосредуется Mrs2p, но не Lpe10p.
Белки Mrs2p и Lpe10p имеют размер 470 и 413 аминокислотных остатков, соответственно, а область из 250–300 аминокислот в середине белков показывает слабое сходство с полным белком CorA. Топологии TM белков Mrs2p и Lpe10p были оценены с помощью анализа защиты протеазы и показаны на рисунке. TM 1 и 2 соответствуют TM 2 и 3 в белке CorA. Консервативный мотив GMN находится на внешнем конце первого TM-домена, и когда глицин (G) в этом мотиве был мутирован в цистеин (C) в Mrs2p, транспорт Mg 2+ был сильно снижен.
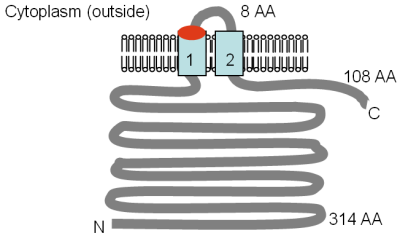 Топология TM белков MRS2 и LPE10
Топология TM белков MRS2 и LPE10 На рисунке показана экспериментально определенная топология Mrs2p и Lpe10p, адаптированная из Bui et al. (1999) и Gregan et al. (2001a). Расположение мотива GMN указано красным, а домены TM - голубым. Указаны ориентация в мембране и положения N- и C-концов. Различные размеры растворимых доменов указаны в аминокислотах (AA), TM-домены пронумерованы, а рисунок не в масштабе.
Mrs2p был локализован на внутренней мембране митохондрий с помощью субклеточного фракционирования и иммунодетекции, а Lpe10p - в митохондриях. Митохондрии, в которых отсутствует Mrs2p, не демонстрируют быстрого поглощения Mg 2+, а только медленную «утечку», а чрезмерное накопление Mrs2p приводит к увеличению начальной скорости поглощения. Кроме того, CorA при слиянии с митохондриальной лидерной последовательностью Mrs2p может частично дополнять митохондриальный дефект, вызванный потерей либо Mrs2p, либо Lpe10p. Следовательно, Mrs2p и / или Lpe10p могут быть основной системой захвата Mg 2+ митохондриями. Возможно, белки образуют гетеродимеры, поскольку ни один из белков (при сверхэкспрессии) не может полностью компенсировать потерю другого.
Характеристики поглощения Mg 2+ в изолированных митохондриях с помощью Mrs2p были количественно определены с использованием маг-фуры 2. Поглощение Mg 2+ с помощью Mrs2p разделяло ряд атрибутов с CorA. Во-первых, поглощение Mg 2+ напрямую зависело от электрического потенциала (ΔΨ) через граничную мембрану. Во-вторых, захват насыщается намного ниже того, что теоретически допускает ΔΨ, поэтому транспорт Mg 2+ с помощью Mrs2p, вероятно, будет регулироваться аналогично CorA, возможно, за счет инактивации белка. В-третьих, отток Mg 2+ наблюдался через Mrs2p при искусственной деполяризации митохондриальной мембраны валиномицином. Наконец, потоки Mg 2+ через Mrs2p ингибируются гексааммином кобальта (III).
Кинетика захвата Mg 2+ Mrs2p была определена в Froschauer et al. (2004) статья о CorA в бактериях. Начальное изменение концентрации свободного Mg 2+ составляло 150 мкМ с-1 для дикого типа и 750 мкМ с-1 для митохондрий дрожжей, сверхэкспрессирующих MRS2. Не было предпринято никаких попыток масштабировать наблюдаемый транспорт до количества присутствующего транспортера.
Транспорт Mg 2+ в Paramecium был в основном охарактеризован Р. Р. Престоном и его сотрудниками. Электрофизиологические методы на всем Paramecium использовались для идентификации и характеристики токов Mg 2+ в серии статей до того, как ген был клонирован Haynes et al. (2002).
Открытая рамка считывания для гена XNTA имеет размер 1707 п.н., содержит два интрона и дает предсказанный белок из 550 аминокислот. Белка была предсказана, чтобы содержать 11 ТМОВ доменов, а также содержит amp; alpha ; 1 и amp; alpha ; 2 мотивов (смотрите рисунок) в SLC8 ( Na + / Ca 2+ обменника ) и SLC24 ( K + в зависимости Na + / Са 2+ обменник ) человеческие растворенные транспортные белки. XntAp в равной степени похож на семейства белков SLC8 и SLC24 по аминокислотной последовательности, но предсказанная топология TM больше похожа на топологию SLC24, но сходство в лучшем случае слабое, а взаимосвязь очень отдаленная. Белок AtMHX из растений также имеет отдаленные отношения с белками SLC8.
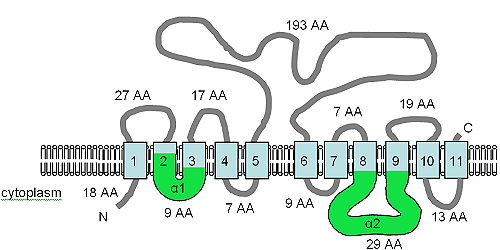 Топология TM белка XNTA
Топология TM белка XNTA На рисунке показана прогнозируемая топология TM XntAp. По материалам Haynes et al. (2002), этот рисунок показывает компьютерную предсказанную топологию мембраны XntAp в Paramecium. Ориентацию в мембране определяли с помощью HMMTOP. Домены TM показаны голубым цветом, домены α1 и α2 показаны зеленым цветом. Указаны ориентация в мембране и положения N- и C-концов, фигура не в масштабе.
Mg 2+ -зависимые токи, переносимые XntAp, кинетически подобны токам канального белка и имеют порядок ионной селективности Mg 2+ gt; Co 2+, Mn 2+ gt; Ca 2+ - серия снова очень похожа на серию CorA.. В отличие от других транспортных белков, о которых сообщалось до сих пор, XntAp зависит от внутриклеточного Ca 2+. Транспорт также зависит от ΔΨ, но снова Mg 2+ не транспортируется до равновесия, ограничиваясь приблизительно 0,4 мМ свободного Mg 2+ в цитоплазме. Существование внутриклеточного компартмента с гораздо более высокой свободной концентрацией Mg 2+ (8 мМ) было подтверждено результатами.
Исследования Mg 2+ у животных, включая человека, отстают от исследований бактерий и дрожжей. Это во многом объясняется сложностью задействованных систем, но также и впечатлением внутри области, что Mg 2+ поддерживается на высоком уровне во всех клетках и не изменяется под воздействием внешних воздействий. Только за последние 25 лет появилась серия отчетов, оспаривающих эту точку зрения, и новые методологии показали, что содержание свободного Mg 2+ поддерживается на уровнях, изменения которых могут влиять на клеточный метаболизм.
Биоинформатический поиск в базах данных последовательностей выявил один гомолог гена MRS2 дрожжей в ряде многоклеточных животных. Белок имеет очень похожую последовательность и предсказанную топологию ТМ с дрожжевым белком, а мотив GMN не поврежден на конце первого домена ТМ. Человеческий белок hsaMrs2p был локализован на митохондриальной мембране в клетках мыши с помощью слитого белка GFP.
Очень мало известно о транспортных характеристиках белка Mg 2+ у млекопитающих, но Zsurka et al. (2001) показали, что Mrs2p человека дополняет мутанты mrs2 в дрожжевой митохондриальной системе захвата Mg 2+.
Идентификация этого семейства генов у метазоа началась с метода ловушки сигнальной последовательности для выделения секретируемых и мембранных белков. Большая часть идентификации пришла из биоинформатического анализа. В конечном итоге три гена были идентифицированы у людей, еще три - у мышей и три - у Caenorhabditis elegans, с одним геном у Anopheles gambiae. В базе данных pFAM домен MgtE указан как pFAM01769 и дополнительно идентифицирован белок, содержащий домен MgtE, у Drosophila melanogaster. Белки, содержащие домен MgtE, можно разделить на семь классов в соответствии с определением pFAM с использованием типа и организации идентифицируемых доменов в каждом белке. Белки Metazoan представлены в трех из семи групп. Все белки метазоа содержат два домена MgtE, но некоторые из них были предсказаны только путем распознавания контекста (Coin, Bateman and Durbin, неопубликовано. Дополнительные сведения см. На веб-сайте pFAM).
Белок SLC41A1 человека содержит два домена MgtE с 52% и 46% соответственно сходством с консенсусной последовательностью PF01769 и, по прогнозам, содержит десять доменов TM, по пять в каждом домене MgtE (см. Рисунок), что предполагает, что белок MgtE бактерий может работать. в виде димера.
 Предсказанная топология TM MgtE из H. sapiens
Предсказанная топология TM MgtE из H. sapiens По материалам Wabakken et al. (2003) и базы данных pFAM, на рисунке показана предсказанная компьютером топология мембраны MgtE у H. sapiens. Домены TM показаны светло-синим цветом, указана ориентация в мембране и положения N- и C-концов, фигура не в масштабе.
Wabakken et al. (2003) обнаружили, что транскрипт гена SLC41A1 экспрессируется во всех протестированных тканях человека, но на разных уровнях, причем сердце и семенники имеют самую высокую экспрессию гена. Никакого объяснения паттерна экспрессии в отношении физиологии, связанной с Mg 2+, предложено не было.
Не было показано, транспортируют ли белки SLC41 Mg 2+ или дополняют транспортную мутацию Mg 2+ в какой-либо экспериментальной системе. Однако было высказано предположение, что, поскольку белки MgtE не имеют другой известной функции, они, вероятно, являются переносчиками Mg 2+ в метазоа, как и в бактериях. Это необходимо будет проверить с помощью одной из ныне стандартных экспериментальных систем для изучения транспорта Mg 2+.
Изучение генов и белков TRPM в клетках человека - это область интенсивных недавних исследований и, иногда, дискуссий. Montell et al. (2002) рассмотрели исследования генов TRP, а во втором обзоре Montell (2003) были рассмотрены исследования генов TRPM.
Семейство ионных каналов TRPM имеет членов во всем многоклеточном организме. Белки TRPM6 и TRPM7 очень необычны, они содержат как домен ионного канала, так и домен киназы (рис. 1.7), роль которых вызывает самые жаркие споры.
Активность этих двух белков очень трудно определить количественно. TRPM7 сам по себе, по-видимому, является каналом Ca 2+, но в присутствии TRPM6 ряд сродства транспортируемых катионов помещает Mg 2+ выше Ca 2+. Различия в сообщаемой проводимости были вызваны паттернами экспрессии этих генов. TRPM7 экспрессируется во всех протестированных типах клеток, тогда как TRPM6 демонстрирует более ограниченный паттерн экспрессии. Неудачный выбор экспериментальной системы Voets et al., (2004) привели к выводу, что TRPM6 является функциональным транспортером Mg 2+. Однако более поздняя работа Чубанова и др. (2004) ясно показали, что TRPM7 необходим для активности TRPM6 и что результаты Voets et al. объясняются экспрессией TRPM7 в экспериментальной клеточной линии, использованной Voets et al. в своих экспериментах. Функционален ли TRPM6 сам по себе, еще предстоит определить.
 Предсказанная топология TM белков TRPM6 и TRPM7
Предсказанная топология TM белков TRPM6 и TRPM7 Предсказанная топология TM белков TPRM6 и TRPM7 была адаптирована из Nadler et al. (2001), Runnels et al. (2001) и Montell et al. (2002), на этом рисунке показана предсказанная компьютером топология мембраны белков TRPM6 и TRPM7 у Homo sapiens. В настоящее время показанную топологию следует рассматривать как предварительную гипотезу. Домены TM показаны светло-синим цветом, петля поры - фиолетовым, мотив TRP - красным, а домен киназы - зеленым. Указаны ориентация в мембране и положения N- и C-концов, фигура не в масштабе.
Выводы Voets et al. (2004) вероятно ошибочно приписывают Mg 2+ зависимые токи только TRPM7, и их кинетические данные, вероятно, отражают объединенный канал TRPM7 / TRPM6. В отчете представлен надежный набор данных, согласующихся с канальной активностью при прохождении Mg 2+, на основе как электрофизиологических методов, так и маг-фуры 2 для определения изменений в цитоплазматическом свободном Mg 2+.
Клаудины позволяют транспортировать Mg 2+ через параклеточный путь; то есть он опосредует транспорт иона через плотные контакты между клетками, которые образуют слой эпителиальных клеток. В частности, Claudin-16 обеспечивает избирательный обратный захват Mg 2+ в почках человека. У некоторых пациентов с мутациями в гене CLDN19 также изменился транспорт магния.
Ген Claudin-16 был клонирован Simon et al. (1999), но только после того, как ряд сообщений описал сам поток Mg 2+ без гена или белка. Характер экспрессии гена определяли с помощью ОТ-ПЦР, и было показано, что он очень плотно ограничен непрерывной областью почечного канальца, идущей от толстой нисходящей конечности мозгового вещества к дистальному извитому канальцу. Эта локализация согласуется с более ранними сообщениями о местоположении повторного захвата Mg 2+ почками. После клонирования мутации в гене были идентифицированы у пациентов с семейной гипомагниемией с гиперкальциурией и нефрокальцинозом, что усилило связь между геном и поглощением Mg 2+.
Современные знания о молекулярных механизмах транспорта Mg 2+ в растениях очень ограничены, и только три публикации сообщают о молекулярной основе транспорта Mg 2+ в растениях. Однако важность Mg 2+ для растений была хорошо описана, и существует множество физиологических и экофизиологических исследований эффектов Mg 2+. В этом разделе будут обобщены сведения о семействе генов, идентифицированных у растений, которое отдаленно связано с CorA. Другой ген, обменник Mg 2+ / H + (AtMHX), не связанный с этим семейством генов и с CorA, также был идентифицирован, локализован на вакуолярной мембране и будет описан в последнюю очередь.
Schock et al. (2000) идентифицировали и назвали семейство AtMRS2 на основании сходства генов с геном MRS2 дрожжей. Авторы также показали, что ген AtMRS2-1 может дополнять мутантный фенотип дрожжей Δmrs2. Независимо Li et al. (2001) опубликовали отчет, идентифицирующий семейство и показывающий, что два дополнительных члена могут дополнять мутанты с дефицитом транспорта Mg 2+, один у S. typhimurium, а другой - у S. cerevisiae.
Было показано, что три гена, транспортирующие Mg 2+, - это AtMRS2-1, AtMRS2-10 и AtMRS2-11, и эти гены продуцируют белки размером 442, 443 и 459 аминокислот соответственно. Каждый из белков показывает значительное сходство с Mrs2p дрожжей и слабое сходство с CorA бактерий, содержит консервативный аминокислотный мотив GMN на внешнем конце первого TM-домена и, как предполагается, имеет два TM-домена.
Ген AtMRS2-1, когда он экспрессируется в дрожжах с промотора MRS2 и сливается на С-конце с первыми 95 аминокислотами белка Mrs2p, направляется в митохондрии, где он фенотипически дополняет мутант Δmrs2 (сплайсинг митохондриальной РНК был восстановлен) и в отношении содержания Mg 2+ в органелле. Данных о кинетике транспорта не было. Ген AtMRS2-11 был проанализирован на дрожжах (в штамме alr1 alr2), где было показано, что экспрессия гена значительно увеличивает скорость поглощения Mg 2+ голодными клетками по сравнению с контролем, как измерено с помощью пламенной атомно-абсорбционной спектроскопии общее содержание Mg 2+ в клетках. Однако было показано, что Alr1p значительно более эффективен при транспортировке Mg 2+ при низких внеклеточных концентрациях, что позволяет предположить, что сродство AtMRS2-11 к Mg 2+ ниже, чем сродство Alr1p. Электрофизиологический анализ белка AtMRS2-11 в ооцитах Xenopus также показал наличие Mg 2+ -зависимого тока при мембранных потенциалах (ΔΨ) от –100 до –150 мВ внутри. Эти значения являются физиологически значимыми, поскольку некоторые мембраны растений поддерживают ΔΨ в этом диапазоне. Однако автору было трудно воспроизвести эти результаты из-за очевидной «гибели» ооцитов, содержащих белок AtMRS2-11, и поэтому к этим результатам следует относиться с осторожностью.
Транспортер AtMRS2-10 был проанализирован с использованием анализа поглощения радиоактивных индикаторов. 63Ni 2+ использовали в качестве замещающего иона, и было показано, что Mg 2+ ингибирует поглощение 63Ni 2+ с Ki 20 мкМ. Поглощение также ингибировалось Co (III) Hex и другими двухвалентными катионами. Только Co 2+ и Cu 2+ ингибировали транспорт со значениями Ki менее 1 мМ.
Белок AtMRS2-10 был слит с GFP, и было показано, что он локализован на плазматической мембране. Аналогичный эксперимент был предпринят Schock et al. (2000), но наблюдаемая локализация существенно не отличалась от той, что наблюдалась при использовании неслитого GFP. Наиболее вероятная причина отсутствия окончательной локализации AtMRS2-1 в Schock et al. В статье говорится, что авторы удалили TM-домены из белка, тем самым предотвратив его встраивание в мембрану.
Точное физиологическое значение белков AtMRS2-1 и AtMRS2-10 в растениях еще предстоит выяснить. Ген AtMRS2-11 сверхэкспрессирован (с промотора 35S CaMV) у A. thaliana. Было показано, что трансгенная линия накапливает высокие уровни транскрипта AtMRS2-11. Сильный фенотип дефицита Mg 2+ (некротические пятна на листьях, см. Главу 1.5 ниже) был зарегистрирован во время процесса скрининга (как в поколении T1, так и в поколении T2) для гомозиготной линии, но этот фенотип был утерян в поколении T3 и мог не могут быть воспроизведены при повторном просмотре предыдущих поколений. Автор предположил, что влияние окружающей среды было наиболее вероятной причиной несовместимого фенотипа.
Первый переносчик магния, выделенный в любом многоклеточном организме, AtMHX не имеет сходства с каким-либо ранее выделенным транспортным белком Mg 2+. Ген был первоначально идентифицирован в базе данных геномных последовательностей ДНК A. thaliana по его сходству с генами обменников Na + / Ca 2+ семейства SLC8 у людей.
Предполагается, что последовательность кДНК длиной 1990 п.н. будет производить белок из 539 аминокислот. AtMHX довольно тесно связан с семейством SLC8 на аминокислотном уровне и имеет общую топологию с одиннадцатью предсказанными доменами TM (рисунок A10.5). Есть одно важное различие в последовательности: длинная немембранная петля (см. Рисунок A10.5) состоит из 148 аминокислот в белке AtMHX и 500 аминокислот в белках SLC8. Однако эта петля плохо сохранена и не требуется для транспортной функции в семействе SLC8.
Ген AtMHX экспрессируется во всем растении, но наиболее сильно в сосудистой ткани. Авторы предполагают, что физиологическая роль белка заключается в хранении Mg 2+ в этих тканях для последующего высвобождения, когда это необходимо. Локализация белка в вакуолярной мембране подтверждает это предположение (см. Также главу 1.5).
Белок транспортирует Mg 2+ в вакуолярное пространство и H + наружу, что продемонстрировано электрофизиологическими методами. Транспорт осуществляется за счет ΔpH, поддерживаемого между вакуолярным пространством (pH 4,5 - 5,9) и цитоплазмой (pH 7,3 - 7,6) с помощью H + -АТФазы. Как регулируется транспорт Mg 2+ белком, не определено. Было замечено, что токи проходят через белок в обоих направлениях, но выходящий ток Mg 2+ требует «цитоплазматического» pH 5,5, условия, не обнаруживаемого в растительных клетках при нормальных обстоятельствах. Помимо транспорта Mg 2+, Shaul et al. (1999) также показали, что белок может транспортировать Zn 2+ и Fe 2+, но не сообщили о способности белка транспортировать другие двухвалентные катионы (например, Co 2+ и Ni 2+) или его чувствительности к ингибированию кобальтом. (III) гексааммин.
Детальная кинетика транспорта Mg 2+ не была определена для AtMHX. Однако были продемонстрированы физиологические эффекты. Когда растения A. thaliana трансформировали конструкциями сверхэкспрессии гена AtMHX, управляемыми промотором 35S CaMV, растения чрезмерно накапливали белок и проявляли фенотип некротических повреждений в листьях, что, по мнению авторов, вызвано нарушением нормальная функция вакуоли, учитывая их наблюдения, что общее содержание Mg 2+ (или Zn 2+) в растениях не изменилось в трансгенных растениях.
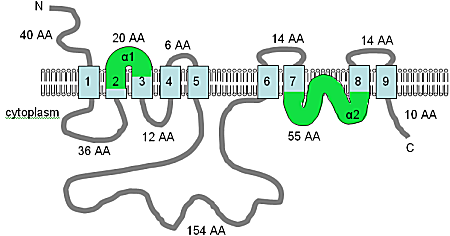 Прогнозируемая топология TM белка AtMHX
Прогнозируемая топология TM белка AtMHX Изображение было адаптировано из Shaul et al. (1999) и Quednau et al. (2004), и в сочетании с анализом с использованием HMMTOP, этот рисунок показывает предсказанную компьютером топологию мембраны белка AtMHX у Arabidopsis thaliana. На данный момент показанную топологию следует рассматривать как предварительную гипотезу. Домены TM показаны светло-синим цветом, указана ориентация в мембране и положения N- и C-концов, фигура не в масштабе. Домены α1 и α2, показанные зеленым цветом, оба достаточно гидрофобны и оба могут быть вставлены в мембрану.