 Долгосрочная потенциация (ДП) - это стойкое увеличение силы синапсов после высокочастотной стимуляции химического синапса. Исследования LTP часто проводят на срезах гиппокампа, важного органа для обучения и памяти. В таких исследованиях электрические записи делаются из клеток и наносятся на график, подобный этому. На этом графике сравнивается реакция на стимулы в синапсах, подвергшихся LTP, и синапсах, которые не подвергались LTP. Синапсы, подвергшиеся LTP, как правило, имеют более сильные электрические ответы на стимулы, чем другие синапсы. Термин долгосрочная потенциация происходит от того факта, что это увеличение синаптической силы или потенцирования длится очень долго по сравнению с другими процессами, влияющими на синаптическую силу.
Долгосрочная потенциация (ДП) - это стойкое увеличение силы синапсов после высокочастотной стимуляции химического синапса. Исследования LTP часто проводят на срезах гиппокампа, важного органа для обучения и памяти. В таких исследованиях электрические записи делаются из клеток и наносятся на график, подобный этому. На этом графике сравнивается реакция на стимулы в синапсах, подвергшихся LTP, и синапсах, которые не подвергались LTP. Синапсы, подвергшиеся LTP, как правило, имеют более сильные электрические ответы на стимулы, чем другие синапсы. Термин долгосрочная потенциация происходит от того факта, что это увеличение синаптической силы или потенцирования длится очень долго по сравнению с другими процессами, влияющими на синаптическую силу. В неврологии, долговременная потенциация ( ДП) является стойким усилением синапсов на основе последних моделей деятельности. Это паттерны синаптической активности, которые вызывают длительное усиление передачи сигнала между двумя нейронами. Противоположностью ДП является длительная депрессия, которая вызывает длительное снижение синаптической силы.
Это один из нескольких феноменов, лежащих в основе синаптической пластичности, способности химических синапсов изменять свою силу. Поскольку считается, что воспоминания кодируются изменением силы синапсов, LTP широко считается одним из основных клеточных механизмов, лежащих в основе обучения и памяти.
LTP был обнаружен в кроличьей гиппокампа по Терье ЛОМО в 1966 году и оставался популярным предметом исследований с тех пор. Многие современные исследования LTP стремятся лучше понять его базовую биологию, в то время как другие стремятся установить причинно-следственную связь между LTP и поведенческим обучением. Третьи пытаются разработать фармакологические или иные методы усиления ДП для улучшения обучения и памяти. LTP также является предметом клинических исследований, например, в области медицины Альцгеймера и наркологии.
 Нейроанатом XIX века Сантьяго Рамон-и-Кахаль предположил, что воспоминания могут храниться в синапсах, соединениях между нейронами, которые позволяют им общаться.
Нейроанатом XIX века Сантьяго Рамон-и-Кахаль предположил, что воспоминания могут храниться в синапсах, соединениях между нейронами, которые позволяют им общаться. В конце XIX века ученые в целом признали, что количество нейронов в мозге взрослого человека (примерно 100 миллиардов) не увеличивается с возрастом, давая нейробиологам веские основания полагать, что воспоминания, как правило, не являются результатом производства новых нейронов. С осознанием этого пришла необходимость объяснить, как воспоминания могут формироваться в отсутствие новых нейронов.
Испанский нейроанатом Сантьяго Рамон Кахаль был одним из первых, чтобы предложить механизм обучения, который не требует формирования новых нейронов. В своей крооновской лекции 1894 года он предположил, что вместо этого воспоминания могут формироваться путем усиления связей между существующими нейронами для повышения эффективности их коммуникации. Теория Хебба, представленная Дональдом Хеббом в 1949 году, вторила идеям Рамона-и-Кахала, предполагая, что клетки могут вырабатывать новые связи или претерпевать метаболические и синаптические изменения, которые повышают их способность общаться и создавать нейронную сеть опыта:
Предположим, что постоянство или повторение реверберационной активности (или «следа») имеет тенденцию вызывать длительные клеточные изменения, которые добавляют к ее стабильности... Когда аксон клетки A находится достаточно близко, чтобы возбуждать клетку B и многократно или постоянно участвует в его возбуждении, в одной или обеих клетках происходят некоторые процессы роста или метаболические изменения, так что эффективность A как одной из клеток, запускающих B, увеличивается.
Эрик Кандел (1964) и его сотрудники были одними из первых исследователей, открывших долгосрочное потенцирование во время работы с морскими слизнями Aplysia. Они попытались применить поведенческое кондиционирование к различным клеткам нейронной сети слизня. Их результаты показали изменения синаптической силы, и исследователи предположили, что это может быть связано с базовой формой обучения, происходящей внутри слизняка.
Хотя эти теории формирования памяти в настоящее время хорошо известны, они были дальновидными для своего времени: нейробиологи и психологи конца 19-го и начала 20-го веков не были оснащены нейрофизиологическими методами, необходимыми для выяснения биологических основ обучения у животных. Эти навыки появятся только во второй половине 20-го века, примерно в то же время, что и открытие долгосрочного потенцирования.
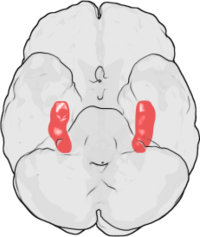 LTP был впервые обнаружен в гиппокампе кролика. У человека гиппокамп расположен в медиальной височной доле. На этой иллюстрации нижней части человеческого мозга красным выделен гиппокамп. Лобная доля находится в верхней части рисунка и затылочная лопасть находится в нижней части.
LTP был впервые обнаружен в гиппокампе кролика. У человека гиппокамп расположен в медиальной височной доле. На этой иллюстрации нижней части человеческого мозга красным выделен гиппокамп. Лобная доля находится в верхней части рисунка и затылочная лопасть находится в нижней части. LTP впервые наблюдал Терье Лёмо в 1966 году в Осло, Норвегия, в лаборатории Пера Андерсена. Там Лёмо провел серию нейрофизиологических экспериментов на анестезированных кроликах, чтобы изучить роль гиппокампа в кратковременной памяти.
Эксперименты Лёмо были сосредоточены на связях или синапсах от перфорантного пути до зубчатой извилины. Эти эксперименты проводились путем стимуляции пресинаптических волокон перфорантного пути и регистрации ответов от набора постсинаптических клеток зубчатой извилины. Как и ожидалось, одиночный импульс электростимуляции волокон перфорантного пути вызывал возбуждающие постсинаптические потенциалы (ВПСП) в клетках зубчатой извилины. Лемо неожиданно заметил, что реакция постсинаптических клеток на эти одноимпульсные стимулы может быть усилена в течение длительного периода времени, если он сначала доставит высокочастотную серию стимулов к пресинаптическим волокнам. Когда применялась такая последовательность стимулов, последующие одноимпульсные стимулы вызывали более сильные и продолжительные ВПСП в популяции постсинаптических клеток. Этот феномен, при котором высокочастотный стимул может вызывать долгосрочное усиление реакции постсинаптических клеток на последующие одноимпульсные стимулы, первоначально был назван «длительной потенциацией».
Тимоти Блисс, который присоединился к лаборатории Андерсена в 1968 году, сотрудничал с Лёмо, и в 1973 году они оба опубликовали первую характеристику длительного потенцирования в гиппокампе кролика. Блисс и Тони Гарднер-Медвин опубликовали аналогичный отчет о длительном потенцировании у бодрствующего животного, который появился в том же выпуске, что и отчет Блисса и Лемо. В 1975 году Дуглас и Годдард предложили «долгосрочное потенцирование» в качестве нового названия феномена долговременного потенцирования. Андерсен предположил, что авторы выбрали «долгосрочное потенцирование», возможно, из-за легко произносимой аббревиатуры «LTP».
 Синапс многократно стимулируется.
Синапс многократно стимулируется. 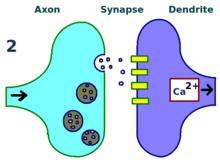 Больше дендритных рецепторов.
Больше дендритных рецепторов. 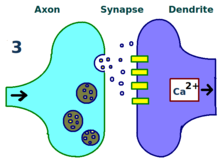 Больше нейротрансмиттеров.
Больше нейротрансмиттеров.  Более сильная связь между нейронами.
Более сильная связь между нейронами. Физический и биологический механизм LTP до сих пор не изучен, но были разработаны некоторые успешные модели. [1] Исследования дендритных шипов, выступающих структур на дендритах, которые физически растут и втягиваются в течение минут или часов, показали взаимосвязь между электрическим сопротивлением позвоночника и эффективной силой синапсов из-за их взаимосвязи с переходными процессами внутриклеточного кальция.. Математические модели, такие как теория BCM, которая также зависит от внутриклеточного кальция по отношению к воротам напряжения рецептора NMDA, разрабатывались с 1980-х годов и модифицируют традиционную априорную модель обучения Хебба как с биологическим, так и с экспериментальным обоснованием. Третьи предложили перестроить или синхронизировать отношения между регуляцией рецепторов, LTP и синаптической силой.
С момента своего первоначального открытия в гиппокампе кроликов, LTP наблюдали во множестве других нервных структур, включая кору головного мозга, мозжечок, миндалевидное тело и многие другие. Роберт Маленка, известный исследователь LTP, предположил, что LTP может даже встречаться во всех возбуждающих синапсах в головном мозге млекопитающих.
В разных областях мозга обнаруживаются разные формы ДП. Конкретный тип LTP между нейронами зависит от ряда факторов. Одним из таких факторов является возраст организма, когда наблюдается ДП. Например, молекулярные механизмы LTP в незрелом гиппокампе отличаются от тех механизмов, которые лежат в основе LTP гиппокампа взрослых. Сигнальные пути, используемые конкретной клеткой, также вносят вклад в конкретный тип присутствующего LTP. Например, некоторые типы LTP гиппокампа зависят от рецептора NMDA, другие могут зависеть от метаботропного рецептора глутамата (mGluR), а третьи полностью зависят от другой молекулы. Разнообразие сигнальных путей, которые вносят вклад в LTP, и широкое распространение этих различных путей в головном мозге являются причинами того, что тип LTP, проявляемый между нейронами, лишь частично зависит от анатомического местоположения, в котором наблюдается LTP. Например, LTP в коллатеральном пути Шаффера гиппокампа является зависимым от рецептора NMDA - это было доказано применением AP5, антагониста рецептора NMDA, который предотвращал LTP в этом пути. Напротив, LTP в пути мшистых волокон не зависит от рецепторов NMDA, хотя оба пути находятся в гиппокампе.
Пре- и постсинаптическая активность, необходимая для индукции LTP, - это другие критерии, по которым классифицируется LTP. В целом это позволяет классифицировать LTP на хеббийские, не-хеббийские и антихеббийские механизмы. Заимствуя свое название из постулата Хебба, резюмируемого максимой, что «клетки, которые активируются вместе, соединяются вместе», Хеббийский LTP требует одновременной пре- и постсинаптической деполяризации для своей индукции. Негеббийский LTP - это тип LTP, который не требует такой одновременной деполяризации пре- и постсинаптических клеток; Пример этого происходит в мшистых волокнах гиппокампа. Частный случай не-хеббовского LTP, анти-хеббийский LTP, явно требует одновременной пресинаптической деполяризации и относительной постсинаптической гиперполяризации для своей индукции.
Благодаря своей предсказуемой организации и легко индуцируемой LTP, гиппокамп CA1 стал прототипом исследования LTP у млекопитающих. В частности, зависимый от рецептора NMDA LTP в гиппокампе взрослого CA1 является наиболее широко изученным типом LTP и поэтому является предметом внимания данной статьи.
LTP, зависимый от рецептора NMDA, проявляет несколько свойств, в том числе входную специфичность, ассоциативность, кооперативность и устойчивость.
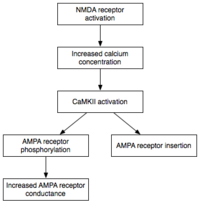 Ранняя фаза LTP, одна из моделей которой показана здесь, не зависит от синтеза белка.
Ранняя фаза LTP, одна из моделей которой показана здесь, не зависит от синтеза белка.  Ca 2+ / кальмодулин-зависимая протеинкиназа II (CaMKII), по-видимому, является важным медиатором ранней, независимой от синтеза белка фазы LTP.
Ca 2+ / кальмодулин-зависимая протеинкиназа II (CaMKII), по-видимому, является важным медиатором ранней, независимой от синтеза белка фазы LTP. В то время как индукция влечет за собой временную активацию CaMKII и PKC, поддержание E-LTP (ранняя форма LTP) характеризуется их постоянной активацией. На этом этапе PKMz ( протеинкиназа Mζ ), не зависящая от кальция, становится автономно активной. Следовательно, они способны осуществлять события фосфорилирования, лежащие в основе экспрессии E-LTP.
Фосфорилирование - это химическая реакция, в которой небольшая фосфатная группа добавляется к другой молекуле, чтобы изменить активность этой молекулы. Автономно активные CaMKII и PKC используют фосфорилирование для выполнения двух основных механизмов, лежащих в основе экспрессии E-LTP. Во-первых, что наиболее важно, они фосфорилируют существующие рецепторы AMPA для повышения их активности. Во-вторых, они опосредуют или модулируют внедрение дополнительных рецепторов AMPA в постсинаптическую мембрану. Важно отметить, что доставка рецепторов AMPA к синапсу во время E-LTP не зависит от синтеза белка. Это достигается за счет наличия несинаптического пула рецепторов AMPA, прилегающего к постсинаптической мембране. Когда поступает соответствующий стимул, индуцирующий LTP, несинаптические рецепторы AMPA быстро попадают в постсинаптическую мембрану под влиянием протеинкиназ. Как упоминалось ранее, рецепторы AMPA являются наиболее многочисленными рецепторами глутамата в головном мозге и опосредуют большую часть его возбуждающей активности. Повышая эффективность и количество рецепторов AMPA в синапсе, будущие возбуждающие стимулы генерируют более сильные постсинаптические ответы.
Хотя вышеупомянутая модель E-LTP полностью описывает постсинаптические механизмы индукции, поддержания и экспрессии, дополнительный компонент экспрессии может происходить пресинаптически. Одна из гипотез этого пресинаптического облегчения состоит в том, что постоянная активность CaMKII в постсинаптической клетке во время E-LTP может приводить к синтезу «ретроградного мессенджера», что обсуждается позже. Согласно этой гипотезе, вновь синтезированный мессенджер проходит через синаптическую щель от постсинаптической клетки к пресинаптической, приводя к цепочке событий, которые облегчают пресинаптическую реакцию на последующие стимулы. Такие события могут включать увеличение числа везикул нейромедиатора, вероятность высвобождения везикул или и то, и другое. Помимо ретроградного мессенджера, лежащего в основе пресинаптической экспрессии в ранних LTP, ретроградный мессенджер также может играть роль в экспрессии поздних LTP.
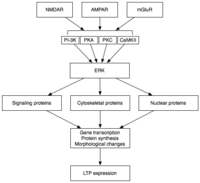 Считается, что ранняя и поздняя фазы LTP передаются через киназу, регулируемую внеклеточными сигналами (ERK).
Считается, что ранняя и поздняя фазы LTP передаются через киназу, регулируемую внеклеточными сигналами (ERK). Поздний LTP (L-LTP) является естественным продолжением E-LTP. В отличие от E-LTP, который не зависит от синтеза белка, L-LTP требует транскрипции генов и синтеза белка в постсинаптической клетке. Существуют две фазы L-LTP: первая зависит от синтеза белка, а вторая зависит как от транскрипции гена, так и от синтеза белка. Эти фазы иногда называют LTP2 и LTP3 соответственно, а E-LTP в этой номенклатуре обозначается как LTP1.
Поздний LTP индуцируется изменениями экспрессии генов и синтеза белка, вызванными постоянной активацией протеинкиназ, активируемых во время E-LTP, таких как MAPK. Фактически, MAPK - в частности подсемейство киназ, регулируемых внеклеточными сигналами (ERK) MAPK, - может быть молекулярным звеном между E-LTP и L-LTP, поскольку многие сигнальные каскады, участвующие в E-LTP, включая CaMKII и PKC, могут сходиться на ERK. Недавние исследования показали, что индукция L-LTP может зависеть от совпадающих молекулярных событий, а именно активации PKA и притока кальция, которые сходятся на CRTC1 (TORC1), мощном транскрипционном коактиваторе для белка, связывающего элемент ответа цАМФ (CREB). Это требование молекулярного совпадения полностью объясняет ассоциативный характер LTP и, предположительно, обучения.
После активации ERK может фосфорилировать ряд цитоплазматических и ядерных молекул, что в конечном итоге приводит к синтезу белка и морфологическим изменениям, наблюдаемым в L-LTP. Эти цитоплазматические и ядерные молекулы могут включать факторы транскрипции, такие как CREB. ERK-опосредованные изменения активности фактора транскрипции могут запускать синтез белков, лежащих в основе поддержания L-LTP. Одной из таких молекул может быть протеинкиназа Mζ (PKMζ), постоянно активная киназа, синтез которой увеличивается после индукции LTP. PKMζ является атипичной изоформой PKC, в которой отсутствует регуляторная субъединица, и поэтому она остается конститутивно активной. В отличие от других киназ, которые опосредуют LTP, PKMζ активна не только в первые 30 минут после индукции LTP; скорее, PKMζ становится требованием для поддержания LTP только во время поздней фазы LTP. PKMζ, таким образом, оказывается важным для сохранения памяти и, как ожидается, играет важную роль в поддержании долговременной памяти. Действительно, введение ингибитора PKMζ в гиппокамп крысы приводит к ретроградной амнезии с интактной кратковременной памятью ; PKMζ не играет роли в установлении кратковременной памяти. Недавно было показано, что PKMζ лежит в основе поддержания L-LTP, управляя перемещением и реорганизацией белков в синаптических каркасах, которые лежат в основе экспрессии L-LTP. Еще совсем недавно трансгенные мыши, лишенные PKMζ, демонстрируют нормальный LTP, что ставит под сомнение необходимость PKMζ.
Долговременная стабилизация синаптических изменений также определяется параллельным увеличением пре- и постсинаптических структур, таких как аксональный бутон, дендритный шип и постсинаптическая плотность. На молекулярном уровне было показано, что увеличение постсинаптических каркасных белков PSD-95 и Homer1c коррелирует со стабилизацией синаптического расширения.
Идентичность только нескольких белков, синтезируемых во время L-LTP, известна. Независимо от их идентичности, считается, что они способствуют увеличению числа дендритных шипов, площади поверхности и постсинаптической чувствительности к нейромедиаторам, связанным с экспрессией L-LTP. Последнее может быть частично вызвано усиленным синтезом рецепторов AMPA во время L-LTP. Поздний LTP также связан с пресинаптическим синтезом синаптотагмина и увеличением количества синаптических везикул, предполагая, что L-LTP индуцирует синтез белка не только в постсинаптических клетках, но и в пресинаптических клетках. Как упоминалось ранее, для того, чтобы индукция постсинаптического LTP приводила к пресинаптическому синтезу белка, должна быть связь от постсинаптической к пресинаптической клетке. Это может происходить через синтез ретроградного посланника, который обсуждается позже.
Даже в исследованиях, ограниченных постсинаптическими событиями, исследователи не определили место синтеза белка, лежащего в основе L-LTP. В частности, неясно, происходит ли синтез белка в теле постсинаптической клетки или в ее дендритах. Несмотря на то, что рибосомы (основные компоненты механизма синтеза белка) в дендритах наблюдались еще в 1960-х годах, преобладала точка зрения, согласно которой тело клетки было основным местом синтеза белка в нейронах. Это рассуждение серьезно не оспаривалось до 1980-х годов, когда исследователи сообщили о наблюдении синтеза белка в дендритах, связь которых с их клеточным телом была прервана. Совсем недавно исследователи продемонстрировали, что этот тип локального синтеза белка необходим для некоторых типов LTP.
Одна из причин популярности гипотезы о локальном синтезе белка заключается в том, что она обеспечивает возможный механизм специфичности, связанной с LTP. В частности, если в основе L-LTP действительно лежит локальный синтез белка, только дендритные шипы, получающие LTP-индуцирующие стимулы, будут подвергаться LTP; потенциация не будет распространяться на соседние синапсы. Напротив, глобальный синтез белка, который происходит в теле клетки, требует, чтобы белки были доставлены во все области клетки, включая синапсы, которые не получили стимулы, индуцирующие LTP. В то время как локальный синтез белка обеспечивает механизм специфичности, глобальный синтез белка, по-видимому, напрямую его нарушает. Однако, как обсуждается позже, гипотеза синаптического тегирования успешно согласовывает глобальный синтез белка, специфичность синапсов и ассоциативность.
Ретроградная передача сигналов - это гипотеза, которая пытается объяснить, что, хотя LTP индуцируется и экспрессируется постсинаптически, некоторые данные предполагают, что он экспрессируется также пресинаптически. Гипотеза получила свое название, потому что нормальная синаптическая передача является направленной и идет от пресинаптической к постсинаптической клетке. Чтобы индукция происходила постсинаптически и частично выражалась пресинаптически, сообщение должно перемещаться от постсинаптической клетки к пресинаптической клетке в ретроградном (обратном) направлении. Оказавшись там, сообщение предположительно инициирует каскад событий, который приводит к пресинаптическому компоненту экспрессии, например, к повышенной вероятности высвобождения везикул нейромедиатора.
Ретроградная передача сигналов в настоящее время является предметом споров, поскольку некоторые исследователи не верят, что пресинаптические клетки вообще вносят вклад в экспрессию LTP. Даже среди сторонников гипотезы существуют разногласия по поводу личности посланника. Ранние мысли были сосредоточены на оксиде азота, в то время как самые последние данные указывают на белки клеточной адгезии.
До того, как гипотеза о локальном синтезе белка получила значительную поддержку, существовало общее мнение, что синтез белка, лежащего в основе L-LTP, происходит в теле клетки. Кроме того, считалось, что продукты этого синтеза неспецифическим образом доставлялись по всей клетке. Таким образом, возникла необходимость объяснить, как синтез белка может происходить в теле клетки без ущерба для специфичности входа LTP. Гипотеза синаптической маркировки пытается решить сложную проблему синтеза белков в теле клетки, но гарантирует, что они достигают только синапсов, которые получили стимулы, индуцирующие LTP.
Гипотеза синаптической маркировки предполагает, что «синаптическая метка» синтезируется в синапсах, которые получили LTP-индуцирующие стимулы, и что эта синаптическая метка может служить для захвата связанных с пластичностью белков, доставляемых по всей клетке из тела клетки. Исследования LTP у морской улитки Aplysia californica показали, что синаптическое мечение является механизмом специфичности входа LTP. Есть некоторые свидетельства того, что при двух широко разделенных синапсах стимул, индуцирующий LTP в одном синапсе, запускает несколько сигнальных каскадов (описанных ранее), которые инициируют экспрессию генов в ядре клетки. В том же синапсе (но не в нестимулированном синапсе) локальный синтез белка создает недолговечную (менее трех часов) синаптическую метку. Продукты экспрессии генов распространяются по всей клетке по всему миру, но захватываются только синапсами, которые экспрессируют синаптический тег. Таким образом, потенцируется только синапс, получающий стимулы, индуцирующие LTP, что демонстрирует специфичность входа LTP.
Гипотеза синаптических тегов может также учитывать ассоциативность и кооперативность LTP. Ассоциативность ( см. Свойства) наблюдается, когда один синапс возбуждается LTP-индуцирующей стимуляцией, в то время как отдельный синапс стимулируется слабо. Принимая во внимание, что можно было ожидать, что только сильно стимулированный синапс подвергнется LTP (поскольку одной слабой стимуляции недостаточно для индукции LTP в любом синапсе), на самом деле оба синапса будут подвергаться LTP. Хотя слабые стимулы не могут вызвать синтез белка в теле клетки, они могут вызвать синтез синаптической метки. Одновременная сильная стимуляция отдельного пути, способного индуцировать синтез белков тела клетки, затем может вызвать производство белков, связанных с пластичностью, которые доставляются по всей клетке. Когда оба синапса экспрессируют синаптическую метку, оба будут захватывать белковые продукты, что приводит к экспрессии LTP как в сильно стимулированном, так и в слабостимулированном путях.
Кооперативность наблюдается, когда два синапса активируются слабыми стимулами, неспособными индуцировать LTP при индивидуальной стимуляции. Но при одновременной слабой стимуляции оба синапса кооперативно подвергаются ДП. Синаптическая маркировка не объясняет, как множественные слабые стимулы могут приводить к коллективному стимулу, достаточному для индукции ДП (это объясняется постсинаптическим суммированием ВПСП, описанным ранее). Скорее, синаптическая маркировка объясняет способность слабо стимулированных синапсов, ни один из которых не способен независимо генерировать LTP, получать продукты синтеза белка, инициированного коллективно. Как и раньше, это может быть достигнуто путем синтеза локальной синаптической метки после слабой синаптической стимуляции.
| Модулятор | Цель |
|---|---|
| β-адренорецептор | цАМФ, усиление MAPK |
| Синтаза оксида азота | Гуанилилциклаза, PKG, NMDAR |
| Рецептор допамина | цАМФ, усиление MAPK |
| Метаботропный рецептор глутамата | PKC, усиление MAPK |
Как описано ранее, молекулы, лежащие в основе LTP, можно классифицировать как медиаторы или модуляторы. Медиатор LTP представляет собой молекулу, такую как рецептор NMDA или кальций, присутствие и активность которой необходимы для генерации LTP почти во всех условиях. Напротив, модулятор - это молекула, которая может изменять LTP, но не важна для его образования или экспрессии.
В дополнение к сигнальным путям, описанным выше, LTP гиппокампа может изменяться множеством модуляторов. Например, стероидный гормон эстрадиол может усиливать LTP, управляя фосфорилированием CREB и последующим ростом дендритных шипов. Кроме того, агонисты β-адренергических рецепторов, такие как норэпинефрин, могут изменять зависимую от синтеза белка позднюю фазу LTP. Активность синтазы оксида азота также может приводить к последующей активации гуанилилциклазы и PKG. Точно так же активация дофаминовых рецепторов может усиливать LTP через сигнальный путь цАМФ / PKA.
В то время как долгосрочное усиление синапсов в клеточной культуре, по-видимому, обеспечивает элегантный субстрат для обучения и памяти, вклад LTP в поведенческое обучение, то есть обучение на уровне всего организма, нельзя просто экстраполировать из исследований in vitro.. По этой причине значительные усилия были направлены на то, чтобы установить, является ли LTP требованием для обучения и памяти у живых животных. Из-за этого LTP также играет решающую роль в обработке страха.
 Задача водного лабиринта Морриса использовалась для демонстрации необходимости рецепторов NMDA в установлении пространственной памяти.
Задача водного лабиринта Морриса использовалась для демонстрации необходимости рецепторов NMDA в установлении пространственной памяти. В 1986 году Ричард Моррис предоставил некоторые из первых доказательств того, что LTP действительно необходим для формирования воспоминаний in vivo. Он проверил пространственную память крыс, фармакологически изменив их гиппокамп - структуру мозга, роль которой в пространственном обучении хорошо известна. Крыс обучили водному лабиринту Морриса, задаче пространственной памяти, в которой крысы плавают в бассейне с мутной водой, пока не обнаружат платформу, скрытую под ее поверхностью. Ожидается, что во время этого упражнения нормальные крысы будут ассоциировать расположение скрытой платформы с заметными сигналами, размещенными в определенных местах по окружности лабиринта. После обучения гиппокампы одной группы крыс были купаны в блокаторе рецепторов NMDA APV, тогда как другая группа служила контролем. Затем обе группы были подвергнуты задаче на пространственную память в водном лабиринте. Крысы в контрольной группе смогли найти платформу и покинуть бассейн, в то время как производительность крыс, получавших APV, была значительно снижена. Более того, когда срезы гиппокампа были взяты у обеих групп, LTP легко индуцировался в контроле, но не мог быть индуцирован в мозге крыс, получавших APV. Это предоставило ранние доказательства того, что рецептор NMDA - и, в более широком смысле, LTP - необходим по крайней мере для некоторых типов обучения и памяти.
Точно так же Сусуму Тонегава продемонстрировал в 1996 году, что область CA1 гиппокампа имеет решающее значение для формирования пространственной памяти у живых мышей. Так называемые ячейки места, расположенные в этой области, становятся активными только тогда, когда крыса находится в определенном месте - называемом полем места - в окружающей среде. Поскольку эти поля мест распределены по окружающей среде, одна из интерпретаций состоит в том, что группы клеток мест формируют карты в гиппокампе. Точность этих карт определяет, насколько хорошо крыса узнает об окружающей среде и, следовательно, насколько хорошо она может ориентироваться в ней. Тонегава обнаружил, что за счет нарушения рецептора NMDA, в частности путем генетического удаления субъединицы NR1 в области CA1, генерируемые поля мест были существенно менее специфичными, чем поля контроля. То есть мыши создавали неправильные пространственные карты, когда их рецепторы NMDA были повреждены. Как и ожидалось, эти мыши очень плохо справлялись с пространственными задачами по сравнению с контрольной группой, что дополнительно подтверждает роль LTP в пространственном обучении.
Повышенная активность рецептора NMDA в гиппокампе также способствует усилению LTP и общему улучшению пространственного обучения. В 1999 году Tang et al. получили линию мышей с усиленной функцией рецептора NMDA за счет сверхэкспрессии субъединицы NR2B в гиппокампе. Получившиеся в результате умные мыши, получившие прозвище «Дуги-мыши» в честь вымышленного выдающегося доктора Дуги Хаузера, имели больший LTP и преуспели в задачах пространственного обучения, что подчеркивало важность LTP в формировании зависимых от гиппокампа воспоминаний.
В 2006 году Джонатан Уитлок и его коллеги сообщили о серии экспериментов, которые предоставили, пожалуй, самые убедительные доказательства роли LTP в поведенческой памяти, утверждая, что для вывода о том, что LTP лежит в основе поведенческого обучения, эти два процесса должны имитировать и перекрывать друг друга. Используя парадигму обучения тормозящего избегания, исследователи тренировали крыс в двухкамерном аппарате со светлой и темной камерами, последняя была оснащена устройством, которое наносило крысе удар ногой при входе. Анализ синапсов гиппокампа CA1 показал, что тренировка ингибирующего избегания индуцировала in vivo фосфорилирование рецептора AMPA того же типа, что и наблюдаемое в LTP in vitro ; то есть тренировка ингибирующего избегания имитировала ДП. Кроме того, синапсы, потенцированные во время тренировки, не могли быть дополнительно усилены экспериментальными манипуляциями, которые в противном случае индуцировали бы LTP; то есть тренировка с ингибирующим избеганием перекрывала LTP. В ответ на статью Тимоти Блисс и его коллеги отметили, что эти и связанные с ними эксперименты «существенно продвигают аргументы в пользу LTP как нейронного механизма памяти».
Роль LTP в заболевании менее ясна, чем его роль в основных механизмах синаптической пластичности. Однако изменения LTP могут способствовать ряду неврологических заболеваний, включая депрессию, болезнь Паркинсона, эпилепсию и невропатическую боль. Нарушение LTP также может иметь значение при болезни Альцгеймера и наркомании.
 Неправильная обработка белка-предшественника амилоида (APP) при болезни Альцгеймера нарушает LTP и, как полагают, приводит к раннему снижению когнитивных функций у людей с этим заболеванием.
Неправильная обработка белка-предшественника амилоида (APP) при болезни Альцгеймера нарушает LTP и, как полагают, приводит к раннему снижению когнитивных функций у людей с этим заболеванием. LTP привлекла большое внимание среди тех, кто изучает болезнь Альцгеймера (БА), нейродегенеративное заболевание, которое вызывает заметное снижение когнитивных функций и деменцию. По большей части это ухудшение происходит в связи с дегенеративными изменениями гиппокампа и других структур медиальной височной доли. Из-за хорошо известной роли гиппокампа в LTP, некоторые предположили, что снижение когнитивных функций, наблюдаемое у людей с AD, может быть результатом нарушения LTP.
В обзоре литературы за 2003 год Rowan et al. предложил одну модель того, как LTP может быть затронут в AD. БА, по-видимому, является результатом, по крайней мере частично, неправильной обработки белка-предшественника амилоида (АРР). Результатом этого аномального процессинга является накопление фрагментов этого белка, называемых амилоидом β (Aβ). Aβ существует как в растворимой, так и в фибриллярной формах. Неправильная обработка APP приводит к накоплению растворимого Aβ, который, согласно гипотезе Роуэна, нарушает LTP в гиппокампе и может привести к когнитивному снижению, наблюдаемому на ранней стадии AD.
AD может также нарушать LTP через механизмы, отличные от Aβ. Например, одно исследование продемонстрировало, что фермент PKMζ накапливается в нейрофибриллярных клубках, которые являются патологическим маркером БА. PKMζ - это фермент, имеющий решающее значение для поддержания позднего ДП.
Исследования в области медицины зависимости также недавно переключились на LTP из-за гипотезы о том, что наркомания представляет собой мощную форму обучения и памяти. Зависимость - это сложное нейроповеденческое явление, затрагивающее различные части мозга, такие как вентральная тегментальная область (VTA) и прилежащее ядро (NAc). Исследования показали, что синапсы VTA и NAc способны подвергаться ДП и что этот ДП может быть ответственным за поведение, характеризующее зависимость.