 Первая катализируемая кислотой Льюиса реакция Дильса – Альдера
Первая катализируемая кислотой Льюиса реакция Дильса – Альдера В кислотный катализ Льюиса органических реакций, основанная на металле кислота Льюиса действует как акцептор электронной пары для увеличения реакционной способности субстрата. Обычные кислотные катализаторы Льюиса основаны на металлах основной группы, таких как алюминий, бор, кремний и олово, а также на многих ранних (титан, цирконий ) и поздние (железо, медь, цинк ) металлы с d-блоком. Атом металла образует аддукт с неподеленной парой, несущей электроотрицательный атом в подложке, такой как кислород (как sp, так и sp), азот, сера и галогены. Комплексообразование имеет характер частичного переноса заряда и делает донор неподеленной пары более электроотрицательным, активируя субстрат в направлении нуклеофильной атаки, разрыва гетеролитической связи или циклоприсоединения с 1,3-диенами и 1,3-диполями.
Многие классические реакции, включающие образование связи углерод-углерод или углерод-гетероатом, могут катализироваться кислотами Льюиса. Примеры включают реакцию Фриделя-Крафтса, альдольную реакцию и различные перициклические процессы, которые протекают медленно при комнатной температуре, такие как реакция Дильса-Альдера и еновая реакция. Помимо ускорения реакций, кислотные катализаторы Льюиса во многих случаях способны придавать региоселективность и стереоселективность.
Ранние разработки реагентов на основе кислоты Льюиса были сосредоточены на легко доступных соединениях, таких как TiCl 4, BF3, SnCl 4 и AlCl 3. На протяжении многих лет универсальные катализаторы, содержащие лиганды, разработанные для конкретных применений, способствовали улучшению как реакционной способности, так и селективности реакций, катализируемых кислотой Льюиса. В последнее время кислотные катализаторы Льюиса с хиральными лигандами стали важным классом инструментов для асимметричного катализа.
Проблемы при разработке кислотного катализа Льюиса включают неэффективную смену катализатора (вызванную сродством катализатора к продукту) и частые требования двухточечного связывания для стереоселективности, что часто требует использования вспомогательных групп.
В реакциях с При полярных механизмах катализ кислотой Льюиса часто включает связывание катализатора с основными гетероатомами Льюиса и поглощение электронной плотности, что, в свою очередь, способствует разрыву гетеролитической связи (в случае реакции Фриделя-Крафтса ) или непосредственно активирует субстрат в направлении нуклеофильной атаки (в случае реакций присоединения карбонила ). Дихотомия может иметь важные последствия в некоторых реакциях, как в случае реакций замещения ацеталя, стимулированных кислотой Льюиса, где механизмы SN1 и SN2, показанные ниже, могут давать разные стереохимические результаты. Изучая соотношение продуктов в бициклической системе, Дания и его коллеги показали, что оба механизма могут работать в зависимости от дентичности кислоты Льюиса и идентичности группы R '.
 (слева) кислота Льюиса -промотируемое замещение ацеталем может происходить либо по механизму S N 1, либо по механизму S N 2. (Справа) Датская модельная система для механизма замещения ацеталя. Если для замещения ацеталя действует механизм S N 1, две показанные здесь реакции должны протекать через один и тот же оксокарбениевый ион и давать аналогичные стереохимические результаты. Результаты показывают, что механизм варьируется в зависимости от кислоты Льюиса и группы R.
(слева) кислота Льюиса -промотируемое замещение ацеталем может происходить либо по механизму S N 1, либо по механизму S N 2. (Справа) Датская модельная система для механизма замещения ацеталя. Если для замещения ацеталя действует механизм S N 1, две показанные здесь реакции должны протекать через один и тот же оксокарбениевый ион и давать аналогичные стереохимические результаты. Результаты показывают, что механизм варьируется в зависимости от кислоты Льюиса и группы R. В реакциях Дильса-Альдера и 1,3-диполярного циклоприсоединения кислоты Льюиса снижают НСМО энергия диенофила или диполярофила соответственно, что делает его более реактивным по отношению к диену или диполю.
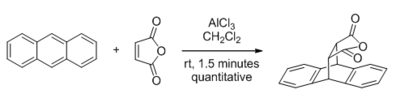
Среди типов реакций, которые могут катализироваться кислотами Льюиса, реакции с карбонил -содержащими субстраты получили наибольшее внимание. Первое крупное открытие в этой области было сделано в 1960 году, когда Йейтс и Итон сообщили о значительном ускорении реакции Дильса-Альдера за счет AlCl 3, когда малеиновый ангидрид является диенофил. Ранние теоретические исследования, которые зависели от анализа пограничной орбиты, установили, что кислотный катализ Льюиса действует за счет снижения энергии НСМО диенофила, что до сих пор является общепринятым рационализатором. Концепция пониженной энергии НСМО также используется для объяснения резко возросшей электрофильной реактивности карбонильных соединений (чья НСМО представляет собой CO π * -орбиталь) по отношению к мягким нуклеофильным реагентам, как в случаях альдольной реакции Мукаямы и Реакция Сакураи.
В дополнение к ускорению скорости реакции, катализируемые кислотой Льюиса, иногда проявляют повышенную стереоселективность, что стимулировало разработку моделей стереоиндукции. Эти модели основаны на знании структур кислотно-карбонильных комплексов Льюиса, которые на протяжении десятилетий исследований в области теоретических расчетов, ЯМР спектроскопии и рентгеновской кристаллографии, были довольно твердо установлены в начале 1990-х годов:
Альдольная реакция Мукаямы и Сакураи реакция относится к добавлению простых эфиров силиленола и аллилсиланов к карбонильным соединениям соответственно. Только при кислотном катализе Льюиса эти реакции протекают в синтетически полезных условиях. Считается, что ациклические переходные состояния действуют в обеих реакциях 1,2- или 1,4-присоединения, и стерические факторы контролируют стереоселективность. Это контрастирует с жестким циклическим переходным состоянием Циммермана-Тракслера, которое было широко принято для альдольной реакции с енолатами лития, бора и титана . Как следствие, геометрия двойной связи в эфире силил енола или аллилсилане плохо отражается на стереохимии продукта. Модель для 1,2-добавки Сакураи, предложенная Кумадой, представлена на схеме ниже; синдиастереомер является преобладающим при использовании (E) силана, а также незначительно предпочтительным при использовании (Z) силана. Подобный анализ Хиткока объясняет тот факт, что с простыми субстратами по существу отсутствует диастереоселективность межмолекулярной альдольной реакции Мукаямы.
 Открытая модель переходного состояния для реакции Сакураи
Открытая модель переходного состояния для реакции Сакураи Катализатор на основе кислоты Льюиса играет роль в стереоселективности, когда альдегид может хелатировать на металлическом центре и образовывать жесткий циклический промежуточный продукт. Таким образом, стереохимический результат согласуется с приближением нуклеофильного анти-антитела к более объемному заместителю в кольце.

кислоты Льюиса, такие как ZnCl 2, BF 3, SnCl 4, AlCl 3 и MeAlCl 2 могут катализировать как нормальную, так и обратную потребность в электронах Реакции Дильса-Альдера. Увеличение скорости часто бывает значительным, и региоселективность в отношении орто- или пара-подобных продуктов часто улучшается, как показано в реакции между изопреном и метилакрилатом.
 . Геометрия переходного состояния по Дильсу. - Реакция старшего поколения в термических (слева) и катализированных BF 3 условиях (справа). Длины образующихся связей (в ангстремах) показаны, что указывает на более асинхронное переходное состояние для катализируемой реакции.
. Геометрия переходного состояния по Дильсу. - Реакция старшего поколения в термических (слева) и катализированных BF 3 условиях (справа). Длины образующихся связей (в ангстремах) показаны, что указывает на более асинхронное переходное состояние для катализируемой реакции. 
Катализированная реакция Дильса-Альдера считается согласованной. Вычислительное исследование на уровне B3LYP / 6-31G (d) показало, однако, что переходное состояние катализируемой BF 3 реакции Дильса-Альдера между пропеналом и 1, 3-бутадиен более асинхронен, чем термическая реакция - связь дальше от карбонильной группы образуется перед другой связью.
карбониленовая реакция почти всегда катализируется кислотами Льюиса в синтетических приложениях. На основании исследований кинетического изотопного эффекта был предложен ступенчатый или в значительной степени асинхронный механизм для каталитической реакции. Тем не менее, циклические переходные состояния часто используются для интерпретации диастереоселективности. В основополагающем обзоре в начале 1990-х Миками и его коллеги предложили позднее, подобное стулу переходное состояние, которое могло бы рационализировать многие наблюдаемые стереохимические результаты, включая роль стерической массы в диастереоселективности:

Однако совсем недавно та же группа провели расчеты HF / 6-31G * для олова или алюминия, катализируемых кислотой Льюиса еновых реакций. Ссылаясь на то, что метилглоксилат хелатирует кислоты Льюиса олова, но не алюминий, они вызвали раннее, похожее на конверт переходное состояние и рационализировали расходящийся стереохимический исход еновой реакции между (E) -2-бутеном и метилглиоксилатом..

Катализируемые кислотой Льюиса реакции карбонильного присоединения обычно используются для образования углерод-углеродных связей в синтезе природного продукта. Первые две реакции, показанные ниже, являются результатом синтеза (+) - ликофлексина и зарагозовой кислоты C, соответственно, которые являются прямым применением реакций Сакураи и Мукаямы. Третья реакция, на пути к (+) - фавцеттимину, представляет собой раскрытие циклопропана, катализируемое кислотой Льюиса, которое аналогично реакции Мукаяма- Майкла.

Реакция Дильса-Альдера, катализируемая или промотируемая кислотами Льюиса, является мощным и широко используемый способ синтеза натурального продукта для достижения сложности каркаса за одну стадию со стереохимическим контролем. Две показанные ниже реакции представляют собой внутримолекулярную реакцию Дильса-Альдера по отношению к (-) - фузаризетину А и межмолекулярную гетеро-реакцию Дильса-Альдера по отношению к (-) - эпибатидину, соответственно.

В Фриделе-Крафтсе алкилирование кислота Льюиса - обычно простая соль галогенида металла - способствует гетеролитическому разрыву связи углерод-галоген в алкиле. галогенид и образует карбокатион, который подвергается электрофильному ароматическому замещению. Хотя эта реакция очень полезна в синтезе, она часто страдает от побочных реакций, которые возникают в результате перегруппировки карбокатиона, миграции алкила и чрезмерного алкилирования. Аналогично, при ацилировании Friedel-Crafts кислота Льюиса способствует образованию иона ацилия из хлорангидрида (или иногда ангидрида кислоты). Хотя часто предполагается, что ион ацилия является активным промежуточным продуктом, есть свидетельства того, что протонированный дикатион ацилия является активным электрофилом, который подвергается последующему электрофильному ароматическому замещению.
Важные варианты реакции Фриделя-Крафтса включают хлорметилирование (с формальдегид и HCl), формилирование (с HCl и CO или CN) и ацилирование с нитрилом в качестве источника ацила. Ацилирование на основе нитрила особенно полезно, поскольку оно позволяет осуществлять прямое орто-ацилирование анилина без защиты аминогруппы. Комбинация слабой и сильной кислоты Льюиса необходима для протекания реакции по механизму, показанному ниже. Руководствуясь этим механизмом и зная, что тригалогениды галлия являются одними из самых сильных кислот Льюиса, химики-технологи Merck смогли разработать высокоэффективные условия для этого состояния в отношении кандидата в лекарство.

Асимметричный катализ кислотами Льюиса основывается на катализаторах с хиральными лигандами, координированными с металлическим центром. За прошедшие годы небольшое количество хиральных лигандных каркасов было выделено как обладающее «привилегированными» каталитическими свойствами, подходящими для широкого круга приложений, часто не связанных с механизмами. Текущие исследования в области асимметричного кислотного катализа Льюиса в основном используют или модифицируют эти лиганды, а не создают новые каркасы de novo. «Привилегированные» каркасы имеют несколько общих черт, в том числе химическую стабильность и относительную простоту обработки. Большинство каркасов многозубые. Большинство из них также обладают высокой жесткостью каркаса внутри лиганда. Некоторые из них имеют в наличии довольно зрелые модели стереоиндукции. Некоторые «привилегированные» строительные леса, определенные Якобсеном и Чжоу, представлены ниже.
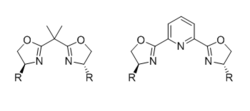 Общая структура лигандов BOX (слева) и PyBOX (справа).
Общая структура лигандов BOX (слева) и PyBOX (справа). Наиболее распространенные хиральные лиганды бисоксазолина (BOX) состоят из двух идентичных хиральных оксазолинов фрагменты, замещенные объемной группой в положениях 4, соединенные линкером. Лиганд является бидентатным, когда линкер представляет собой одно углеродное звено, но является тридентатным (обычно меридиальным), когда линкер несет дополнительный координирующий атом, такой как азот пиридина в случае Лиганды PyBOX. Влияние дентичности лиганда и геометрии активного промежуточного соединения на стереохимический результат было тщательно изучено.
Многие реакции, катализируемые кислотой Льюиса на основе бидентатного BOX, основаны на катализаторах меди (II) с субстратами. которые подходят для двухточечного связывания. Стереохимический результат согласуется со скрученным квадратным плоским промежуточным продуктом, который был предложен на основе родственных кристаллических структур. Заместитель в 4-м положении оксазолина блокирует одну энантиотопическую сторону субстрата, что приводит к энантиоселективности. Это продемонстрировано в следующей реакции типа альдола, но применимо к широкому спектру реакций, таких как реакции типа Манниха, еновая реакция, Добавление Майкла, циклизация Назарова и гетеро- реакция Дильса-Альдера.

С другой стороны, двухточечное связывание на кислоте Льюиса, несущей меридиально тридентатный лиганд PyBOX, приведет к в квадратно-пирамидальном комплексе. Исследование с использованием (бензилокси) ацетальдегида в качестве электрофила показало, что стереохимический результат согласуется с экваториальным связыванием карбонильного кислорода и аксиальным связыванием эфирного кислорода.

Разработано Noyori, BINAP (2,2'-дифенилфосфино-1,1'-бинафтил) представляет собой семейство хиральных дифосфиновых лигандов, содержащих два триарилфосфиновых фрагмента, установленных на бинафталиновом скелете. BINAP хелатирует с металлом (обычно с поздним переходным металлом) с образованием C 2 -симметричного комплекса. Как показано ниже в структуре комплекса (R) -BINAP рутений, среди четырех оставшихся координационных центров на октаэдрическом металлическом центре два экваториальных сайта (пурпурный) находятся под сильным влиянием экваториальными фенильными группами, в то время как два аксиальных участка (зеленые) находятся под влиянием аксиальных фенильных групп.
 Слева: структура (R) -BINAP. Справа: структура рутениевого комплекса (R) -BINAP, выделены экваториальные (фиолетовый) и аксиальный (зеленый) координационные центры, а также экваториальные и аксиальные фенильные группы, которые обеспечивают асимметричную среду для входящих лигандов.
Слева: структура (R) -BINAP. Справа: структура рутениевого комплекса (R) -BINAP, выделены экваториальные (фиолетовый) и аксиальный (зеленый) координационные центры, а также экваториальные и аксиальные фенильные группы, которые обеспечивают асимметричную среду для входящих лигандов. На основе структуры, были предложены модели наблюдаемой энантиоселективности во многих реакциях, катализируемых кислотой Льюиса на основе BINAP. Например, в энантиоселективной реакции Дильса-Альдера, катализируемой палладием, показанной ниже, считается, что диенофил координирует центр металла в экваториальных центрах. Таким образом, экваториальная фенильная группа на фосфоре блокирует Si-поверхность, что приводит к превосходной энантиоселективности. Очень похожая модель была использована для обоснования результатов реакции асимметричного енолятного алкилирования, катализируемой никелем, где субстрат также несет вспомогательный компонент, который позволяет ему хелатировать на металле. С другой стороны, реакция гетеро-ена, катализируемая медью (I), как полагают, протекает через тетраэдрический промежуточный продукт, предлагая альтернативный режим стереоиндукции путем изменения металлического центра.
BINOL (1,1'-бинафтил-2,2'-диол) обычно используется в сочетании с оксофильным диолом Льюиса. кислые металлы, такие как алюминий, титан, цирконий и различные редкоземельные металлы. В случаях, когда сам BINOL не обеспечивает идеального энантиоселективного контроля, его можно легко разработать путем замены в положениях 3,3 '(через литиирование ) и в положениях 6,6' (через положения 6,6'- дибромидное соединение, полученное электрофильным ароматическим замещением ) для модуляции стерических объемных и электронных свойств. Например, алюминиевые катализаторы на основе объемного 3,3'-дисилилзамещенного BINOL были разработаны как ранние примеры каталитических асимметричных гетеро- реакции Дильса-Альдера и перегруппировки Клайзена, в то время как введение электроноакцепторные группы в 6,6'-положениях имеют решающее значение для повышения кислотности Льюиса и, следовательно, каталитической активности циркониевых (IV) катализаторов по отношению к реакции типа Манниха. На сегодняшний день, однако, общепринятой модели для определения решающих факторов, управляющих BINOL-направленной стереоиндукцией, не существует.
 Слева: (R) -BINOL. В центре: алюминиевый катализатор на основе объемного 3,3'-дисилилзамещенного БИНОЛА. Справа: циркониевый катализатор на основе BINOL, замещенного в положениях 6 и 6 'электроноакцепторной трифторметильной группой.
Слева: (R) -BINOL. В центре: алюминиевый катализатор на основе объемного 3,3'-дисилилзамещенного БИНОЛА. Справа: циркониевый катализатор на основе BINOL, замещенного в положениях 6 и 6 'электроноакцепторной трифторметильной группой. TADDOL означает тетраарил-1,3-диоксолан-4,5-диметанол. Широкое применение катализаторов ТАДДОЛата титана для карбонильных присоединений и циклоприсоединений было представлено Зеебахом и его коллегами и было подробно описано в основополагающем обзоре, в котором была представлена рабочая модель стереоиндукции, которая согласуется с наблюдаемой селективностью в широком спектре реакций. в-четвертых, несмотря на отсутствие четкой картины механизма.

Катализ на основе кислоты Льюиса использовался на стадии установления асимметрии для синтеза многих натуральных продуктов. В первой реакции, показанной ниже, из синтеза скелета таксана используется катализатор на основе меди, нанесенный на хиральный фосфорамидит лиганд для реакции сопряженного карбонильного присоединения. Во второй реакции синтеза энт- гиперфорина используется катализатор железо-PyBOX для асимметричной реакции Дильса-Альдера.
