| Leishmania | |
|---|---|
 | |
| L. donovani в клетке костного мозга | |
| Научная классификация | |
| Домен: | Eukaryota |
| Тип: | Euglenozoa |
| Класс: | Kinetoplastea |
| Порядок: | Trypanosomatida |
| Род : | Leishmania. Боровский 1898 (Росс 1903) |
| Виды | |
L. aethiopica. L. amazonensis.. (виды звезд). (статус оспаривается). L. (Viannia) braziliensis. L. chagasi (син. L. infantum). L. donovani.. (статус оспариваемый). (статус оспариваемый)... L. Infantum. (статус оспаривается).. L. майор... Л. mexicana.... (статус оспаривается)... L. tropica... | |
Leishmania - это род из трипаносом, ответственных за болезнь лейшманиоз. Они распространены москитами рода Phlebotomus в Старом Свете и рода Lutzomyia в Новом Свете.. По крайней мере 93 вида москитов являются подтвержденными или вероятными переносчиками во всем мире. Их основные хозяева - позвоночные ; Leishmania обычно поражает даманов, псовых, грызунов и людей.
Первое письменное упоминание заметных симптомов кожного лейшманиоза появилось в Палеотропах в пределах восточные тексты, относящиеся к VII веку до нашей эры (предположительно переписанные из источников на несколько сотен лет старше, между 1500 и 2000 годами до нашей эры). Из-за того, что лейшманиоз широко и устойчиво распространялся на протяжении всей древности как загадочная болезнь с различными симптомами, лейшманиоз получил разные названия от «белой проказы» до «черной лихорадки ». Некоторые из этих названий предполагают связь с негативными культурными верованиями или мифологией, которые все еще усиливают социальную стигматизацию лейшманиоза сегодня.
Представители древнего рода паразита Leishmania, палеолейшмании., были обнаружены у ископаемых москитов, относящихся к раннему меловому периоду, однако возбудитель болезни был обнаружен только в 1901 году. как одновременное открытие Уильяма Буг Лейшмана и Чарльза Донована. Они независимо друг от друга визуализировали микроскопических одноклеточных паразитов (позже названных тельцами Лейшмана-Донована), живущих в клетках инфицированных органов человека. Позже паразитический род будет классифицирован как трипаносоматид простейшие под филогенетическим обозначением, Leishmania donovani. С тех пор несколько видов были классифицированы и сгруппированы в два основных подрода, а именно Leishmania Viannia (обычно расположенные в Neotropics ) или Leishmania Leishmania (обычно расположенные в Paleotropics, за главным исключением L. mexicana подгруппа).
В настоящее время лейшмания поражает 6 миллионов человек в 98 странах. Ежегодно возникает около 0,9–1,6 миллиона новых случаев, и известно, что 21 вид вызывает заболевания у людей.
Виды Leishmania - это одноклеточные эукариоты, имеющие четко выраженное ядро и другие клеточные органеллы, включая кинетопласты и жгутик. В зависимости от стадии их жизненного цикла они существуют в двух структурных вариантах:
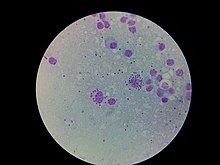 L. Формы амастигот infantum
L. Формы амастигот infantum Детали эволюции этого рода обсуждаются, но Leishmania, очевидно, произошла от предковой линии трипаносом. Самая старая ветвь - это линия, за которой следует Trypanosoma brucei, последняя приурочена к африканскому континенту. Группы Trypanosoma cruzi с трипаносомами летучих мышей, южноамериканских млекопитающих и кенгуру предполагают происхождение из Южного полушария. Эти клады имеют лишь отдаленное родство.
Остальные клады в этом дереве: Blastocrithidia и Phytomonas. Четыре рода Leptomonas, Crithidia, Leishmania и образуют концевые ветви, что указывает на относительно недавнее происхождение. Некоторые из этих родов могут быть полифилетическими и могут нуждаться в дальнейшем разделении.
Происхождение самого рода Leishmania неясно. Одна теория предполагает африканское происхождение с миграцией в Америку. Другой предлагает миграцию из Америки в Старый Свет через сухопутный мост Берингов пролив около 15 миллионов лет назад. Третья теория предполагает палеарктическое происхождение. Такие миграции повлекут за собой последующую миграцию переносчиков и резервуаров или последовательные адаптации на этом пути. Более поздняя миграция - это миграция L. infantum из стран Средиземноморья в Латинскую Америку (известная как L. chagasi) после европейской колонизации Нового Света, где паразиты перенесли свои текущие векторы Нового Света в их соответствующих экосистемах. Это очевидная причина эпидемий. Одна из недавних эпидемий в Новом Свете касается песцов в США.
Хотя было высказано предположение, что лейшмания могла развиться в неотропах. это, вероятно, верно для видов, относящихся к подродам Viannia и Endotrypanum. Однако есть свидетельства того, что первичной эволюцией подродов Leishmania и Sauroleishmania является Старый Свет. В то время как виды Mundinia кажутся более универсальными в своей эволюции. Одна из теорий состоит в том, что разные линии были изолированы географически в разные периоды, и именно это привело к возникновению этого эволюционного мозаицизма. Но несомненно, что Leishmaniinae - монофилетическая группа.
Анализ большого набора данных предполагает, что лейшмания возникла от 90 до 100 миллионов лет назад в Гондване. Виды, заражающие рептилий, произошли от кладов млекопитающих.
Виды Sauroleishmania первоначально были определены на основании того, что они инфицировали рептилий (ящериц ), а не млекопитающих. На основании молекулярных данных они были переведены в статус подрода в пределах Leishmania. Этот подрод, вероятно, произошел от группы, которая первоначально инфицировала млекопитающих.
В этом роде распознается 53 вида. Статус некоторых из них оспаривается, поэтому окончательное число может отличаться. По крайней мере 20 видов заражают людей. Чтобы усложнить ситуацию, могут быть задействованы гибриды, как было зарегистрировано в Бразилии с гибридом между Leishmania (V.) guyanensis и Leishmania (V.) shawi shawi.
род в настоящее время делится на 4 подрода: Leishmania, Sauroleishmania, Mundinia и Viannia. Разделение на два подрода (Leishmania и Viannia) было сделано Лейнсоном и Шоу в 1987 году на основании их местонахождения в кишечнике насекомых. Виды подрода Viannia развиваются в заднем кишечнике: L. (V.) braziliensis был предложен в качестве типового вида для этого подрода. Это разделение подтверждено всеми последующими исследованиями. Шоу, Камарго и Тейшейра создали подрод Mundinia при пересмотре Leishmaniinae в 2016 году.
Endotrypanum тесно связан с Leishmania. Некоторые виды Endotypanum уникальны тем, что заражают эритроциты своих хозяев (ленивцев). Все виды обитают в Центральной и Южной Америке. У человека обнаружены инфекции E. colombiensis.
Зауролейшмания первоначально была описана Ранкейном в 1973 году как отдельный род, но молекулярные исследования показывают, что это фактически подрод, а не отдельный род.
Предложенное в 2000 г. разделение Leishmania на группы и группы подчеркивало глубокую филогенную дистанцию между паразитами, некоторые из которых были названы видами Leishmania. Euleishmania включает виды, в настоящее время относящиеся к подродам Leishmania, Sauroleishmania, Mundinia и Viannia. Предлагаемый Paraleishmania включал виды Endotypanum, Leishmamnia-L. colomubensis, L. herreri, L. hertigi, L. deanei и L. equatorensis. В недавнем пересмотре этим видам был присвоен другой родовой статус.
В настоящее время различают четыре подрода Leishmania - Leishmania, Sauroleishmania, Viannia и Mundinia (комплекс L. enriettii). Род Endotrypanum и Porcisia относятся к Paraleishmania.
Существует четыре вида Mundinia: L. (Mundinia) enriettii, L. (Mundinia) martiniquensis, L. (Mundinia) macropodum и L. (Mundinia) orientalis, обитающий в Таиланде.
Л. Специфический статус арчибальди не определен, но он тесно связан с L. donovani.
Л. herreri принадлежит скорее к роду Endotypanum, чем к Leishmania.
Л. donovani и L. infantum тесно связаны.
Селенофермент Селтрип является уникальным для этого заказа. Он был исключен из подрода Viannia.
Л. deanei и L. hertigi, оба заражающие дикобразов, были перемещены в род Porcisia.
Подрод Leishmania Ross, 1903 sensu Saf'janova, 1982
Подрод Mundinia Shaw, Camargo and Teixeira 2016
Подрод Sauroleishmania Ranque, 1973 sensu Сафьянова, 1982
↑ Виды, описанные как Sauroleishmania. Их развитие не похоже на развитие других представителей подрода, поэтому их таксономическое положение сомнительно.
Подрод Вианния Lainson Shaw 1987
Отношения между этими родами и Leishmania в настоящее время неясны, но они тесно связаны.
Род Endotrypanum
Род Новимонас Костыгов и Юрченко 2016
Род Порцизия Шоу, Камарго и Тейшейра, 2016
Род Zelonia Shaw, Camargo and Teixeira 2016
Биохимия По своему химическому составу и клеточной биологии Leishmania аналогична таковой других кинетопластид. Они имеют одинаковые основные морфологические признаки, в том числе один жгутик, который имеет инвагинацию, жгутиковый карман, в основании, кинетопласт, который находится в единственной митохондрии., и субпеликулярный массив микротрубочек, которые составляют основную часть цитоскелета.
Leishmania имеют липофосфогликан покрытие на внешней стороне ячейка. Липофосфогликан является триггером для толл-подобного рецептора 2, сигнального рецептора, участвующего в запуске врожденного иммунного ответа у млекопитающих.
Точная структура липофосфогликана варьируется в зависимости от вида и стадии жизненного цикла паразита. Гликановый компонент особенно вариабелен, и различные варианты липофосфогликана могут использоваться в качестве молекулярного маркера для различных стадий жизненного цикла. Лектины, группа растительных белков, которые связывают различные гликаны, часто используются для обнаружения этих вариантов липофосфогликанов. Например, агглютинин арахиса связывает конкретный липофосфогликан, обнаруженный на поверхности инфекционной формы L. major.
Липофосфогликан используется паразитом для обеспечения его выживания в организме хозяина, и механизмы, с помощью которых паразит делает это, сосредоточены на модуляции иммунного ответа хозяина. Это жизненно важно, поскольку паразиты Leishmania живут в макрофагах и должны предотвратить их убийство макрофагами. Липофосфогликан играет роль в сопротивлении системе комплемента, ингибировании реакции окислительного всплеска, индукции воспалительной реакции и предотвращении естественных Т-киллеров признание того, что макрофаг инфицирован паразитом Leishmania.
| Тип | Патоген | Местоположение |
|---|---|---|
| Кожный лейшманиоз (локализованные и диффузные) инфекции проявляются в виде явных кожных реакций. | Наиболее распространенным является восточная язва (вызывается видами Старого Света L. major, L. tropica и L. aethiopica ). В Новом Свете наиболее частыми виновниками являются L. mexicana. | Кожные инфекции наиболее распространены в Афганистане, Бразилии, Иране, Перу, Саудовской Аравии и Сирия. |
| Слизисто-кожный лейшманиоз инфекции начинаются как реакция на укус и могут переходить метастаз в слизистую оболочку и приводить к летальному исходу. | Л. braziliensis | Кожно-слизистые инфекции наиболее распространены в Боливии, Бразилии и Перу. Кожно-слизистые инфекции также обнаружены в Карамае, Синьцзян-Уйгурский автономный район Китая. |
| Висцеральный лейшманиоз инфекции часто распознаются по лихорадке, отеку печени и селезенки и анемии. Они известны под многими местными названиями, наиболее распространенным из которых, вероятно, является кала азар, | Вызывается исключительно видами комплекса L. donovani (L. donovani, L. infantum син. L. chagasi). | Встречается в тропических и субтропических областях всех континентов, кроме Австралии, висцеральные инфекции наиболее распространены в Бангладеш, Бразилия, Индия, Непал и Судан. Висцеральный лейшманиоз также встречается в некоторых частях Китая, таких как провинция Сычуань, провинция Ганьсу и Синьцзян-Уйгурский автономный район. |
Чтобы избежать разрушения иммунной системой и процветания, лейшмания «прячется» внутри клеток своего хозяина. Такое расположение позволяет ему избежать действия гуморального иммунного ответа (поскольку возбудитель безопасно находится внутри клетки и вне открытого кровотока), и, кроме того, это может помешать иммунной системе уничтожить своего хозяина через безопасную поверхность. сигналы, препятствующие апоптозу. Основные типы клеток Leishmania инфильтраты - это фагоцитозные клетки, такие как нейтрофилы и макрофаги.
Обычно фагоцитозные иммунные клетки, такие как макрофаги, поглощают патоген в закрытом эндосома, а затем заполните эту эндосому ферментами, которые переваривают патоген. Однако в случае Leishmania эти ферменты не действуют, позволяя паразиту быстро размножаться. Этот беспрепятственный рост паразитов в конечном итоге подавляет макрофаги хозяина или другие иммунные клетки, вызывая их гибель.
Передается москитами, простейшими паразитами L. major может переключить стратегию первой иммунной защиты с приема пищи / воспаления / убийства на прием пищи / отсутствие воспаления / отсутствие уничтожения своего хозяина фагоцит и повредить его в своих интересах. Они строго используют охотно фагоцитирующие полиморфноядерные нейтрофильные гранулоциты (PMN) в качестве хитрого укрытия, где они размножаются, не распознаваемые иммунной системой, и проникают в долгоживущие макрофаги, чтобы создать «скрытое» инфекция.
 Жизненный цикл Leishmania
Жизненный цикл Leishmania После микробной инфекции PMN перемещаются из кровотока через эндотелиальный слой сосудов к участку инфицированной ткани ( кожная ткань после укуса мухи). Они немедленно инициируют первый иммунный ответ и фагоцитируют захватчика, распознавая чужеродные и активируя поверхности на паразите. Активированные PMN секретируют хемокины, IL-8, в частности, для привлечения дополнительных гранулоцитов и стимуляции фагоцитоза. Кроме того, L. major увеличивает секрецию IL-8 PMN. Этот механизм наблюдается и при заражении другими облигатными внутриклеточными паразитами. Для подобных микробов существует множество механизмов внутриклеточного выживания. Удивительно, но совместная инъекция апоптотических и жизнеспособных патогенов вызывает гораздо более скоротечное течение болезни, чем инъекции только жизнеспособных паразитов. Когда противовоспалительный сигнал фосфатидилсерин, обычно обнаруживаемый на апоптотических клетках, экспонируется на поверхности мертвых паразитов, L. major отключает окислительный взрыв, тем самым предотвращая гибель и деградацию паразитов. жизнеспособный патоген.
В случае Leishmania потомство не образуется в PMNs, но таким образом они могут выжить и сохраняться не запутанными в первичном очаге инфекции. Формы промастиготов также выделяют хемотаксический фактор Leishmania (LCF) для активного рекрутирования нейтрофилов, но не других лейкоцитов, например, моноцитов или NK-клеток. В дополнение к этому, продукция PMNs блокируется выработкой интерферона гамма (IFNγ) -индуцируемого белка 10 (IP10) при лейшмании, что влечет за собой отключение воспалительного и защитного иммунного ответа NK и Набор клеток Th1. Патогены остаются жизнеспособными во время фагоцитоза, поскольку их первичные хозяева, PMN, демонстрируют апоптотический клеточный молекулярный паттерн (ACAMP), сигнализирующий «нет патогена».
Продолжительность жизни нейтрофильных гранулоцитов довольно коротка. Они циркулируют в кровотоке в течение примерно 6-10 часов после выхода из костного мозга, после чего они подвергаются спонтанному апоптозу. Сообщалось, что микробные патогены влияют на апоптоз клеток различными способами. Очевидно, что из-за ингибирования активации каспазы 3 L. major может вызывать задержку апоптоза нейтрофилов и увеличивать их продолжительность жизни по крайней мере на 2–3 дня. Факт увеличения продолжительности жизни очень благоприятен для развития инфекции, поскольку конечными клетками-хозяевами для этих паразитов являются макрофаги, которые обычно мигрируют в места заражения в течение двух или трех дней. Возбудители не дрянные; вместо этого они берут на себя управление первичным очагом заражения. Они индуцируют выработку PMN хемокинов MIP-1α и MIP-1β (воспалительный белок макрофагов ) для рекрутирования макрофагов.
Чтобы сохранить целостность окружающей ткани от токсичных клеточных компонентов и протеолитических ферментов, содержащихся в нейтрофилах, апоптозные PMN молча выводятся макрофагами. Умирающие PMN обнажают сигнал «съешь меня» фосфатидилсерин, который передается на внешний листок плазматической мембраны во время апоптоза. Из-за отсроченного апоптоза паразиты, которые сохраняются в PMN, поглощаются макрофагами, используя абсолютно физиологический и нефлогистический процесс. Стратегия этого «безмолвного фагоцитоза» имеет следующие преимущества для паразита:
Однако исследования показали, что это маловероятно, поскольку видно, что патогены покидают апоптопные клетки, и нет никаких доказательств поглощения макрофагами этим методом.
Важным аспектом простейших Leishmania является его гликоконъюгированный слой липофосфогликана (LPG). Он удерживается вместе с якорем фосфоинозитидной мембраны и имеет трехчастную структуру, состоящую из липидного домена, нейтрального гексасахарида и фосфорилированной галактозо-маннозы с концевой нейтралью. У этих паразитов не только развивается постфлеботомусное пищеварение, но и считается, что они необходимы для окислительных всплесков, что позволяет проникать инфекции. Характеристики внутриклеточного переваривания включают слияние эндосомы с лизосомой с высвобождением кислых гидролаз, которые разрушают ДНК, РНК, белки и углеводы.
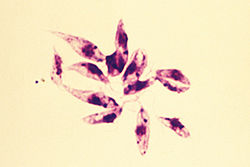 Leishmania tropica
Leishmania tropica Были секвенированы геномы четырех видов Leishmania (L. major, L. infantum, L. donovani и L. braziliensis), выявлено более 8300 кодирующий белок и 900 РНК генов. Почти 40% генов, кодирующих белок, относятся к 662 семействам, содержащим от двух до 500 членов. Большинство меньших семейств генов представляют собой тандемные массивы от одного до трех генов, в то время как более крупные семейства генов часто рассредоточены в тандемных массивах в различных локусах по всему геному. Каждая из 35 или 36 хромосом организована в небольшое количество кластеров генов от десятков до сотен генов на одной и той же цепи ДНК. Эти кластеры могут быть организованы по принципу «голова к голове» (расходящийся) или «хвост к хвосту» (конвергентный), причем последние часто разделяются тРНК, рРНК и / или мяРНК генов. Транскрипция генов, кодирующих белок, инициируется двунаправленно в дивергентных областях переключения цепей между кластерами генов и распространяется поли цистронно через каждый кластер генов перед тем, как завершиться в области переключения цепей, разделяющей конвергентные кластеры. Leishmania теломеры обычно относительно небольшие, состоящие из нескольких различных типов повторяющихся последовательностей. Можно найти доказательства рекомбинации между несколькими различными группами теломер. Геномы L. major и L. infantum содержат только около 50 копий неактивных вырожденных Ingi / L1Tc-связанных элементов (DIREs), тогда как L. braziliensis также содержит несколько связанных с теломерами мобильных элементов и сплайсированных связанных с лидером ретроэлементов. Геномы Leishmania имеют общий консервативный коровой протеом из примерно 6200 генов с родственными трипаносоматидами Trypanosoma brucei и Trypanosoma cruzi, но известно около 1000 генов, специфичных для Leishmania, которые в основном случайным образом распределены по геному. Относительно немного (около 200) видоспецифических различий в содержании генов существует между тремя секвенированными геномами Leishmania, но около 8% генов, по-видимому, эволюционируют с разной скоростью между тремя видами, что свидетельствует о различных давлениях отбора, которые могут быть связаны с патология болезни. Около 65% генов, кодирующих белок, в настоящее время не имеют функционального назначения.
Виды Leishmania продуцируют несколько различных белков теплового шока. К ним относятся Hsp83, гомолог Hsp90. Регуляторный элемент в 3 'UTR Hsp83 контролирует трансляцию Hsp83 чувствительным к температуре образом. Эта область образует стабильную структуру РНК, которая плавится при более высоких температурах.
Репродуктивная система микробного патогена является одним из основных биологических процессов, определяющих экологию микроорганизма и распространение болезни. В 2009 г. Акопянц и др. продемонстрировали, что L. major имеет половой цикл, включая мейотический процесс. Формируются гибридные потомки, которые имеют полный геномный набор от обоих родителей. Спаривание происходит только в векторе песчаная муха, и гибриды могут передаваться млекопитающему-хозяину при укусе песчаной мухи. У L. braziliensis спаривания в природе преимущественно происходят между родственными особями, что приводит к крайнему инбридингу. Скорость ауткроссинга между различными штаммами Leishmania в переносчике песчаных мух зависит от частоты коинфекции. Такие случаи скрещивания редки у L. major и L. donovani.
L. Infantum продуцирует белки BRCA1 и RAD51, которые взаимодействуют друг с другом, способствуя гомологичной рекомбинационной репарации. Эти белки играют ключевую роль в мейозе. Таким образом, мейотические события обеспечивают адаптивное преимущество эффективной рекомбинационной репарации повреждений ДНК, даже если они не приводят к ауткроссингу.
| На Викискладе есть медиафайлы, связанные с Leishmania. |
.