Свинец является химическим веществом элемент с символом Pb(от латинского plumbum) и атомным номером 82. Это тяжелый металл, который плотнее, чем большинство обычных материалов. Свинец мягкий и ковкий, а также имеет относительно низкую точку плавления. В свежем виде свинец серебристый с оттенком синего; он тускнеет до тускло-серого цвета при контакте с воздухом. Свинец имеет наивысший атомный номер из всех стабильных элементов, и три его изотопа являются конечными точками основных ядерных цепочек распада более тяжелых элементов.
Свинец - это относительно инертный металл после перехода. Его слабый металлический характер иллюстрируется его амфотерным характером; свинец и оксиды свинца реагируют с кислотами и основаниями и имеют тенденцию к образованию ковалентных связей. Соединения свинца обычно находятся в степени окисления +2 , а не в состоянии +4, обычном для более легких членов углеродной группы. Исключения в основном ограничиваются органическими соединениями. Подобно более легким членам группы, свинец имеет тенденцию связываться с самим собой ; он может образовывать цепочки и многогранные структуры.
Свинец легко извлекается из руды ; доисторические люди Западной Азии знали об этом. Галена - основная руда свинца, которая часто содержит серебро. Интерес к серебру помог повсеместно добывать и использовать свинец в Древнем Риме. Производство свинца снизилось после падения Рима и не достигало сопоставимых уровней до промышленной революции. В 2014 году годовое мировое производство свинца составило около десяти миллионов тонн, более половины из которых приходилось на переработку. Высокая плотность свинца, низкая температура плавления, пластичность и относительная инертность к окислению делают его полезным. Эти свойства в сочетании с его относительным обилием и низкой стоимостью привели к его широкому использованию в строительстве, сантехнике, батареях, пуль и выстрелах <141.>, веса, припои, оловянные, плавкие сплавы, белые краски, этилированный бензин и радиационная защита.
В конце 19 века была признана токсичность свинца, и с тех пор его использование во многих областях было прекращено. Однако во многих странах по-прежнему разрешена продажа продуктов, которые подвергают людей воздействию свинца, включая некоторые типы красок и пуль. Свинец - это нейротоксин, который накапливается в мягких тканях и костях; он повреждает нервную систему и нарушает функцию биологических ферментов, вызывая неврологические расстройства, такие как повреждение мозга и поведенческие проблемы.
Атом свинца имеет 82 электронов, расположенных в электронная конфигурация [Xe ] 4f5d6s6p. Сумма первой и второй энергий ионизации свинца - полная энергия, необходимая для удаления двух 6p-электронов - близка к таковой для олова, верхнего соседа свинца в углеродной группе .. Это необычно; энергии ионизации обычно падают вниз по группе, поскольку внешние электроны элемента становятся все более удаленными от ядра и более экранируются меньшими орбиталями. Сходство энергий ионизации вызвано сокращением лантаноидов - уменьшением радиусов элемента с лантана (атомный номер 57) до лютеция (71) и относительно небольшие радиусы элементов от гафния (72) и далее. Это происходит из-за плохой экранирования ядра 4f-электронами лантаноида. Сумма первых четырех энергий ионизации свинца превышает энергию олова, что противоречит предсказанию периодических тенденций. Релятивистские эффекты, которые проявляются в более тяжелых атомах, способствуют такому поведению. Одним из таких эффектов является эффект инертной пары : 6s-электроны свинца не хотят участвовать в связывании, что делает расстояние между ближайшими атомами в кристаллическом свинце необычно большим.
Более легкие углеродные группы конгенеров свинца образуют стабильные или метастабильные аллотропы с тетраэдрически координированной и ковалентно связанной кубической алмазной структурой. Уровни энергии их внешних s- и p-орбиталей достаточно близки, чтобы обеспечить смешивание в четыре гибридных sp-орбиталей. В свинце эффект инертной пары увеличивает расстояние между его s- и p-орбиталями, и разрыв не может быть преодолен за счет энергии, которая будет высвобождена дополнительными связями после гибридизации. Вместо кубической структуры алмаза свинец образует металлические связи, в которых только p-электроны делокализованы и разделяются между ионами Pb. Свинец, следовательно, имеет гранецентрированную кубическую структуру, как и двухвалентные металлы аналогичного размера металлы кальций и стронций.
Чистый Свинец имеет яркий серебристый вид с оттенком синего. При контакте с влажным воздухом он тускнеет и приобретает тусклый вид, оттенок которого зависит от преобладающих условий. Характерные свойства свинца включают высокую плотность, пластичность, пластичность и высокую устойчивость к коррозии из-за пассивации.
 Образец свинца, затвердевший из расплавленного состояния
Образец свинца, затвердевший из расплавленного состояния Плотноупакованная гранецентрированная кубическая структура свинца и высокий атомный вес приводят к плотности 11,34 г / см, что выше, чем у обычных металлов, таких как железо (7,87 г / см), медь (8,93 г / см) и цинк (7,14 г / см). Эта плотность является источником идиомы летать, как свинцовый шар. Некоторые более редкие металлы имеют более высокую плотность: вольфрам и золото имеют плотность 19,3 г / см, а осмий - самый плотный из известных металлов - имеет плотность 22,59 г / см. см, что почти вдвое больше, чем у свинца.
Свинец - очень мягкий металл с твердостью по Моосу 1,5; его можно поцарапать ногтем. Он довольно податлив и несколько пластичен. Модуль объемной упругости свинца - показатель легкости его сжимаемости - составляет 45,8 ГПа. Для сравнения, у алюминия 75,2 ГПа; медь 137,8 ГПа; и низкоуглеродистая сталь 160–169 ГПа. У свинца предел прочности на разрыв при 12–17 МПа низкий (у алюминия в 6 раз выше, у меди в 10 раз и у низкоуглеродистой стали в 15 раз); он может быть усилен добавлением небольшого количества меди или сурьмы.
. Температура плавления свинца при 327,5 ° C (621,5 ° F) очень низкая по сравнению с большинством металлов. Его температура кипения 1749 ° C (3180 ° F) является самой низкой среди элементов углеродной группы. удельное электрическое сопротивление свинца при 20 ° C составляет 192 наноом - метров, что почти на порядок выше, чем у других промышленных металлы (медь - 15,43 нОм · м; золото - 20,51 нОм · м; алюминий - 24,15 нОм · м). Свинец является сверхпроводником при температурах ниже 7,19 К ; это самая высокая критическая температура из всех сверхпроводников типа I и третья по величине из элементных сверхпроводников.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес Ar, стандартный (Pb) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Природный свинец состоит из четырех стабильных изотопов с массовыми числами 204, 206, 207 и 208, а также т расы пяти короткоживущих радиоизотопов. Большое количество изотопов согласуется с четным атомным номером свинца. Свинец имеет магическое число протонов (82), для которого модель ядерной оболочки точно предсказывает особенно стабильное ядро. Свинец-208 имеет 126 нейтронов, еще одно магическое число, которое может объяснить, почему свинец-208 необычайно стабилен.
Свинец с его высоким атомным номером является самым тяжелым элементом, природные изотопы которого считаются стабильными; Свинец-208 - самое тяжелое стабильное ядро. (Ранее это различие относилось к висмуту с атомным номером 83, пока в 2003 году не было обнаружено, что его единственный первичный изотоп, висмут-209, распадается очень медленно.) Четыре стабильных изотопы свинца теоретически могут подвергаться альфа-распаду до изотопов ртути с выделением энергии, но ни для одного из них этого не наблюдалось; их прогнозируемый период полураспада составляет от 10 до 10 лет (по крайней мере, в 10 раз больше нынешнего возраста Вселенной).
Три стабильных изотопа находятся в трех из четырех основных цепочек распада : свинец-206, свинец-207 и свинец-208 являются конечными продуктами распада урана-238, уран-235 и торий-232 соответственно. Эти цепочки распада называются урановой цепью, актиниевой цепью и ториевой цепью. Их изотопные концентрации в образце естественной породы сильно зависят от присутствия этих трех исходных изотопов урана и тория. Например, относительное содержание свинца-208 может колебаться от 52% в нормальных образцах до 90% в ториевых рудах; по этой причине стандартный атомный вес свинца дается только с точностью до одного десятичного знака. Со временем отношение свинца-206 и свинца-207 к свинцу-204 увеличивается, так как первые два дополняются радиоактивным распадом более тяжелых элементов, а второй - нет; это позволяет проводить датирование свинцом. По мере распада урана на свинец их относительные количества меняются; это основа для уран-свинцового датирования. Свинец-207 проявляет ядерный магнитный резонанс, свойство, которое использовалось для изучения его соединений в растворе и твердом состоянии, в том числе в человеческом теле.
 Метеорит Холсингера, самый большой кусок Каньон Диабло метеорит. Уран-свинцовое датирование и свинцово-свинцовое датирование этого метеорита позволило уточнить возраст Земли до 4,55 миллиарда ± 70 миллионов лет.
Метеорит Холсингера, самый большой кусок Каньон Диабло метеорит. Уран-свинцовое датирование и свинцово-свинцовое датирование этого метеорита позволило уточнить возраст Земли до 4,55 миллиарда ± 70 миллионов лет. Отдельно. из стабильных изотопов, которые составляют почти весь свинец, существующий в природе, есть следовые количества нескольких радиоактивных изотопов. Один из них - свинец-210; Хотя его период полураспада составляет всего 22,3 года, небольшие количества встречаются в природе, потому что свинец-210 образуется в результате длительного цикла распада, который начинается с урана-238 (который присутствует на Земле в течение миллиардов лет). Свинец-211, -212 и -214 присутствуют в цепочках распада урана-235, тория-232 и урана-238, соответственно, поэтому следы всех трех изотопов свинца обнаруживаются естественным образом. Незначительные следы свинца-209 возникают в результате очень редкого кластерного распада радия-223, одного из дочерних продуктов природного урана-235, и цепочки распада нептуния-237, следы которых образуются при захвате нейтронов в урановых рудах. Свинец-210 особенно полезен для определения возраста образцов путем измерения его отношения к свинцу-206 (оба изотопа присутствуют в одной цепочке распада).
Всего было синтезировано 43 изотопа свинца, с массовыми числами 178–220. Свинец-205 является наиболее стабильным радиоизотопом с периодом полураспада около 1,73 × 10 лет. Вторым по стабильности является свинец-202, период полураспада которого составляет около 52 500 лет, что больше, чем у любого из естественных радиоизотопов в следовых количествах.
 Испытание пламенем : цвета свинца пламя бледно-голубого
Испытание пламенем : цвета свинца пламя бледно-голубого Свинец в массе, подвергающийся воздействию влажного воздуха, образует защитный слой различного состава. Карбонат свинца (II) является обычным компонентом; сульфат или хлорид также может присутствовать в городских или морских условиях. Этот слой делает свинец в массе химически инертным на воздухе. Свинец в тонком порошке, как и многие металлы, пирофорен и горит голубовато-белым пламенем.
Фтор реагирует со свинцом при комнатной температуре с образованием фторида свинца (II). Реакция с хлором аналогична, но требует нагревания, поскольку образующийся хлоридный слой снижает реакционную способность элементов. Расплавленный свинец реагирует с халькогенами с образованием халькогенидов свинца (II).
Металлический свинец устойчив к серной и фосфорной кислоте, но не соляная или азотная кислота ; результат зависит от нерастворимости и последующей пассивации соли продукта. Органические кислоты, такие как уксусная кислота, растворяют свинец в присутствии кислорода. Концентрированные щелочи растворяют свинец и образуют плюмбиты.
Свинец демонстрирует два основных состоянияокисления: +4 и +2. Четырехвалентное состояние является общим для углеродной группы. Двухвалентное состояние редко встречается для углерода и кремния, незначительно для германия, важно (но не преобладает) для олова и является более важным из двух состояний окисления для свинца. Это связано с релятивистскими эффектами, в частности с эффектом инертной пары, который проявляется, когда существует большая разница в электроотрицательности между свинцом и оксидом, галогенид или нитрид анионы, приводящие к значительному частичному положительному заряду на свинце. Результатом является более сильное сокращение орбитали свинца 6s, чем в случае орбитали 6p, что делает его довольно инертным по отношению к ионным соединениям. Эффект инертной пары, используемые в соединении, которые соединяются друг с другом, образует ковалентные связи с элементами аналогичной электроотрицательности, такие как электрические соединения свинца. В них орбитали 6s и 6p остаются одинакового размера, и sp-гибридизация по-прежнему является энергетически выгодной. Свинец, как и пластик, в таких соединениях, как четырехвалентный.
Существует относительно большая разница в электроотрицательности свинца (II) при 1,87 и свинца (IV) при 2,33. Это различие знаменует собой изменение тенденции к увеличению степени окисления +4 по углеродной группе; олово, для сравнения, имеет значения 1,80 в степени окисления +2 и 1,96 в состоянии +4.
 Оксид свинца (II)
Оксид свинца (II) Соединения свинца (II) - характеристика неорганической химии свинца. Даже сильные окислители, такие как фтор и хлор, реагируют со свинцом с образованием только PbF 2 и PbCl 2. Ионы свинца (II) обычно бесцветны в растворе и частично гидролизуются с образованием Pb (OH) и, наконец, [Pb 4 (OH) ] (в котором гидроксил Ионы как мостиковые лиганды ), но не являются восстановителями, как ионы олова (II). Методы для определения присутствия иона Pb в воде обычно основываются на осаждении хлорида свинца (II) с использованием разбавленной соляной кислоты. Смазочно-охлаждающая жидкость в воде, растворенная в воде, растворенная в воде, растворенная в воде, растворенная в воде.
Моноксид свинца существует в двух полиморфы, бледность α-PbO (красный) и massicot β-PbO (желтый), причем последний стабилен только выше примерно 488 ° C. Глет - наиболее часто используемое неорганическое соединение свинца. Нет гидроксида свинца (II); повышение pH растворов солей свинца (II) приводит к гидролизу и конденсации. Свинец обычно реагирует с более тяжелыми халькогенами. Сульфид свинца представляет собой полупроводник, фотопроводник и чрезвычайно чувствительный детектор инфракрасного излучения. Два других халькогенида, селенид свинца и теллурид свинца, также являются светопроводящими. Они необычны тем, что их цвет становится светлее при движении вниз по группе.
 Свинец и кислород в тетрагональной элементарной ячейке из свинца (II, IV) оксид
Свинец и кислород в тетрагональной элементарной ячейке из свинца (II, IV) оксид Дигалогениды свинца хорошо изучены; это включает диастатид и смешанные галогениды, такие как PbFCl. Относительная нерастворимость составляет полезную основу для гравиметрического определения фтора. Дифторид был первым твердым ионопроводящим соединением, которое было обнаружено (в 1834 году Майклом Фарадеем ). Другие дигалогениды разлагаются под воздействием ультрафиолета или видимого света, особенно дииодид. Известны многие псевдогалогениды свинца (II), такие как и тиоцианат. Свинец (II) образует большое количество галогенидных координационных комплексов, таких как [PbCl 4 ], [PbCl 6 ] и [Pb 2Cl9]nцепной анион.
Сульфат свинца (II) нерастворим в воде, как и сульфаты других тяжелых двухвалентных катионов . Нитрат свинца (II) и ацетат свинца (II) хорошо растворимы, и это используется в синтезе других соединений свинца.
Немного неорганические соединения свинца (IV) известны. Они образуются только в окисляющих растворах и обычно не используются в стандартных условиях. Оксид свинца (II) при дальнейшем окислении дает смешанный оксид Pb 3O4. Он описывается как оксид свинца (II, IV) или структурно 2PbO · PbO 2 и наиболее известным соединением свинца со смешанной валентностью. Диоксид свинца является сильным окислителем, способным окислять соляную кислоту до газообразного хлора. Это связано с тем, что ожидаемый PbCl 4, который мог бы образоваться, нестабилен и спонтанно разлагается на PbCl 2 и Cl 2. Аналогично оксиду свинца диоксид свинца способен образовывать анионы свинца. Дисульфид свинца и диселенид свинца стабильны только при высоких давлениях. Тетрафторид свинца, желтый кристаллический порошок, является стабильным, но менее стабильным, чем дифторид. Тетрахлорид свинца (желтое масло) разлагается при комнатной температуре, тетрабромид свинца еще менее стабилен, и существование тетраиодида свинца вызывает сомнения.
 Квадратный антипризматический анион с заглушкой [Pb 9 ] из [K (18-crow-6)] 2K2Pb9· (ru) 1,5
Квадратный антипризматический анион с заглушкой [Pb 9 ] из [K (18-crow-6)] 2K2Pb9· (ru) 1,5 Некоторые соединения свинца существуют в формальных степенях окисления кроме +4 или +2. Свинец (III) может быть получен в качестве промежуточного звена между свинцом (II) и свинцом (IV) в более крупных целях комплексах свинца; эта степень окисления нестабильна, поскольку и ион свинца (III), и более крупные комплексы, являются его, являются радикалами. То же самое относится к свинцу (I), который может быть обнаружен в таких радикалах.
Известно множество смешанных оксидов свинца (II, IV). Когда PbO 2 нагревается на воздухе, он становится Pb 12O19при 293 ° C, Pb 12O17при 351 ° C, Pb 3O4при 374 ° C и, наконец, PbO при 605 ° C... Другой полуторный оксид, Pb 2O3, может быть получен при высоком давлении вместе с использованием нестехиометрическими фазами. Многие из них демонстрируют дефектные структуры флюорита, в которых некоторые атомы кислорода заменены вакансиями: можно считать, что PbO имеет такую структуру, в которой отсутствуют все чередующиеся слои элементов кислорода.
Отрицательное окисление состояний может встречаться как фаза Zintl, как свободные анионы свинца, как в Ba 2 Pb, причем свинец формально является свинцом (-IV), или в чувствительных к кислороду кольцевых или многогранные кластерные ионы, такие как тригонально-бипирамидальный ион Pb5, где два атома свинца являются свинцом (-I), а три - свинцом (0). В таких анионах каждый атом находится в полиэдрической вершине и вносит два электрона в каждую ковалентную связь вдоль их sp-гибридных орбиталей, причем два других атома являются внешней неподеленной парой. Их можно получить в жидком аммиаке путем восстановления свинца натрием.
 . Структура молекулы тетраэтилсвинца :. Углерод. Водород. Свинец
. Структура молекулы тетраэтилсвинца :. Углерод. Водород. Свинец Свинец может образовывать многосвязные цепи, свойство, которое он разделяет с его более легкими гомологами в углеродной группе. Его способность делать это намного меньше, потому что энергия связи Pb - Pb более чем в три с половиной раза ниже, чем у связи C - C. Сам по себе свинец может образовывать связи металл-металл порядка трех. С помощью обычных органических соединений, которые образуют обычные органические соединения (из-за того, что Pb-C довольно слабая), образует соединение между ними. Это делает металлоорганическую химию свинца гораздо менее обширной, чем химию олова. Свинец преимущественно образует свинецорганические (IV) соединения, даже если исходить из неорганических реагентов свинца (II); известно очень мало свинецорганических (II) соединений. Наиболее хорошо охарактеризованными исключениями являются Pb [CH (SiMe 3)2]2и Pb (η-C 5H5)2.
). Ведущий аналог простейшего органического соединения, метан, составляет плюмбан. Плюмбан может быть получен в результате реакции металлическим свинцом и атомарным водородом. Два простых производных, тетраметилсвинец и тетраэтилсвинец, являются лучшими известными Эти соединения относительно стабильны: тетраэтилсвинец начинает разлагаться только при нагревании или воздействии солнечного света или ультрафиолетового света. Металлоорганических соединений, таких как тетраэтилсвинец. Окислительная природа многих соединений свинца успешно используется: тетраацетат свинца является важным лабораторным реагентом для окисления в организме. ический синтезе. Тетраэтилсвинец, однажды добавленный в бензин, производился в больших количествах, чем любое другое металлоорганическое соединение. фунты менее химически стабильны. Для многих соединений не существует аналога свинца.
| Атомное. число | Элемент | Относительное. количество |
|---|---|---|
| 42 | Молибден | 0,798 |
| 46 | Палладий | 0,440 |
| 50 | Олово | 1,146 |
| 78 | Платина | 0,417 |
| 80 | Ртуть | 0,127 |
| 82 | Свинец | 1 |
| 90 | Торий | 0,011 |
| 92 | Уран | 0,003 |
Содержание свинца на частицу в Солнечной системе составляет 0,121 частей на миллиард (частей на миллиард). Этот показатель в два с половиной раза выше, чем у платины, в восемь раз больше, чем у ртути, и в семнадцать раз больше, чем у золота. Количество свинца во вселенной медленно увеличивается, поскольку все из нестабильны атомы постепенно распадаются на свинец. Содержание свинца в Солнечной системе с момента ее образования 4,5 миллиарда лет назад увеличилось примерно на 0,75%. Таблица содержания в солнечной системе показывает, что свинец, несмотря на распространение других элементов с атомным номером больше 40.
Первородный свинец, включающий изотопы свинец-204, свинец-206, свинец-207 и свинец-208 - в основном образовался в результате повторяющихся процессов захвата нейтронов, происходящих в звездах. Двумя режимами захвата являются s- и r-процессы.
В s-процессе (s означает «медленный») захваты разделяются годами или десятилетиями, что позволяет меньше стабильные ядра претерпевают бета -распад. Стабильное ядро таллия-203 может захватить нейтрон и стать таллием-204; он подвергается бета-распаду с образованием стабильного свинца-204; при захвате другого нейтрона он становится свинцом-205, период полураспада которого составляет около 15 миллионов лет. Дальнейшие захваты приводят к свинцу-206, свинцу-207 и свинцу-208. При захвате другого нейтрона свинец-208 становится свинцом-209, который быстро распадается на висмут-209. При захвате другого нейтрона висмут-209 становится висмутом-210, и этот бета-распадом превращается в полоний-210, который альфа-распадом до свинца-206. Таким образом, цикл заканчивается на свинце-206, свинце-207, свинце-208 и висмуте-209.
 График заключительной части s-процесса, от ртути к полонию. Красные линии и кружки включают захваты нейтронов ; синие стрелки указывают бета-распад ; зеленая стрелка представляет альфа-распад ; голубые стрелки обозначают захват электронов.
График заключительной части s-процесса, от ртути к полонию. Красные линии и кружки включают захваты нейтронов ; синие стрелки указывают бета-распад ; зеленая стрелка представляет альфа-распад ; голубые стрелки обозначают захват электронов.В r-процессе (r означает «быстрый») захваты проходят быстрее, чем ядра могут распадаться. Это происходит в средах с высокой плотностью нейтронов, таких как сверхновая или с влиянием двух нейтронных звезд. Поток нейтронов может создать порядок 10 нейтронов на квадратный сантиметр в секунду. R-процесс не формирует столько свинца, как s-процесс. Он имеет тенденцию останавливаться, когда богатые нейтронами ядра достигают 126 нейтронов. В этот момент нейтроны располагаются в полных оболочках в атомном ядре, и энергетическая становится труднее link их большее количество. Когда поток нейтронов спадает, эти ядра бета-распада распадаются на стабильные изотопы осмия, иридия и платины.
Свинец классифицируется как халькофил по классификации Гольдшмидта, что означает, что он обычно встречается в сочетании с серой. Он редко встречается в своей естественной металлической форме. Многие свинцовые минералы относительно легкие и на протяжении истории Земли оставались в коре вместо того, чтобы погрузиться глубже в недра Земли. Этим объясняется относительно высокое содержание свинца в земной коре - 14 частей на миллион; это 38-й по содержанию элемент в земной коре.
Основным свинцовым минералом является галенит (PbS), который в основном встречается в цинковых рудах. Большинство других свинцовых минералов так или иначе связаны с галенитом; буланжерит, Pb 5Sb4S11, представляет собой смешанный сульфид, полученный из галенита; англезит, PbSO 4, является продуктом окисления галенита; и церуссит или белая свинцовая руда, PbCO 3, является продуктом разложения галенита. Мышьяк, олово, сурьма, серебро, золото, медь и висмут являются обычными примесями в минералах свинца.
 Свинец - довольно распространенный элемент земной коры за его высокий атомный номер (82). Большинство элементов с атомным номером больше 40 менее распространены.
Свинец - довольно распространенный элемент земной коры за его высокий атомный номер (82). Большинство элементов с атомным номером больше 40 менее распространены. Мировые ресурсы свинца превышают два миллиарда тонн. Значительные месторождения находятся в Австралии, Китае, Ирландии, Мексике, Перу, Португалии, России и США. Мировые запасы - ресурсы, которые экономически целесообразно добыть - в 2016 году составили 88 миллионов тонн, из которых Австралия - 35 миллионов, Китай - 17 миллионов, Россия - 6,4 миллиона.
Типичные фоновые концентрации свинца не превышают 0,1 мкг / м в атмосфере; 100 мг / кг в почве; и 5 мкг / л в пресной и морской воде.
Современное английское слово «свинец» имеет германское происхождение; оно происходит от среднеанглийского leed и староанглийского lēad (с macron над «е», означающим, что гласный звук этой буквы длинный). Древнеанглийское слово происходит от гипотетического реконструированного протогерманского * lauda- («свинец»). Согласно лингвистической теории, от этого слова произошли потомки во многих германских языках с точно таким же значением.
Нет единого мнения о происхождении протогерманского * lauda-. Одна из гипотез предполагает, что оно происходит от протоиндоевропейского * lAudh- («свинец»; заглавная буква гласной эквивалентна макрону). Другая гипотеза предполагает, что оно заимствовано из прото-кельтского * ɸloud-io- («свинец»). Это слово связано с латинским plumbum, которое дало элементу его химический символ Pb. Слово * ɸloud-io- считается источником протогерманского * bliwa- (что также означает «свинец»), от которого произошло немецкое слово Blei.
Название химического элемента не связаны с глаголом того же написания, который происходит от протогерманского * layijan- («вести»).
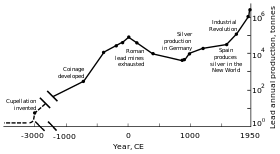 Мировое производство свинца достигло пика в римском периоде и Промышленная революция.
Мировое производство свинца достигло пика в римском периоде и Промышленная революция.Металлические свинцовые бусины , датируемые 7000–6500 гг. До н.э., были найдены в Малой Азии и могут представлять собой первые пример выплавки металла . В то время свинец практически не применялся из-за его мягкости и тусклого вида. Основной причиной распространения производства свинца была его связь с серебром, которое можно получить путем сжигания галенита (распространенного минерала свинца). Древние египтяне были первыми, кто использовал минералы свинца в косметике, и это применение распространилось на Древнюю Грецию и далее; египтяне могли использовать свинец для грузил в рыболовных сетях, глазури, очков, эмали и для украшений. Различные цивилизации Плодородного полумесяца использовали свинец в качестве письменного материала, валюты и строительного материала. Свинец использовался в древнекитайском королевском дворе как стимулятор, как валюта и противозачаточное средство ; цивилизация долины Инда и мезоамериканцы использовали его для изготовления амулетов; а народы Восточной и Южной Африки использовали свинец в волочении проволоки.
Поскольку серебро широко использовалось в качестве декоративного материала и средства обмена, месторождения свинца начали разрабатываться в Малой Азии из 3000 г. до н. Э.; позже месторождения свинца были разработаны в Эгейском и Лаурионе. Эти три региона коллективно доминировали в добыче свинца до c. 1200 г. до н.э. Начиная примерно с 2000 г. до н.э., финикийцы разрабатывали месторождения на Пиренейском полуострове ; к 1600 г. до н.э. добыча свинца существовала на Кипре, Греция и Сардинии.
 Древнегреческие свинцовые пули с крылатой молнией на одной стороне и надписью «ΔΕΞΑΙ» («возьми это» или «улов») с другой стороны
Древнегреческие свинцовые пули с крылатой молнией на одной стороне и надписью «ΔΕΞΑΙ» («возьми это» или «улов») с другой стороны Территориальная экспансия Рима в Европе и Средиземноморье, а также развитие горнодобывающей промышленности, приводящей к использованию новейших технологий свинца в классическую эпоху, с расчетным годовым объемом производства 80 000. Римляне их свинец в основном как побочный продукт при выплавке. Добыча свинца происходила в Центральной Европе, Британии, Балканах., Греция, Анатолия и Испания, на долю последней 40% мирового производства.
Обычно использовались свинцовые таблетки в качестве материала для букв., Отлитые в плоские песчаные формы, со сменными мотивами, использовались вере умершего, использовались в древней Иудее. Свинец использовался для изготовления пращовых пуль с 5 века до нашей эры. Во времена Римской империи широко применялись свинцовые пули, которые были эффективны на расстоянии от 100 до 150 метров. Балеарские пращники, использовавшиеся в качестве наемников в карфагенской и римской армиях, были известны своей дальностью стрельбы и точностью.
Свинец использовался для изготовления водопроводных труб в Римской империи ; латинское слово, обозначающее металл, свинец, является английским словом «сантехника ». Простота работы и устойчивость к коррозии обеспечили его широкое применение в других областях, включаятутику, кровлю, валюту и войну. Писатели того времени, такие как Катон Старший, Колумелла и Плиний Старший, рекомендовали свинцовые (или покрытые свинцом) сосуды для приготовления подсластители и консерванты добавлены в вино и пищу. Свинец придавал приятный вкус из-за образования «сахара свинца» (ацетата свинца (II)), тогда как сосуды из меди или бронзы могли придавать горький вкус из-за образования зелени.
Этот металл был наиболее часто используемым материалом в классической античности, и его уместно отнести к (римскому) свинцовому веку. Свинец был для римлян тем же, чем пластик для нас.Хайнц Эшнауэр и Маркус Штопплер. «Вино - энологический банк образцов», 1992
Римский автор Витрувий сообщил об опасности для здоровья ведущие и современные авторы предположили, что отравление свинцом сыграло важную роль в упадке Римской империи. Другие исследователи раскритиковали такие утверждения, отметив, например, что не все боли в животе вызваны отравлением свинцом. Согласно археологическим исследованиям, римские свинцовые трубы повышали уровень свинца в водопроводной воде, но такой эффект «вряд ли был действительно вредным». Когда отравление свинцом действительно происходило, жертв называли «сатурнианскими», темными и циничными, в честь омерзительного отца богов Сатурн. По ассоциации свинец считался отцом всех металлов. Его статус в римском обществе был низким, поскольку он был легко доступен и дешев.
 Римские свинцовые трубы
Римские свинцовые трубы В классическую эпоху (и даже до 17 века) олово часто не отличался от свинца: римляне называли свинец plumbum nigrum («черный свинец») и tin plumbum Candidum («светлый свинец»). Связь свинца и олова прослеживается и в других языках: слово олово в чешском переводится как «свинец», а в русском его родственное слово олово ( олово) означает «жесть». Кроме того, свинец имел тесную связь с сурьмой: оба элемента обычно встречаются в виде сульфидов (галенит и антимонит ), часто вместе. Плиний неправильно писал, что при нагревании стибнит дает свинец, а не сурьму. В таких странах, как Турция и Индия, первоначально персидское название сурма стало обозначать либо сульфид сурьмы, либо сульфид свинца, а в некоторых языках, таких как русский, дало свое название сурьма (сурьма).
Добыча свинца в Западной Европе снизилась после падения Западной Римской империи, при этом Аравийская Иберия была единственным регионом, имеющим значительную добычу. Наибольшее производство свинца происходило в Южной и Восточной Азии, особенно в Китае и Индии, где добыча свинца быстро росла.
 Английская Елизавета I обычно изображалась с побелевшим лицом. Считается, что свинец в отбеливателях для лица способствовал ее смерти.
Английская Елизавета I обычно изображалась с побелевшим лицом. Считается, что свинец в отбеливателях для лица способствовал ее смерти. В Европе производство свинца начало расти в XI и XII веках, когда он снова стал использоваться для кровли и трубопроводов. Начиная с 13 века свинец использовали для создания витражей. В европейских и арабских традициях алхимии свинец (символ ![]() в европейской традиции) считался нечистым основным металлом которое путем разделения, очищения и уравновешивания составляющих его сущностей могло быть преобразовано в чистое и нетленное золото. В тот период свинец все чаще использовался для фальсификации вина. Использование такого вина было запрещено для использования в христианских обрядах папской буллой в 1498 году, но его продолжали пить и приводили к массовым отравлениям вплоть до конца 18 века. Свинец был ключевым материалом в деталях печатного станка , изобретенного около 1440 года; Печатные работники обычно вдыхали свинцовую пыль, вызывая отравление свинцом. Примерно в то же время было изобретено огнестрельное оружие, и свинец, несмотря на то, что он был дороже железа, стал основным материалом для изготовления пуль. Он был менее разрушительным для железных стволов, имел более высокую плотность (что позволяло лучше сохранять скорость), а его более низкая температура плавления облегчала производство пуль, поскольку их можно было изготовить с помощью дровяного огня. Свинец в виде венецианской церузы широко использовался в косметике западноевропейской аристократией, поскольку побеленные лица считались признаком скромности. Позже эта практика распространилась на белые парики и подводку для глаз и исчезла только с Французской революцией в конце 18 века. Подобная мода появилась в Японии в 18 веке с появлением гейш, практика, которая продолжалась и в 20 веке. Белые лица женщин «стали олицетворением их женских достоинств японских женщин», при этом свинец обычно используется в отбеливателе.
в европейской традиции) считался нечистым основным металлом которое путем разделения, очищения и уравновешивания составляющих его сущностей могло быть преобразовано в чистое и нетленное золото. В тот период свинец все чаще использовался для фальсификации вина. Использование такого вина было запрещено для использования в христианских обрядах папской буллой в 1498 году, но его продолжали пить и приводили к массовым отравлениям вплоть до конца 18 века. Свинец был ключевым материалом в деталях печатного станка , изобретенного около 1440 года; Печатные работники обычно вдыхали свинцовую пыль, вызывая отравление свинцом. Примерно в то же время было изобретено огнестрельное оружие, и свинец, несмотря на то, что он был дороже железа, стал основным материалом для изготовления пуль. Он был менее разрушительным для железных стволов, имел более высокую плотность (что позволяло лучше сохранять скорость), а его более низкая температура плавления облегчала производство пуль, поскольку их можно было изготовить с помощью дровяного огня. Свинец в виде венецианской церузы широко использовался в косметике западноевропейской аристократией, поскольку побеленные лица считались признаком скромности. Позже эта практика распространилась на белые парики и подводку для глаз и исчезла только с Французской революцией в конце 18 века. Подобная мода появилась в Японии в 18 веке с появлением гейш, практика, которая продолжалась и в 20 веке. Белые лица женщин «стали олицетворением их женских достоинств японских женщин», при этом свинец обычно используется в отбеливателе.
В Новом Свете Производство свинца было зафиксировано вскоре после прибытия европейских поселенцев. Самые ранние записи относятся к 1621 году в английской колонии Вирджиния, через четырнадцать лет после ее основания. В Австралии первый рудник, открытый колонистами на континенте, был свинцовым рудником в 1841 году. В Африке добыча и выплавка свинца были известны в Желобе Бенуэ и нижнем бассейне Конго, где свинец использовался для торговли с европейцами и в качестве валюты к 17 веку, задолго до схватки за Африку.
 Добыча свинца в верхнем регионе реки Миссисипи в Соединенных Штатах в 1865
Добыча свинца в верхнем регионе реки Миссисипи в Соединенных Штатах в 1865 Во второй половине 18 века Великобритания, а затем континентальная Европа и США пережили промышленную революцию. Это был первый раз, когда объемы производства свинца превысили показатели Рима. Великобритания была ведущим производителем, потеряв этот статус к середине 19 века с истощением своих рудников и развитием добычи свинца в Германии, Испании и США. К 1900 году Соединенные Штаты были лидером по производству свинца в мире, а другие неевропейские страны - Канада, Мексика и Австралия - начали значительное производство; производство за пределами Европы превышало внутренний. Большая часть спроса на свинец приходилась на сантехнику и покраску - свинцовые краски использовались регулярно. В это время больше людей (из рабочего класса) подвергались воздействию металла, и случаи отравления свинцом участились. Это привело к исследованию эффектов потребления свинца. Доказано, что свинец более опасен в виде дыма, чем в виде твердого металла. Отравление свинцом и подагра были связаны; Британский врач Альфред Баринг Гаррод отметил, что треть его пациентов с подагрой были сантехниками и малярами. Последствия хронического употребления свинца, включая психические расстройства, также изучались в XIX веке. Первые законы, направленные на сокращение отравления свинцом на фабриках, были приняты в 1870-х и 1880-х годах в Соединенном Королевстве.
 Рекламный плакат для Dutch Boy свинцовой краски, США, 1912 год
Рекламный плакат для Dutch Boy свинцовой краски, США, 1912 год Еще одно свидетельство угрозы, исходящей от свинца для человека, было обнаружено в конце 19-го и начале 20-го веков. Механизмы вреда были лучше поняты, свинцовая слепота была задокументирована, и этот элемент был постепенно выведен из общественного использования в Соединенных Штатах и Европе. Соединенное Королевство ввело обязательные производственные инспекции в 1878 году и назначило первого медицинского инспектора фабрик в 1898 году; в результате было сообщено о 25-кратном сокращении случаев отравления свинцом с 1900 по 1944 год. Большинство европейских стран запретили свинцовую краску, которая обычно использовалась из-за ее непрозрачности и водостойкости, для внутренних работ к 1930 году.
Последним серьезным воздействием свинца на человека было добавление тетраэтилсвинца к бензину в качестве антидетонационного агента, практика, которая зародилась в Соединенных Штатах в 1921 году. Она была прекращена в США и Европейском союзе к 2000 году.
В 1970-х годах в США и странах Запада Европейские страны приняли законодательство по снижению загрязнения воздуха свинцом. Воздействие было значительным: хотя исследование, проведенное Центрами по контролю и профилактике заболеваний в США в 1976–1980 годах, показало, что 77,8% населения имели повышенный уровень свинца в крови, в 1991–1994 гг. исследование того же института показало, что доля людей с таким высоким уровнем снизилась до 2,2%. Основным продуктом, изготовленным из свинца к концу 20 века, была свинцово-кислотная батарея.
. С 1960 по 1990 год производство свинца в Западном блоке выросло примерно на 31%. Доля Восточного блока в мировом производстве свинца увеличилась с 10% до 30% с 1950 по 1990 год, при этом Советский Союз был крупнейшим производителем в мире в середине 1970-х годов. и 1980-е годы, и Китай начал крупное производство свинца в конце 20-го века. В отличие от европейских коммунистических стран, Китай к середине 20-го века практически не был индустриализирован; в 2004 году Китай обогнал Австралию как крупнейший производитель свинца. Как и во время европейской индустриализации, свинец оказывает негативное влияние на здоровье в Китае.
По состоянию на 2014 год производство свинца во всем мире увеличивается за счет его использование в свинцово-кислотных аккумуляторах. Существует две основные категории продукции: первичная из добытых руд и вторичная из лома. В 2014 году 4,58 миллиона метрических тонн были получены от первичного производства и 5,64 миллиона тонн от вторичного производства. В тройку лидеров по производству добытого свинцового концентрата в этом году входили Китай, Австралия и США. В тройку лидеров по производству рафинированного свинца вошли Китай, США и Индия. Согласно отчету «Запасы металлов в обществе» за 2010 год Международной группы ресурсов, общее количество свинца, которое используется, складывается, выбрасывается или рассеивается в окружающей среде в глобальном масштабе., составляет 8 кг на душу населения. Большая часть этого приходится на более развитые страны (20–150 кг на душу населения), а не в менее развитых странах (1–4 кг на душу населения).
Процессы производства первичного и вторичного свинца схожи. Некоторые предприятия первичного производства в настоящее время дополняют свою деятельность ломом свинца, и эта тенденция, вероятно, усилится в будущем. При использовании соответствующих технологий свинец, полученный во вторичных процессах, неотличим от свинца, полученного в первичных процессах. Свинцовый лом из строительной отрасли обычно довольно чистый и переплавляется без переплавки, хотя иногда требуется рафинирование. Таким образом, производство вторичного свинца обходится дешевле с точки зрения потребности в энергии, чем производство первичного, часто на 50% и более.
Большинство свинцовых руд содержат низкий процент свинца (богатые руды обычно имеют содержание 3–8%), которые необходимо сконцентрировать для экстракции. Во время начальной обработки руды обычно подвергаются дроблению, измельчению, пенной флотации и сушке. Полученный концентрат, который имеет содержание свинца 30–80% по массе (обычно 50–60%), затем превращается в (нечистый) металлический свинец.
Это можно сделать двумя основными способами: двухстадийный процесс, включающий обжиг с последующей экстракцией в доменной печи, проводимый в отдельных сосудах; или прямой процесс, при котором экстракция концентрата происходит в одном сосуде. Последний стал наиболее распространенным маршрутом, хотя первый по-прежнему имеет большое значение.
| Страна | Добыча. (тыс.. тонн) |
|---|---|
| 2400 | |
| 500 | |
| 335 | |
| 310 | |
| 250 | |
| 225 | |
| 135 | |
| 80 | |
| 76 | |
| 75 | |
| 41 | |
| 41 | |
| 40 | |
| 40 | |
| 35 | |
| 33 | |
| 33 | |
| Другие страны | 170 |
Сначала сульфидный концентрат обжигают на воздухе для окисления сульфида свинца:
Поскольку исходный концентрат не был чистым сульфидом свинца, обжиг дает не только желаемый оксид свинца (II), но смесь оксиды, сульфаты и силикаты свинца и других металлов, содержащихся в руде. Этот нечистый оксид свинца восстанавливается в доменной печи с коксом до (опять же нечистого) металла:
Примеси - это в основном мышьяк, сурьма, висмут, цинк, медь, серебро и золото. Обычно их удаляют в серии пирометаллургических процессов. Расплав обрабатывают в отражательной печи воздухом, паром и серой, которая окисляет примеси, за исключением серебра, золота и висмута. Окисленные загрязнения всплывают в верхнюю часть расплава и снимаются. Металлическое серебро и золото удаляются и экономично извлекаются с помощью процесса Паркса, в котором цинк добавляется к свинцу. Цинк, который не смешивается со свинцом, растворяет серебро и золото. Раствор цинка можно отделить от свинца, а серебро и золото извлечь. Обесеребренный свинец освобождают от висмута с помощью процесса Беттертона – Кролла, обрабатывая его металлическим кальцием и магнием. Образовавшийся шлак висмута может быть удален.
В качестве альтернативы пирометаллургическим процессам очень чистый свинец может быть получен путем электролитической обработки расплавленного свинца с использованием процесса Беттса. Аноды из нечистого свинца и катоды из чистого свинца помещают в электролит из фторосиликата свинца (PbSiF 6). При приложении электрического потенциала загрязненный свинец на аноде растворяется и оседает на катоде, оставляя большинство примесей в растворе. Это дорогостоящий процесс, и поэтому он в основном предназначен для аффинажа слитков с высоким содержанием примесей.
В этом процессе получают свинцовые слитки и шлак непосредственно из свинцовых концентратов. Концентрат сульфида свинца плавится в печи и окисляется, образуя монооксид свинца. Углерод (в виде кокса или угольного газа ) добавляется к расплавленной загрузке вместе с флюсующими агентами. Таким образом, монооксид свинца восстанавливается до металлического свинца в среде шлака, богатого монооксидом свинца.
Если исходный материал богат свинцом, до 80% исходного свинца может быть получено в виде слитков; остальные 20% образуют шлак, богатый монооксидом свинца. В случае низкосортного сырья весь свинец может быть окислен до шлака с высоким содержанием свинца. Металлический свинец также получают из шлаков с высоким содержанием свинца (25–40%) путем сжигания или впрыска топлива под флюсом, восстановления с помощью электрической печи или их комбинации.
Исследования по более чистому и менее энергоемкому процессу извлечения свинца продолжаются; Главный недостаток состоит в том, что либо слишком много свинца теряется в виде отходов, либо альтернативные методы приводят к высокому содержанию серы в образующемся металлическом свинце. Гидрометаллургическая экстракция, при которой аноды нечистого свинца погружаются в электролит, а чистый свинец осаждается на катоде, является методом, который может иметь потенциал, но в настоящее время неэкономично, за исключением случаев, когда электроэнергия очень дешевая.
Плавка, которая является важной частью первичного производства, часто пропускается во время вторичного производства. Это выполняется только тогда, когда металлический свинец подвергся значительному окислению. Процесс аналогичен процессу первичного производства в доменной печи или вращающейся печи, с существенной разницей в большей вариативности выхода: доменные печи производят твердый свинец (10% сурьма), а в отражательных и вращающихся печах - полумягкий свинец (3–4% сурьмы). процесс Isasmelt - это более новый метод плавки, который может выступать в качестве дополнения к первичному производству; Из аккумуляторной пасты из отработанных свинцово-кислотных аккумуляторов (содержащих сульфат свинца и оксиды свинца) сульфат удаляется обработкой щелочью, а затем обрабатывается в угольной печи в присутствии кислорода, что дает нечистый свинец, а сурьму - самая обычная примесь. Рафинирование вторичного свинца аналогично рафинированию первичного свинца; некоторые процессы рафинирования могут быть пропущены в зависимости от переработанного материала и его потенциального загрязнения.
Из источников свинца для переработки наиболее важными являются свинцово-кислотные батареи; Свинцовые трубы, листы и оболочки кабелей также имеют большое значение.
 Свинцовые кирпичи (легированные 4% сурьмы) используются в качестве защиты от излучения.
Свинцовые кирпичи (легированные 4% сурьмы) используются в качестве защиты от излучения. Вопреки распространенному мнению, грифели карандашей в деревянных карандаши никогда не делались из свинца. Когда карандаш возник как инструмент для письма с графитовой оберткой, конкретный тип используемого графита назывался plumbago (буквально, акт для свинцового или свинцового макета).
Металлический свинец имеет несколько полезных механических свойств, включая высокую плотность, низкую температуру плавления, пластичность и относительную инертность. Многие металлы превосходят свинец в некоторых из этих аспектов, но, как правило, они менее распространены и их труднее извлечь из материнских руд. Токсичность свинца привела к прекращению его использования в некоторых случаях.
Свинец использовался для пуль с момента их изобретения в средние века. Это недорого; его низкая точка плавления означает, что боеприпасы для стрелкового оружия и дробовики могут быть отлиты с минимальным техническим оборудованием; и он более плотный, чем другие обычные металлы, что позволяет лучше сохранять скорость. Он остается основным материалом для пуль, легированных другими металлами в качестве отвердителей. Высказывались опасения, что свинцовые пули, используемые для охоты, могут нанести вред окружающей среде.
Высокая плотность свинца и устойчивость к коррозии использовались в ряде связанных приложений. Используется как балласт в килях парусников; его плотность позволяет ему занимать небольшой объем и минимизировать водонепроницаемость, тем самым уравновешивая кренящее воздействие ветра на паруса. Он используется в дайвинге грузовых поясах для противодействия плавучести дайвера. В 1993 году основание Пизанской башни было укреплено 600 тоннами свинца. Из-за своей коррозионной стойкости свинец используется в качестве защитной оболочки для подводных кабелей.
 Позолоченная свинцовая скульптура 17 века
Позолоченная свинцовая скульптура 17 века Свинец находит множество применений в строительной индустрии; Свинцовые листы используются в качестве архитектурных металлов в кровельных материалах, облицовке, гидроизоляции, желобах и соединениях желобов, а также на парапетах крыш. Свинец до сих пор используется в статуях и скульптурах, в том числе для арматуры. В прошлом его часто использовали для балансировки колес автомобилей ; по экологическим причинам это использование постепенно прекращается в пользу других материалов.
Свинец добавляют в медные сплавы, такие как латунь и бронза, для улучшения обрабатываемости и за его смазочные качества. Практически нерастворимый в меди свинец образует твердые глобулы в дефектах по всему сплаву, таких как границы зерен . В низких концентрациях, а также действуют как смазка, глобулы препятствуют образованию стружки при обработке сплава, тем самым улучшая обрабатываемость. В подшипниках используются медные сплавы с повышенным содержанием свинца. Свинец обеспечивает смазку, а медь обеспечивает несущую поддержку.
Высокая плотность, атомный номер и формуемость свинца составляют основу использования свинца в качестве барьера,поглощающего звук, вибрацию и излучение. Свинец не имеет собственных резонансных частот; в результате листовой свинец используется в качестве звукоизоляционного слоя в стенах, полах и потолках звуковых студий. Трубы для органа часто изготавливаются из свинцового сплава, смешанного с различным контроля тон каждой трубы. Свинец является общепризнанным защищающим от излучения в ядерной науке и в рентгеновских помещениях из-за его плотности и высокой коэффициент затухания. Расплавленный свинец использовался в качестве теплоносителя для быстрых реакторов со свинцовым теплоносителем.
Наибольшее применение свинца в начале 21 века находилось в свинцово-кислотных батареях. Свинец в батареях не контактирует напрямую с людьми, поэтому опасения по поводу токсичности меньше. Люди, работающие на заводах по производству аккумуляторов, могут подвергаться воздействию свинцовой пыли и вдыхать ее.} Реакции в аккумуляторе между свинцом, диоксидом свинца и серной кислотой надежный источник напряжения. Суперконденсаторы со свинцово-кислотными батареями были установлены в приложениях киловаттного и мегаваттного масштаба в Австралии, Японии и США для регулирования частоты, сглаживания и переключения солнечной энергии, сглаживания ветра и других приложений. Эти батареи имеют более низкую плотность энергии и эффективность заряда-разряда, чем литий-ионные батареи, но они значительно дешевле.
 Свинцовое стекло
Свинцовое стекло Свинец используется в высоковольтных силовых кабелях в качестве материала для предотвращения попадания воды диффузия в изоляцию; это сокращается по мере отказа от использования свинца. Его использование в припое для электроники постепенно прекращается в некоторых странах, чтобы сократить количество опасных отходов. Свинец - один из трех металлов, тесте используется в Oddy для музейных материалов, помогающий обнаруживать органические кислоты, альдегиды и кислые газы.
Помимо того, что они являются основным потребителем свинцового металла, свинцово-кислотные батареи также являются основным потребителем соединений свинца. Реакция накопления энергии, используемая в этих устройствах, включает сульфат свинца и диоксид свинца :
Другие соединения соединений свинца очень специализированы и часто исчезают. Красители на основе свинца используются в керамической глазури и стекле, особенно для красных и желтых оттенков. Хотя использование свинцовых красок постепенно прекращается в Европе и Северной Америке, они по-прежнему используются в менее развитых странах, таких как Китай, Индия или Индонезия. Тетраацетат свинца и диоксид свинца используются в качестве окислителей в органической химии. Свинец часто используется в покрытии поливинилхлорида электрические шнуров. Его можно использовать для обработки фитилей свечей, чтобы обеспечить более длительный и равномерный горение. Из-за его токсичности европейские и североамериканские производители используют такие альтернативы, как цинк. Свинцовое стекло состоит из 12–28% оксида свинца, что изменяет его оптические характеристики и снижает пропускание ионизирующего излучения. радиация. Свинцовые полупроводники, такие как теллурид свинца и селенид свинца, используются в фотоэлектрических элементах и инфракрасных детекторах.
| Опасности | |
|---|---|
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасно |
| Краткая характеристика опасности GHS | H302, H332, H351, H360Df, H373, H410 |
| Меры предосторожности GHS | P201, P261, P273, P304, P340, P312, P308, P313, P391 |
| NFPA 704 (огненный алмаз) |  0 2 0 0 2 0 |
Свинец не имеет подтвержденной биологической роли, нет подтвержденного безопасного уровня воздействия. Канадско-американское исследование 2009 года «вредные последствия для психического здоровья» даже на уровнях, которые незначительными или не представляющими никакого риска. Его распространенность в организме человека - в среднем 120 мг для взрослого - среди тяжелых металлов, тем не менее, больше цинк (2500 мг) и железо (4000 мг). Соли свинца очень эффективно усваиваются организмом. Небольшое количество свинца (1%) хранится в костях; остальное выводится с мочой и калом в течение нескольких недель после воздействия. Только около трети свинца выводится из организма ребенка. Постоянное воздействие может привести к биоаккумуляции свинца.
Свинец - очень ядовитый металл (при вдыхании или проглатывании), поражающий почти все органы и системы в организме. тело человека. При концентрации в воздухе 100 мг / м3 он опасен для жизни и здоровья. Большая часть проглоченного свинца попадает в кровоток. Основная причина его токсичности - это его склонность мешать правильному функционированию ферментов. Это достигается путем связывания с сульфгидри группами, обнаруженными во многих ферментативных реакциях кофакторами во многих ферментативных реакциях. Среди важнейших металлов, которые взаимодействует свинец, - кальций, железо и цинк. Высокий уровень кальция и железа, как правило, обеспечивает некоторую защиту от отравления свинцом; низкие уровни повышенную восприимчивость.
Свинец может вызвать повреждения мозга и почек и, в конечном итоге, смерть. Имитируя кальций, свинец может преодолевать гематоэнцефалический барьер. Он разрушает миелин оболочки нейронов, уменьшает их количество, препятствует маршрутам нейротрансмиссии и снижает рост нейронов. В организме человека свинец ингибирует порфобилиногенсинтазу и феррохелатазу, предотвращает как образование порфобилиногена, так и включение железа в протопорфирин. IX, последняя стадия синтеза гема. Это вызывает неэффективный синтез гема и микроцитарную анемию.
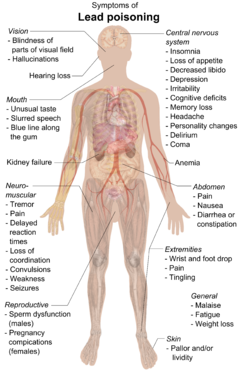 Симптомы отравления свинцом
Симптомы отравления свинцом Симптомы отравления свинцом включают нефропатию, колические -подобные боли в животе и, возможно, слабость в организме. животе. пальцы, запястья или лодыжки. Небольшое повышение артериального давления, особенно у людей среднего и пожилого возраста, может вызвать анемию. Несколько исследований, в основном поперечных, показывают связь между повышенным воздействием свинца и снижением вариабельности сердечного ритма. У беременных женщин высокие уровни воздействия свинца вызвать выкидыш. Было показано, что хроническое воздействие высокого уровня снижает фертильность у мужчин.
В развивающемся мозге ребенка свинец препятствует образованию синапсов в коре головного мозга, нейрохимия развитие (в том числе нейротрансмиттеров) и организация ионных каналов. Воздействие в раннем детстве связано с повышенным риском нарушения сна и чрезмерной сонливости в более позднем детстве. Высокий уровень в крови с задержкой полового созревания у девочек. Повышение и снижение воздействия переносимого по сжиганию тетраэтилсвинца в бензине в течение 20-го века было связано с историческим ростом и снижением уровня преступности, гипотеза, которая не является общепринятой.
Воздействие свинца является глобальной проблемой, поскольку добыча и выплавка свинца, а также производство / утилизация / переработка аккумуляторов широко распространены во многих странах. Свинец попадает в организм при вдыхании, проглатывании или абсорбции через кожу. Почти весь вдыхаемый свинец всасывается в организм; при проглатывании показатель составляет 20–70%, при этом у детей процент выше, чем у взрослых.
Отравление обычно возникает в результате проглатывания пищи или воды, загрязненных свинцом, и реже после случайного проглатывания загрязненной почвы, пыли, или краски на основе свинца. Продукты с морской водой могут содержать свинец, если они попадают в близлежащие промышленные воды. Фрукты и овощи могут быть загрязнены высоким содержанием свинца в почве, в которой они были выращены. Почва может быть загрязнена из-за накопления твердых частиц свинца в трубах, свинцовой краски и остаточных выбросов этилированного бензина.
Использование этилированного бензина. свинец для водопроводных труб - проблема в районах с мягкой или кислой водой. Жесткая вода образует нерастворимые слои в трубах, тогда как мягкая и кислая вода растворяет свинцовые трубы. Растворенный диоксид углерода в переносимой воде может привести к образованию растворимого бикарбоната свинца ; кислородсодержащая вода может растворять свинец аналогично гидроксиду свинца (II). Питье такой воды может вызвать проблемы со здоровьем из-за токсичности растворенного свинца. Чем тверже вода, тем больше бикарбоната кальция и сульфата она будет содержать, и тем больше внутренняя поверхность труб будет покрыта защитным слоем карбоната свинца. или сульфат свинца.
 Кимографическая запись воздействия ацетата свинца на экспериментальное сердце лягушки.
Кимографическая запись воздействия ацетата свинца на экспериментальное сердце лягушки. Проглатывание нанесенной краски на основе свинца является основным источником воздействия на детей: прямой источник грызет старое окрашенное окно пороги. В качестве альтернативы, когда нанесенная сухая краска портится, она отслаивается, превращается в пыль и попадает в организм через контактные руки в рот или через загрязненную пищу, воду или спирт. Прием некоторых домашних средств может привести к контакту со свинцом или его соединениями.
Вдыхание является вторым основным воздействием. Сигаретный дым содержит, помимо других токсичных веществ, радиоактивный свинец-210.
Воздействие на кожу может быть значительным для людей, работающих с органическими соединениями свинца. Скорость всасывания неорганического свинца в кожу ниже.
Лечение отравления свинцом обычно включает введение димеркапрола и сукцимера. В острых случаях может потребоваться использование динатрия эдетата кальция, хелата кальция и динатриевой соли этилендиаминтетрауксусной кислоты (EDTA ). Он имеет большее сродство к свинцу, чем кальций, в результате чего хелат свинца образуется в результате обмена и выводится с мочой, оставляя безвредный кальций.
 Место сбора аккумуляторов в Дакаре, Сенегал, где в 2008 году от отравления свинцом умерло не менее 18 детей.
Место сбора аккумуляторов в Дакаре, Сенегал, где в 2008 году от отравления свинцом умерло не менее 18 детей. Добыча, производство, использование и удаление свинца и его продуктов вызвали значительное загрязнение почв и вод Земли. Выбросы свинца в атмосферу достигли своего пика во время промышленной революции и периода использования этилированного бензина во второй половине двадцатого века. Выбросы свинца происходят из природных источников (т. Е. Концентраций свинца природного происхождения), промышленного производства, сжигания и переработки, а также мобилизации ранее захороненного свинца. Повышенные концентрации свинца сохраняются в почвах и отложениях в постиндустриальных и городских районах; промышленные выбросы, в том числе связанные с сжиганием угля, продолжаются во многих частях мира, особенно в развивающихся странах.
Свинец может накапливаться в почвах, особенно в почвах с высоким содержанием органических веществ, где он остается от сотен до тысяч лет. Свинец в окружающей среде может конкурировать с другими металлами, обнаруженными на поверхности растений и на их поверхности, потенциально ингибируя фотосинтез, и в достаточно высоких концентрациях, отрицательно влияя на рост и выживание растений. Загрязнение почвы и растений может позволить свинцу подняться по пищевой цепи, поражая микроорганизмы и животных. У животных свинец проявляет токсичность для многих органов, повреждая нервную почечную, репродуктивную кроветворную и сердечно-сосудистую системы после приема внутрь, вдыхания или абсорбции через кожу. Рыба поглощает свинец как из воды, так и из донных отложений; биоаккумуляция в пищевой цепочке представляет опасность для рыб, птиц и морских млекопитающих.
Антропогенный свинец включает свинец от дробовиков и грузил. Они являются одними из самых мощных источников загрязнения свинцом наряду с объектами производства свинца. Свинец был запрещен для дроби и грузила в США в 2017 году, хотя этот запрет действовал только в течение месяца, и аналогичный запрет рассматривается в Европейском союзе.
Аналитические методы определения свинца в среда включает спектрофотометрию, рентгеновскую флуоресценцию, атомную спектроскопию и электрохимические методы. На основе ионофора S, S'-метиленбис (N, N-диизобутил дитиокарбамат ) был разработан специальный ион-селективный электрод. Важным биомаркером отравления свинцом является уровень δ-аминолевулиновой кислоты в плазме, сыворотке и моче.
 Рентгенография лебедя, найденного мертвым в Конде-сюр-л'Эско (север Франции), выделив свинцовую дробь. Есть сотни свинцовых гранул; дюжины достаточно, чтобы убить взрослого лебедя за несколько дней. Такие тела являются источниками загрязнения окружающей среды свинцом.
Рентгенография лебедя, найденного мертвым в Конде-сюр-л'Эско (север Франции), выделив свинцовую дробь. Есть сотни свинцовых гранул; дюжины достаточно, чтобы убить взрослого лебедя за несколько дней. Такие тела являются источниками загрязнения окружающей среды свинцом. К середине 1980-х годов использование свинца в промышленности значительно сократилось. В Соединенных Штатах экологические нормы уменьшили или отменили использование свинца в изделиях, не относящихся к аккумуляторным батареям, включая бензин, краски, припои и водные системы. На угольных электростанциях были установлены устройства для контроля твердых частиц для улавливания выбросов свинца. В 1992 году Конгресс США потребовал от Агентства по охране окружающей среды снизить уровень свинца в крови детей страны. Использование свинца было дополнительно ограничено Директивой Европейского Союза об ограничении использования опасных веществ 2003 года. Значительное сокращение отложения свинца произошло в Нидерландах после национального запрета на использование свинцовой дроби для охоты и спортивной стрельбы в 1993 году: с 230 тонн в 1990 году до 47,5 тонн в 1995 году.
В Соединенных Штатах допустимый предел воздействия для свинца на рабочем месте, включая металлический свинец, неорганические соединения свинца и свинцовые мыла были установлены на уровне 50 мкг / м в течение 8-часового рабочего дня, а предел уровня свинца в крови - 5 мкг на 100 г крови. в 2012 году. Свинец по-прежнему может содержаться в вредных количествах в керамограните, виниле (например, используемом для изготовления трубок и изоляции электрических шнуров) и китайской латуни. Старые дома все еще могут содержать свинцовую краску. Белая свинцовая краска была изъята из продажи в промышленно развитых странах, но остаётся специализированное использование других пигментов, таких как желтый хромат свинца. При снятии старой краски шлифованием образует пыль, которую можно вдыхать. Некоторые органы власти санкционировали программы по снижению выбросов свинца на территории, где проживают маленькие дети.
Свинцовые отходы, в зависимости от юрисдикции и окружающей среды, обрабатываются как бытовые отходы (для облегчения работы по борьбе с выбросами свинца) или опасные отходы, требующие стандартной обработки или хранения. Свинец попадает в дикую природу в местах отстрела, и для борьбы с загрязнением свинцом разработан ряд методов управления свинцом, такими как охрана окружающей среды и снижение качества общества. Миграция свинца может увеличиваться в кислых почвах; Чтобы противостоять воздействию почвы, рекомендуется использовать почву для заражения почвы.
Провести исследования о том, как свинец из биосистем с помощью биологических средств исследуются рыбьи кости на предмет их содержания. способность биоремедиата свинца в загрязненной почве. Грибок Aspergillus versicolor эффективно поглощает ионы свинца из промышленных отходов перед попаданием в водоемы. Некоторые бактерии были исследованы на предмет их способности удалять свинец из окружающей среды, включая сульфатредуцирующие бактерии Desulfovibrio и Desulfotomaculum, оба из которых очень эффективны в водные среды.
![]() Эта статья была отправлена в WikiJournal of Science для внешней академической экспертной оценки в 2019 г. (рецензент сообщает ). Обновленный контент был повторно интегрирован на страницу Википедии под лицензией CC-BY-SA-3.0 (). Рецензированная версия записи: Болдырев Михаил Александрович; и другие. (2018), «Ведущий: свойства, история и приложения», WikiJournal of Science, 1 (2): 7, doi : 10.15347 / WJS / 2018.007, Викиданные Q56050531
Эта статья была отправлена в WikiJournal of Science для внешней академической экспертной оценки в 2019 г. (рецензент сообщает ). Обновленный контент был повторно интегрирован на страницу Википедии под лицензией CC-BY-SA-3.0 (). Рецензированная версия записи: Болдырев Михаил Александрович; и другие. (2018), «Ведущий: свойства, история и приложения», WikiJournal of Science, 1 (2): 7, doi : 10.15347 / WJS / 2018.007, Викиданные Q56050531
| Wikisource содержит текст статьи 1879 года American Cyclopædia Lead. |
| Найдите лид в Викисловарь, бесплатном режиме. |
| На Викискладе есть материалы, связанные с Свинец. |