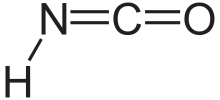 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Изоциановая кислота | |
| Другие имена Карбимид | |
| Идентификаторы | |
| Количество CAS | |
| 3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.109.068 |
| PubChem CID | |
| UNII | |
| Панель управления CompTox ( EPA) | |
ИнЧИ
| |
Улыбки
| |
| Характеристики | |
| Химическая формула | C H N O |
| Молярная масса | 43,025 г моль -1 |
| Появление | Бесцветная жидкость или газ (температура кипения близка к комнатной) |
| Плотность | 1,14 г / см 3 (20 ° С) |
| Температура плавления | -86 ° С (-123 ° F, 187 К) |
| Точка кипения | 23,5 ° С (74,3 ° F, 296,6 К) |
| Растворимость в воде | Растворяется |
| Растворимость | Растворим в бензоле, толуоле, эфире |
| Конъюгированная кислота | Оксометаниний |
| Основание конъюгата | Цианат |
| Опасности | |
| Основные опасности | Ядовитый |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| | |
| Ссылки на инфобоксы | |
Изоциановая кислота - это химическое соединение со структурной формулой HNCO, которую часто записывают как H – N = C = O. Это бесцветное, летучее и ядовитое вещество с температурой кипения 23,5 ° C. Это является преобладающим таутомер из синильной кислоты H-O-C≡N.
Производный анион [N = C = O]- совпадает с циановой кислотой и называется цианатом. Родственная функциональная группа –N = C = O представляет собой изоцианат ; он отличается от цианата –O – C≡N, фульмината –O – N + ≡C - и оксида нитрила –C≡N + –O -.
Изоциановая кислота была открыта в 1830 году Юстусом фон Либихом и Фридрихом Велером.
Изоциановая кислота - это простейшее стабильное химическое соединение, которое содержит углерод, водород, азот и кислород - четыре наиболее часто встречающихся элемента в органической химии и биологии. Это единственный достаточно стабильный из четырех синтезированных линейных изомеров с молекулярной формулой HOCN, остальные представляют собой циановую кислоту H – O – C≡N и неуловимую фульминовую кислоту H – C≡N + –O - и изофульминовую кислоту. H – O – N + ≡C -.
Хотя электронная структура согласно теории валентной связи может быть записана как HN = C = O, колебательный спектр имеет полосу при 2268,8 см -1 в газовой фазе, что ясно указывает на тройную связь углерод-азот. Таким образом, каноническая форма H+N≡C − O - основная резонансная структура.
Чистое соединение имеет точку плавления -86,8 ° C и точку кипения 23,5 ° C, поэтому оно летучее при температуре окружающей среды.
В водном растворе это слабая кислота с p K a 3,7:
Изоциановая кислота гидролизуется до диоксида углерода и аммиака :
При достаточно высоких концентрациях изоциановая кислота олигомеризуется с образованием тримера циануровой кислоты и циамелида, полимера. Эти частицы обычно легко отделяются от продуктов реакции в жидкой или газовой фазе. Сама циануровая кислота при дальнейшем нагревании разлагается обратно до изоциановой кислоты.
Разбавленные растворы изоциановой кислоты стабильны в инертных растворителях, например эфире и хлорированных углеводородах.
Изоциановая кислота реагирует с аминами с образованием мочевины (карбамидов):
Эта реакция называется карбамилированием.
HNCO присоединяется через богатые электронами двойные связи, такие как виниловые эфиры, с получением соответствующих изоцианатов.
Изоциановая кислота, HNCO, представляет собой кислоту Льюиса, свободная энергия, энтальпия и энтропия которой изменяются при ее ассоциации 1: 1 с рядом оснований в растворе четыреххлористого углерода при 25 ° C. Акцепторные свойства HNCO сравниваются с другими кислотами Льюиса в модели ECW.
Таутомер, известный как синильная кислота, HOCN, в котором протонированный атоме кислорода, является неустойчивым к разложению, но в растворе он присутствует в равновесии с изоциановой кислотой в пределы примерно 3%. Колебательный спектр свидетельствует о наличии тройной связи между атомами азота и углерода.
Низкотемпературный фотолиз твердых веществ, содержащих HNCO, приводит к образованию таутомерной циановой кислоты HOC≡N, также называемой цианатом водорода. Чистая циановая кислота не была выделена, и изоциановая кислота является преобладающей формой во всех растворителях. Иногда информация, представленная для циановой кислоты в справочниках, на самом деле относится к изоциановой кислоте.
Изоциановая кислота может быть получена протонированием цианат-аниона, например, из солей, подобных цианату калия, либо газообразным хлористым водородом, либо кислотами, такими как щавелевая кислота.
HNCO также может быть получен путем высокотемпературного термического разложения тримера циануровой кислоты :
В обратном направлении известного синтеза мочевины путем Фридриха Вёлер,
образуется изоциановая кислота, которая быстро тримеризуется в циануровую кислоту.
Изоциановая кислота была обнаружена во многих межзвездных средах.
Изоциановая кислота также присутствует в различных формах дыма, включая смог и сигаретный дым. Он был обнаружен с помощью масс-спектрометрии и легко растворяется в воде, представляя опасность для здоровья легких.