 | |
| Имена | |
|---|---|
| Название IUPAC Бромид железа (II) | |
| Другие имена Бромид железа | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.029.244 |
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКА
| |
| Свойства | |
| Химическая формула | FeBr 2 |
| Молярная масса | 215,65 г моль |
| Внешний вид | твердое вещество желто-коричневого цвета |
| Плотность | 4,63 г / см3, твердое вещество |
| Плавление точка | 684 ° C (1263 ° F, 957 K) (безводный). 27 ° C (гексагидрат) |
| Кипение точка | 934 ° C (1713 ° F; 1207 K) |
| Растворимость в воде | 117 г / 100 мл |
| Растворимость в других растворителях | THF, метанол, этанол |
| Магнитная восприимчивость (χ) | + 13,600 · 10 см / моль |
| Структура | |
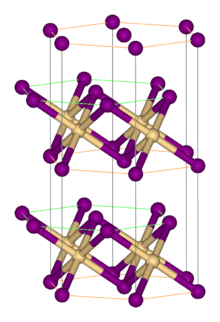
| Кристаллическая структура | Ромбоэдрическая, hP3, SpaceGroup = P-3m1, Нет.164 |
| Координационная геометрия | октаэдрическая |
| Опасности | |
| Основные опасности | нет |
| R-фразы (устаревшие) | R20 R36 / 37 / 38 |
| S-фразы (устаревшие) | S26 S36 |
| Родственные соединения | |
| Прочие анионы | Хлорид железа (II) |
| Другие катионы | бромид железа (III) |
| Родственные соединения | VBr 2 |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Бромид железа (II) представляет собой неорганическое соединение с химической формулой FeBr 2. Безводное соединение представляет собой парамагнитное твердое вещество желтого или коричневатого цвета. Известно также несколько гидратов FeBr 2, причем все они представляют собой твердые вещества бледного цвета. Это обычный предшественник других соединений железа в исследовательских лабораториях, но для этого соединения не существует приложений.
Как и большинство галогенидов металлов, FeBr 2 принимает полимерная структура, состоящая из изолированных металлических центров, сшитых галогенидами. Он кристаллизуется со структурой CdI 2, содержащей плотноупакованные слои бромид-ионов, между которыми расположены ионы Fe (II) в октаэдрических дырках. Упаковка галогенидов немного отличается от упаковки для FeCl 2, в котором используется мотив CdCl 2.
FeBr 2 синтезируют с использованием метанольного раствора концентрированной бромистоводородной кислоты и порошка железа. Он добавляет сольват метанола [Fe (MeOH) 6 ] Br 2 вместе с газообразным водородом. Нагревание метанольного комплекса в вакууме дает чистый FeBr 2.
FeBr 2, который взаимодействует с двумя эквивалентами тетраэтиламмонийбромида с образованием [(C 2H5)4N]2FeBr 4. FeBr 2 реагирует с бромидом и бромом с образованием сильно окрашенных частиц со смешанной валентностью [FeBr 3Br9].
FeBr 2 обладает сильным метамагнетизм при 4,2 K и долгое время изучался как прототипное метамагнитное соединение.