| Идиопатический фиброз легких | |
|---|---|
| Другие | Криптогенный фиброзирующий альвеолит, диффузный фиброзирующий альвеолит, обычный интерстициальный пневмонит |
 | |
| На рисунке A показано расположение легких и дыхательных путей в организме. На вставленном изображении показано подробное изображение дыхательных путей и воздушных мешков легких в разрезе.. На рисунке B показан фиброз (рубцевание) в легких. На вставленном изображении подробно показан фиброз и то, как он повреждает дыхательные пути и воздушные мешочки. | |
| Специализация | Пульмонология |
| Симптомы | Одышка, сухой кашель |
| Осложнения | Легочная гипертензия, сердечная недостаточность, пневмония, легочная эмболия |
| Обычное начало | Постепенное |
| Причины | Неизвестно |
| Факторы риска | Курение сигарет, некоторые вирусные инфекции, семейный анамнез |
| Метод диагностики | КТ, биопсия легкого |
| Дифференциальный диагноз | Саркоидоз, другие интерстициальные заболевания легких, гиперчувствительный пневмонит |
| Лечение | Легочная реабилитация, дополнительный кислород, Трансплантация легких |
| Лекарства | Пирфенидон, нинтеданиб |
| Прогноз | Ожидаемая продолжительность жизни ~ 4 года |
| Частота | 12 на 100 000 человек в год |
Идиопатический фиброз легких (IPF ) - это тип хронического рубца заболевания легких описываетс я прогрессирующим и необратимым снижением функций легких. Симптомы обычно наблюдаемое появление одышки и сухого кашля. Другие изменения чувство усталости и аномально большие и куполообразные ногти на пальцах рук и ног (клубы ногтями). Осложнения могут быть легочной гипертензию, сердечную недостаточность, пневмонию или тромбоэмболию легочной артерии.
Причина неизвестна. Факторы риска включают курение сигарет, вирусные инфекции и семейные анамнезные заболевания. Основной механизм включает рубцевание легких. Диагностика требует других причин. Это может быть подтверждено компьютерной томографией или биопсией легкого, которые показывают обычную интерстициальную пневмонию (UIP). Это тип интерстициального заболевания легких (ILD).
Люди часто получают пользу от легочной реабилитации и дополнительного кислорода. Некоторые лекарства, такие как пирфенидон или нинтеданиб, могут замедлить прогрессирование заболеваний. Трансплантация легких также может быть лип.
Около 5 миллионов человек затронуты во всем мире. Заболевание возникает примерно у 12 на 100 000 человек в год. Чаще всего страдают люди в возрасте от 60 до 70 лет. Мужчины болеют чаще, чем женщины. Средняя продолжительность жизни после постановки диагноза составляет около четырех лет.
 Бить пальцами при идиопатическом фиброзе легких
Бить пальцами при идиопатическом фиброзе легких У многих людей симптомы присутствуют в течение значительного времени до постановки диагноза. Наиболее частые клинические признаки IPF включают следующее:
Некоторые из этих нарушений хронической гипоксемией (недостаток кислорода в крови), не специфичны для IPF и могут возникнуть при других легочных заболеваниях. IPF следует рассматривать у всех пациентов с необъяснимой хронической одышкой при физических нагрузках, которые проявляются кашлем, бибазилярными хрипами на вдохе или ударов пальцами.
Оценка потрескивания «липучки» при аускультации легких - практический способ улучшить ранний диагноз IPF. Мелкие потрескивания легко распознаются клиницистами и характерны для IPF.
двусторонние мелкие потрескивания присутствуют на протяжении всего времени вдоха и сохраняются после нескольких недель вдоха, и если они сохраняются несколько раз с интервалом в несколько недель в возрасте ≥60 лет, это должно вызвать подозрение на ИЛФ и привести к рассмотрению возможности проведения КТВР грудной клетки, которая более чувствительна, чем рентген грудной клетки. Временное потрескивание не характерно для IPF, они должны требовать проведения тщательного диагностического процесса.
Причина IPF неизвестна, но было показано, что факторы окружающей среды и воздействие повышают риск возникновения IPF. Курение сигарет является наиболее подходящим и наиболее приемлемым фактором риска IPF примерно в два раза. Другие воздействия окружающей среды и производственного процесса, такие как воздействие металлической пыли, древесной пыли, угольной пыли, кремнезема, каменной пыли, биологической пыли, исходящей сенной пыли или спор плесени или других сельскохозяйственных продуктов, а также профессии, связанным с сельским хозяйством / животноводством также было показано, что они увеличивают риск ИЛФ. Существуют некоторые свидетельства того, что вирусные инфекции связаны с идиопатическим фиброзом легких и другими фиброзными заболеваниями легких.

Несмотря на обширные исследования, причина IPF остается неизвестной. фиброз в IPF был связан с курением сигарет, факторами окружающей среды (например, воздействием газов, дыма, химикатов или пыли на рабочем месте), другими заболеваниями, включая гастроэзофагеальную рефлюксную болезнь (ГЭРБ), или к генетической предрасположенности (семейная IPF). Однако ни один из них не присутствует у всех людей с IPF и, следовательно, не дает удовлетворительного объяснения болезни.
IPF считает результатом аномального процесса заживления ран, включая / включающий аномальные и чрезмерные отложение коллагена (фиброз) в легочном интерстиции с минимальным ассоциированным воспалением. клеточное старение предположительно является основной причиной, убеждение, которое подтверждено преимуществами наблюдаемых у пациентов сенолитическую терапию.
Предполагается, что первоначальное или повторяющееся повреждение при IPF происходит в клетках легких, называемых альвеолярными эпителиальными клетками (пневмоциты), которые выстилают большую часть альвеолярной поверхности. Считается, что при повреждении типа или потере АЭК I происходит пролиферация АЕС типа II, покрывая открытые базальные мембраны. При нормальной репарации гиперпластические AEC типа II умирают, оставшиеся клетки проходят дифференцировку, чтобы AEC типа I. В патологических условиях и в присутствии трансформирующий фактор роста бета (TGF-β), фибробласты накапливаются в этих поврежденных областях и дифференцируются в миофибробласты, которые секретируют коллаген. и другие белки. Раньше считалось, что воспаление было первым событием, инициировавшим рубцевание легочной ткани. Более поздние результаты показали, что развитие фибробластических очаговует накоплению воспалительных клеток и последующему отложению коллагена. Эта патогенетическая косвенно подтверждается клиническими особенностями IPF, включая скрытое начало в несколько лет, относительно редкие острые обострения и неэффективность иммуносупрессивной терапии. Ряд методов лечения, нацеленных на активацию фибробластов или синтез внеклеточного матрикса, проходят ранние испытания или исследования для разработки.
Семейная IPF составляет менее 5% от общего числа пациентов с IPF и клиническим и гистологическим неотличима от спорадической IPF. Генетические ассоциации включают мутации легочного сурфактанта белков A1, A2, C (SFTPA1, SFTPA2B ) и муцина (MUC5B ). Замечательный аспектом варианта MUC5B его высокая частота обнаружения, так как он обнаруживается примерно у 20% людей северного и западноевропейского происхождения и у 19% популяции Framingham Heart Study. Мутации в генах теломеразы человека также связаны с пациентами со спорадическими IPF (например, гены TERT, TERC ). Недавно в семье с IPF была описана мутация, связанная с Х-хромосомой в третьем гене, связанном с теломеразой, дискерине (DKC1).
Ранний диагноз IPF является для более раннего лечения и возможно улучшение долгосрочного клинического исхода этого прогрессирующего и конечного смертельного заболевания. Если есть подозрение на IPF, диагностика может быть сложной, но было показано, что мультидисциплинарный подход к участию в работе радиолога и патологоанатома, специализирующийся на интерстициальной болезни легких, повышает точность диагностики IPF.
Междисциплинарное согласованное заявление по идиопатической интерстициальной болезни Пневмонии, опубликованные Американским респираторным обществом (ATS) и Европейским респираторным обществом (ERS) в 2000 году, предложили особые основные и второстепенные критерии для установления диагноза IPF. Однако в 2011 году новые упрощенные и обновленные методы диагностики и лечения были опубликованы ATS, ERS совместно с Японским респираторным обществом (JRS) и Латиноамериканской торакальной ассоциацией (ALAT). В настоящее время диагноз IPF требует:
В правильных клинических условиях можно поставить диагноз IPF только с помощью HRCT, чтобы избежать необходимости хирургической биопсии легкого.
Распознавание IPF в клинической практике может быть сложным, поскольку симптомы часто кажутся похожими на симптомы более распространенных заболеваний, таких как астма, хроническая обструктивная болезнь легких (ХОБЛ) и застойная сердечная недостаточность (www.diagnoseipf.com ). Ключевой вопрос, с которым сталкиваются клиницисты, состоит в том, соответствуют ли анамнез, симптомы (или признаки), радиология и исследование функции легких диагнозу IPF или связаны ли выводы с другим процессом. Давно признано, что пациенты с ILD связаны с воздействием асбеста, лекарствами (такими как химиотерапевтические агенты или нитрофурантоин ), ревматоидный артрит и склеродермия / системный склероз может быть трудно отличить от IPF. Другие аспекты дифференциальной диагностики включают интерстициальное заболевание легких, связанное с смешанным заболеванием соединительной ткани, прогрессирующим саркоидозом, хроническим гиперчувствительным пневмонитом, легочным гистиоцитозомом клеток Лангергана и лучевое поражение легких.
 Классификация IIP.
Классификация IIP. Идиопатический фиброз легких (IPF) относится к большой группе из более чем 200 заболеваний легких, известных как интерстициальные заболевания легких (ILD), которые характеризуются поражением легкого интерстиция, ткани между воздушными мешочками легкого. IPF является одним из конкретных проявлений идиопатической интерстициальной пневмонии (МИП), которая, в свою очередь, является типом ИЛЗ, также известным как диффузное паренхиматозное заболевание легких (ДПЛД).
В 2013 г. была обновлена классификация IIP, принятая в 2002 г. Американским торакальным обществом / Европейским респираторным обществом (ATS / ERS). В этой новой классификации есть три основных категории идиопатические интерстициальные пневмонии (IIP): основные IIP, редкие IIP и неклассифицируемые IIP. Основные IIP сгруппированы в хронические фиброзирующие IP (сюда входят IPF и неспецифическая интерстициальная пневмония [NSIP]); ИП, связанный с курением (т.е. респираторный бронхиолит - интерстициальное заболевание легких [RB-ILD] и десквамативная интерстициальная пневмония [DIP]); и острые / подострые ИП (т.е. криптогенная организующая пневмония [COP] и острая интерстициальная пневмония [AIP]).
Диагностика IIP требует исключения известных причин ILD. Примеры ILD с известной причиной включают гиперчувствительный пневмонит, легочный гистиоцитозные клетки Лангергана, асбестоз и сосудистое заболевание коллагена. Однако эти расстройства часто поражают не только интерстиций, но и воздушное пространство, периферические дыхательные пути и кровеносные сосуды.
Рентген грудной клетки полезен при последующем наблюдении за пациентом с IPF. Обычная рентгенография грудной клетки, к сожалению, не является диагностической, но может выявить уменьшенные объемы легких, обычно с заметными сетчатыми интерстициальными показателями около оснований легких.
 Рентгенограмма грудной клетки пациента с IPF. Обратите внимание на небольшие легкие и периферический паттерн ретикулонодулярного помутнения.
Рентгенограмма грудной клетки пациента с IPF. Обратите внимание на небольшие легкие и периферический паттерн ретикулонодулярного помутнения. Радиологическая оценка с помощью КТВР является важным этапом в диагностическом пути при IPF. HRCT выполняется с использованием обычного компьютерного осевого томографического сканера без контрастных веществ. Оценочные срезы очень тонкие, 1-2 мм.
Типичная КТГ грудной клетки IPF демонстрирует фиброзные изменения в обоих легких с преобладанием оснований и периферии. Согласно совместным рекомендациям ATS / ERS / JRS / ALAT 2011, HRCT является важным компонентом диагностического пути при IPF, который может идентифицировать UIP по наличию:
 Высокое разрешение компьютерная томография грудной клетки пациента с ИЛФ. Основные черты - это периферический, преимущественно базальный образец грубой ретикуляции с сотами
Высокое разрешение компьютерная томография грудной клетки пациента с ИЛФ. Основные черты - это периферический, преимущественно базальный образец грубой ретикуляции с сотами В соответствии с обновленными рекомендациями 2011 г. при отсутствии типичного рисунка ПВП на КТВР требуется хирургическая биопсия легкого. для уверенного диагноза.
Гистологические образцы для диагностики IPF должны быть взяты как минимум в трех разных местах. Небольшой биопсии, например, полученной с помощью трансбронхи биопсии легкого (выполненной во время бронхоскопии), обычно недостаточно для этой цели. Следовательно, обычно необходимы более крупные биопсии, полученные хирургическим путем с помощью торакотомии или торакоскопии.
Ткань легкого людей с IPF обычно показывает характерный гистопатологический образец UIP и, следовательно, является патологический аналог IPF. Патологический диагноз UIP часто соответствует клиническому диагнозу IPF, гистологический паттерн UIP можно увидеть и при других заболеваниях, а также при фиброзе известного происхождения (например, ревматических заболеваний). Есть четыре ключевых особенности UIP, включая интерстициальный фиброз в виде «лоскутного рисунка», интерстициальное рубцевание, сотовые изменения и очаги фибробластов.
Фибробластические очаги представляют собой плотные скопления миофибробластов и рубцовой ткани и вместе с сотами являются основными патологическими находками, которые позволяют диагностировать UIP.
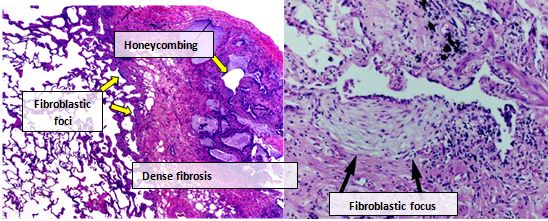 Микрофотография гистопатологических проявлений обычной интерстициальной пневмонии. При большом увеличении (справа) показан очаг пролиферации фибробластов, близкий к области фиброза, в которой можно наблюдать мягкий, неспецифический хронический инфильтрат воспалительных клеток. В субплевральном пространстве можно распознать типичный сотовый аспект.
Микрофотография гистопатологических проявлений обычной интерстициальной пневмонии. При большом увеличении (справа) показан очаг пролиферации фибробластов, близкий к области фиброза, в которой можно наблюдать мягкий, неспецифический хронический инфильтрат воспалительных клеток. В субплевральном пространстве можно распознать типичный сотовый аспект. Бронхоальвеолярный лаваж (БАЛ) - это хорошо переносимая диагностическая процедура при ILD. Цитологический анализ БАЛ (дифференциальный подсчет клеток) следует учитывать при оценке пациентов с ИЛФ по усмотрению лечащего врача, исходя из доступности и опыта в своем учреждении. БАЛ может выявить альтернативные специфические диагнозы: злокачественные новообразования, инфекции, эозинофильная пневмония, гистиоцитоз X или альвеолярный протеиноз. При оценке пациентов с подозрением на ИЛФ наиболее важным применением БАЛ является исключение других диагнозов. Выраженный лимфоцитоз (>30%) обычно позволяет исключить диагноз IPF.
Спирометрия классически выявляет снижение жизненной емкости легких (VC) либо с пропорциональным сокращением воздушных потоков, либо с увеличением воздушных потоков для наблюдаемой жизненной емкости легких. Последнее открытие отражает повышенную жесткость легких (снижение эластичности легких), связанную с фиброзом легких, что приводит к усилению упругой отдачи легких.
Измерение статических объемов легких с помощью плетизмографии тела или других обычно выявляет уменьшение объема легких (ограничение). Это отражает трудности, возникающие при надувании фиброзных легких.
Дифференцирующая способность по монооксиду углерода (DL CO) неизменно снижается при IPF и может быть единственным отклонением от нормы при легкой или ранней стадии заболевания. Его нарушение лежит в основе склонности пациентов с ИЛФ к снижению насыщения кислородом при физических нагрузках, что также можно оценить с помощью теста с 6-минутной ходьбой (6MWT).
Такие термины, как «легкая», «умеренная» и « «тяжелая» иногда используются для определения стадии заболевания и обычно основываются на измерениях функции легких в состоянии покоя. Однако нет четкого консенсуса относительно стадирования пациентов с ИЛФ и того, какие критерии и значения лучше всего использовать. IPF легкой и средней степени тяжести характеризуется следующими функциональными критериями:
Цели лечения IPF заключаются в основном в уменьшении симптомов, остановке прогрессированиязаболевания, предупреждении обострений и продлении выживаемости. Профилактическую помощь (например, вакцинацию) и симптоматическое лечение следует начинать у каждого пациента на ранней стадии.
В рекомендациях IPF 2011 года кислородная терапия или дополнительный кислород для домашнего использования стала рекомендацией для пациентов со значительно низким уровнем кислорода в покое. Хотя кислородная терапия не показала улучшения выживаемости при ИЛФ, данные указывают на улучшение переносимости физических упражнений.
Усталость и потеря мышечной массы являются обычными и инвалидизирующими проблемами пациентов с IPF. Легочная реабилитация может облегчить явные симптомы ИЛФ и улучшить функциональный статус, стабилизировать и / или обращая вспять внелегочные признаки заболевания. Большинство из этих исследований показали краткосрочные улучшения функциональной переносимости физических упражнений, качества жизни и одышки при нагрузке. Типичные программы реабилитации включают упражнения, изменение режима питания, трудотерапию, образование и психосоциальные консультации. В поздней фазе заболевания пациенты с ИЛФ склонны прекращать физическую активность из-за усиливающейся одышки. По возможности этого не следует наносить.
В прошлом был исследован ряд методов лечения IPF, включая интерферон гамма-1β, бозентан, амбризентан и антикоагулянты, но они больше считаются эффективными вариантами лечения. Многие из этих ранних исследований основывались на гипотезе воспалительного заболевания IPF.
A Кокрановский обзор, сравнивающий пирфенидон с плацебо, выявил снижение риска прогрессирования заболеваний на 30%. FVC или VC также были улучшены, даже если небольшое замедление снижения FVC могло быть выполнено только в одном из двух испытаний CAPACITY. Третье исследование, которое было завершено в 2014 году, показало снижение функций легких и прогрессирования заболеваний IPF. Данные исследования ASCEND также были объединены с данными двух исследований CAPACITY в приведенном заданном анализе, который показал, что пирфенидон снижает риск смерти почти на 50% в течение одного года лечения.
N-ацетилцистеин (NAC) является предшественником глутатиона, антиоксиданта. Было предположено, что лечение высокими дозами NAC может восстановить дисбаланс между оксидантами и антиоксидантами, который возникает в ткани легких пациентов с IPF. В первом клиническом исследовании с участием 180 (IFIGENIA) в предыдущем исследовании было показано, что NAC снижает снижение VC и DLCO в течение 12 месяцев при использовании комбинации с преднизоном и азатиоприном. (тройная терапия).
Совсем недавно Национальные институты здоровья (NIH) в США провели большое рандомизированное контролируемое исследование (PANTHER-IPF) для оценки тройной терапии и монотерапии НАК у пациентов с ИЛФ. Это исследование показало, что комбинация преднизона, азатиоприна и NAC увеличивает риск смерти и госпитализаций, и в 2012 году NIH объявил, что группа тройной терапии в исследовании PANTHER-IPF была досрочно прекращена.
Это исследование также оценивало только NAC, и результаты для этой части исследования были опубликованы в мае 2014 г. в журнале New England Journal of Medicine, в котором сделан вывод о том, что «по сравнению с плацебо ацетилцистеин не дает значительных преимуществ в сохранении FVC у пациентов с идиопатическим фиброзом легких с нарушением функций легких от легкой до умеренной».
Нинтеданиб - тройной ингибитор ангиокиназы, нацеленный на рецепторные тирозинкиназы участвует в регуляции ангиогенеза : рецептор фактор роста фибробластов (FGFR), фактор тромбоцитарного фактора роста (PDGFR) и эндотелиальный рецептор фактора роста (VEGFR), которые также участвуют в патогенезе фиброза и IPF. В обоих исследованиях фазы III нинтеданиб снизился уровень легких примерно на 50% в течение одного года. Он был одобрен FDA США в октябре 2014 года и разрешен в Европе в январе 2015 года.
Трансплантация легких может быть подходящей для тех пациентов, которые физически подходят для проведения серьезных операций по трансплантации. Было показано, что у пациентов с пациентами с ИЛФ трансплантация легких снижает риск на 75% по сравнению с пациентами, которые остаются в списке ожидания. С момента введения шкалы распределения легких (LAS), которая определяет приоритетность кандидатов на трансплантацию на основе вероятности выживания, IPF стал наиболее распространенным показанием для трансплантации легких в США.
Пациенты с симптомами и IPF в возрасте до 65 лет и индексом массы тела (ИМТ) ≤26 кг / м 2 должны быть задействованы на трансплантацию легких, но нет четких данных, которые позволили бы определить точное время для LTx. Несмотря на противоречие, самые последние данные предполагают, что двусторонняя трансплантация легкого превосходит трансплантацию одного легкого у пациентов с ИЛФ. Пятилетняя выживаемость после трансплантации легкого при IPF оценивается от 50 до 56%.
Паллиативная помощь направлена на уменьшение симптомов и улучшение комфорта пациентов, а не на лечение болезни. Это может быть использование плохих симптомов с хронических опиоидов сильной одышке и кашле. Кроме того, кислородная терапия может быть полезной для облегчения одышки у пациентов с гипоксемией.
Паллиативная помощь также включает облегчение физических и эмоциональных страданий и психологическую поддержку пациентов и лиц, осуществляющих уход. По мере прогрессирования заболеваний пациенты испытывают страх, тревогу и депрессию, поэтому следует рассмотреть возможность психологического консультирования. В недавнем исследовании амбулаторных пациентов с ILD, включая IPF, оценку депрессии, функциональный статус (по оценке с помощью теста ходьбы), а также легочную функцию, все они способствовали выраженности одышки.
В отдельных случаях, особенно можно было бы рассмотреть тяжелую одышку морфин. Он может уменьшить одышку, беспокойство и кашель без значительного снижения насыщения кислородом.
IPF часто ошибочно диагностируется, по крайней мере, до тех пор, пока физиологические данные и / или данные изображений не укажут на ILD. что приводит задержке в получении доступа к помощи. Учитывая, что IPF - это заболевание, средняя выживаемость которого составляет три года после постановки диагноза, поэтому следует рассмотреть возможность раннего направления в специализированный центр для любого пациента с подозрением или известным ILD. На основе комплексной дифференциальной диагностики, многопрофильное обсуждение между пульмонологами, радиологами и патологами, имеющими опыт диагностики ILD, имеет первостепенное значение для постановки точного диагноза.
После диагностики IPF и выбора соответствующего лечения в зависимости от симптомов и стадии заболевания необходимо тщательное наблюдение. Рак легких (до 25% зарегистрированы в IPF), включая спирометрию (плетизмографию тела), тестирование диффузионной способности, рентген грудной клетки, рентген грудной клетки, высокая вариабельности лечения заболеваний. 6MWT, оценка одышки, качества жизни, потребность в кислороде обязательна.
Кроме того, растущая осведомленность об осложнениях и общих сопутствующих состояниях, часто связанных с IPF, требует регулярных оценок сопутствующих заболеваний, из которых большинство просто сопутствующих заболеваний старения, а также лекарства с их совместными и побочными эффектами.
Острые обострения IPF (AE-IPF) определяют как необъяснимое ухудшение или развитие одышки в течение 30 дней с новыми рентгенологическими инфильтратами при HRCT аномалии, часто наложенной на фон, соответствующей Шаблон UIP. Ежегодная частота AE-IPF составляет от 10 до 15% всех пациентов. Прогноз AE-IPF плохой, летальность составляет от 78% до 96%. Необходимо исключить другие причины AE-IPF, такие как тромбоэмболия легочной артерии, застойная сердечная недостаточность, пневмоторакс или инфекция. Легкую инфекцию следует исключить с помощью эндотрахеального аспирата или БАЛ.
Многие пациенты с острым плохим состоянием нуждаются в интенсивной терапии, особенно когда дыхательная недостаточность связана с гемодинамической нестабильностью, значительными сопутствующими заболеваниями или тяжелой гипоксемией. Однако летальность при госпитализации высока. Механическую вентиляцию легких следует вводить только после тщательного анализа долгосрочного прогноза пациента и по возможности его желаний. Однако текущие рекомендации не рекомендуют использовать искусственную вентиляцию легких у пациентов с респираторной недостаточностью, вторичным по отношению к IPF.
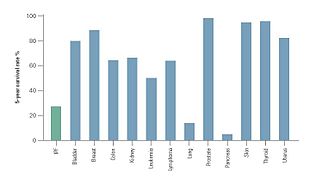 Сравнение 5-летней выживаемости при IPF и распространенных злокачественных новообразований. По материалам Bjoraker et al. 1998.
Сравнение 5-летней выживаемости при IPF и распространенных злокачественных новообразований. По материалам Bjoraker et al. 1998. Клиническое течение IPF может быть непредсказуемым. Прогрессирование IPF связано с оценкой среднего времени выживания от 2 до 5 лет после постановки диагноза. 5-летняя выживаемость для IPF колеблется в пределах 20-40%, уровень смертности выше, чем у ряда злокачественных новообразований, включая рак толстой кишки, множественную миелому и рак мочевого пузыря.
Недавно был введен многомерный индекс и система определения стадий. было предложено прогнозировать смертность при ИПФ. Название индекса - GAP, он основан на поле [G], возрасте [A] и двух физиологии легких [P] (FVC и DL CO, которые обычно измеряются в клинической практике для прогнозирования смертности. Было обнаружено, что наивысшая стадия GAP (стадия III) связана с 39% -ным риском смерти через 1 год. Эта модель также была оценена в IPF и других ILD и показала хорошие результаты в прогнозировании смертности во всех основных Подтипы ILD. GAP был разработан для применения к подтипам ILD, чтобы обеспечить выживаемость по конкретным заболеваниям. У пациентов с IPF общая смертность при 5-летнем уровне высока, но годовой уровень смертности от всех пациентов с Легкое или умеренное поражение легких относительно невелико. того, почему изменение функции легких (ФЖЕЛ) обычно измеряется в одногодичных клинических испытаниях лечения IPF, а не выживаемость.
В дополнение к клиническим и физиологическим параметрам, чтобы пред сказать, насколько быстро пациенты с ИЛФ могут Прогресс, генетические и молекулярные особенности также связаны со смертностью от IPF. Например, было показано, что пациенты с IPF, которые имеют конкретный генотип в полиморфизме гена муцина MUC5B (см. Выше), испытывают более медленное снижение FVC и значительно улучшают выживаемость. Даже если такие данные интересны с научной точки зрения, применение в клинической практике прогностической модели, основанной на конкретных генотипах, по-прежнему невозможно.
IPF, хотя и встречается редко, наиболее распространенная форма IIP. Распространенность IPF оценивается от 14,0 до 42,7 на 100 000 человек на основе анализа данных о заявках на медицинское обслуживание в США, с вариациями в зависимости от определенных случаев, используемых в этом анализе. IPF чаще встречается у мужчин, чем у женщин, и обычно диагностируется у людей старше 50 лет.
заболеваемость IPF трудно определить, поскольку единообразные диагностические правила не применялись последовательно.. Согласно недавнему исследованию, проведенному в США, частота ИЛФ составляет от 6,8 до 16,3 на 100 000 человек. В 27 странах Европейского Союза, по оценке ряда источников, заболеваемость составляет 4,6–7,4 человека на 100 000 населения, что позволяет предположить, что ежегодно около 30 000–35 000 новых пациентов будут диагностированы с ИЛФ.
Недавний сингл. -центровое, ретроспективное, наблюдательное когортное исследование, включающее пациентов с диагнозом ILD в Университетской больнице Орхуса (Дания) в период с 2003 по 2009 год, показало, что заболеваемость ILD составляет 4,1 на 100 000 жителей в год. IPF был наиболее частым диагнозом (28%), за ним следовали ILD, связанные с заболеванием соединительной ткани (14%), гиперчувствительный пневмонит (7%) и неспецифическая интерстициальная пневмония (NSIP) (7%). Заболеваемость ИЛЗ составила 1,3 на 100 000 жителей / год.
Из-за неоднородного распределения болезни по европейским странам эпидемиологические данные необходимо обновлять через общеевропейский регистр ИЛЗ и ИЛЗ.
IPF был обнаружен у нескольких пород собак и кошек и лучше всего охарактеризован у вест-хайленд-уайт-терьеров. Ветеринарные пациенты с этим заболеванием имеют многие из тех же клинических признаков, что и их коллеги-люди, включая прогрессирующую непереносимость физических упражнений, учащенное дыхание и возможный респираторный дистресс. Прогноз в целом плохой.
Ряд агентов в настоящее время исследуются в рамках фазы II клинических испытаний для IPF, включая моноклональные антитела симтузумаб, тралокинумаб, лебрикизумаб и FG-3019, антагонист рецептора лизофосфатидной кислоты (BMS-986020). Также продолжается исследование фазы II STX-100. Эти молекулы направлены против нескольких факторов роста и цитокинов, которые, как известно, играют роль в пролиферации, активации, дифференцировке или ненадлежащем выживании фибробластов.
предшественник микроРНК mir-29 в исследованиях на мышах продемонстрировал обратимость индуцированной IPF. MRG-201 в настоящее время проходит испытания по состоянию на 2016 год, но еще не на пациентах с IPF, и на январь 2016 года не запланировано никаких испытаний на людях для использования IPF.
Лечение стволовыми клетками для IPF является областью исследований.
| Классификация | D |
|---|---|
| Внешние ресурсы |
| Викискладе есть материалы, относящиеся к Идиопатический фиброз легких. |