| Синдром гипоплазии левых отделов сердца | |
|---|---|
| Другие имена | Цианотическая болезнь сердца - гипоплазия левых отделов сердца |
 | |
| Иллюстрация сердца, страдающего синдромом гипоплазии левых отделов сердца | |
| Специальность | Кардиология |
Синдром гипоплазии левых отделов сердца ( HLHS) - это редкий врожденный порок сердца, при котором левая сторона сердца сильно недоразвита. Это может повлиять на левый желудочек, аорту, аортальный или митральный клапан.
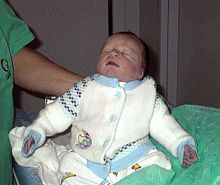 Младенец с цианозом из-за синдрома гипоплазии левых отделов сердца
Младенец с цианозом из-за синдрома гипоплазии левых отделов сердца Закрытие артериального протока в сердце, которое сильно недоразвито слева, приводит к цианозу и респираторной недостаточности, которые могут прогрессировать до кардиогенного шока и смерти. Первые симптомы - цианоз, который не реагирует на введение кислорода или плохое питание. Периферический пульс может быть слабым, а конечности холодными на ощупь.
HLHS часто сочетается с низкой массой тела при рождении и преждевременными родами.
У новорожденных с небольшим дефектом межпредсердной перегородки, называемым «рестриктивным», наблюдается неадекватное смешивание оксигенированной и деоксигенированной крови. У этих новорожденных быстро наступает декомпенсация, и у них развивается ацидоз и цианоз.
На ЭКГ отклонение оси вправо и гипертрофия правого желудочка встречаются часто, но не указывают на HLHS. Рентген грудной клетки может показать большое сердце ( кардиомегалия ) или усиление легочной сосудистой сети. Новорожденные с HLHS обычно не имеют шума в сердце, но в некоторых случаях может быть слышен шум легочного кровотока или шум трехстворчатой регургитации.
Сопутствующая регургитация трикуспидального клапана или дисфункция правого желудочка могут вызвать развитие гепатомегалии.
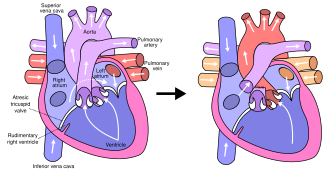
 Схема здорового сердца и сердца с синдромом гипоплазии левых отделов сердца
Схема здорового сердца и сердца с синдромом гипоплазии левых отделов сердца В большинстве случаев HLHS неизвестна причина. Некоторые случаи могут иметь генетический компонент, поскольку было показано, что HLHS передается по наследству и связан с конкретными генными мутациями.
Не все, но некоторые случаи стеноза аорты у плода могут вызвать нагрузку на левый желудочек внутриутробно, что в конечном итоге может привести к снижению перфузии и остановке роста левого желудочка.
При ретроспективном анализе более 1300 новорожденных (родившихся в период с 1996 по 2006 год) из 24 детских больниц в США исследователи Детской больницы Цинциннати в Огайо обнаружили, что у детей, рожденных в летние месяцы, вероятность развития HLHS выше, что позволяет предположить, что сезонность и окружающая среда факторы могут играть важную роль в причинно-следственной связи.
Генетические локусы, связанные с HLHS, включают GJA1 (коннексин 43), HAND1, NKX2.5, 10q22 и 6q23. Существует небольшой риск рецидива при будущих беременностях, оцениваемый в 2-4%, который увеличивается до 25% в семьях с двумя пострадавшими детьми. Считается, что это связано с генетическими мутациями с неполной пенетрантностью.
HLHS также связан с несколькими генетическими синдромами, в том числе трисомией 13 (синдром Патау), трисомии 18 (синдром Эдвардса), частичные трисомии 9, синдром Тернера (ХО), синдром Якобсен (11q делецию синдром), синдром Холт-Орам и Смит Синдром Лемли-Опица.
Наличие кистозной гигромы увеличивает риск HLHS у плода.
При рождении артериальный проток все еще открыт, и сопротивление кровотоку в легких выше нормы. Это обеспечивает адекватную оксигенацию за счет смешивания предсердий и нормальный внешний вид при рождении. Когда проток начинает закрываться и сопротивление легочных сосудов уменьшается, кровоток через проток ограничивается, а кровоток в легкие увеличивается.
В типичной анатомии левая часть сердца получает кровь, богатую кислородом, из легких и перекачивает ее в остальное тело. У людей с HLHS аорта и левый желудочек недоразвиты (начинаются в утробе матери), а аортальный и митральный клапаны либо слишком малы, чтобы обеспечить достаточный кровоток, либо полностью атретичны (закрыты). Поскольку кровь возвращается из легких в левое предсердие, левый желудочек не может перекачивать ее к остальной части тела. Новорожденный полагается на кровь, протекающую через дефект межпредсердной перегородки, чтобы смешивать оксигенированную и деоксигенированную кровь, и на открытый артериальный проток, позволяющий крови достигать аорты и большого круга кровообращения через правый желудочек. Это то, что определяет HLHS как дефект «единственного желудочка».
Из-за недоразвития левой половины сердца в утробе матери повышенная постнагрузка вызывает гипертонию левого предсердия, отек легких и, следовательно, повреждение легких у плода до рождения.
Синдром гипоплазии левых отделов сердца может быть диагностирован пренатально или после рождения с помощью эхокардиографии. Типичные находки включают небольшой левый желудочек и аорту, аномалии митрального и аортального клапанов, ретроградный кровоток в поперечной дуге аорты и кровоток между предсердиями слева направо. Это часто распознается во втором триместре беременности, между 18 и 24 неделями беременности.
Без вмешательств, продлевающих жизнь, HLHS фатален, но с вмешательством младенец может выжить. Кардио хирург может выполнить ряд операций или полную пересадку сердца. В то время как хирургическое вмешательство стало стандартом лечения в Соединенных Штатах, другие национальные системы здравоохранения, особенно во Франции, подходят к диагностике HLHS более консервативно, с акцентом на прерывание беременности или заботу после родов.
Перед операцией проток необходимо держать открытым, чтобы обеспечить кровоток с помощью лекарств, содержащих простагландин. Воздух с меньшим количеством кислорода, чем обычно, используется для младенцев с синдромом гипоплазии левых отделов сердца. Этот низкий уровень кислорода увеличивает сопротивление легочных сосудов (PVR) и, таким образом, улучшает приток крови к остальным частям тела из-за большей разницы давления между легкими и телом. Достижение уровня кислорода ниже атмосферного требует использования вдыхаемого азота. Оксид азота является сильнодействующим легочным вазодилататором и, таким образом, снижает ЛСС и улучшает венозный возврат. Любой фактор, увеличивающий PVR, будет препятствовать правостороннему потоку.
Хирургические операции по лечению гипоплазии левых отделов сердца сложны и должны быть индивидуализированы для каждого пациента. Кардиолог должен оценивать все медицинские и хирургические возможности в индивидуальном порядке.
В настоящее время младенцы подвергаются поэтапной реконструктивной хирургии ( процедура Норвуда или Сано в течение нескольких дней после рождения, процедура Гленна или Хеми-Фонтана в возрасте от 3 до 6 месяцев и процедура Фонтана в возрасте от 1,5 до 5 лет) или трансплантация сердца. Текущие ожидания таковы, что 70% людей с HLHS могут достичь совершеннолетия. Многие исследования показывают, что чем выше объем (количество выполненных операций) в больнице, тем ниже уровень смертности (смертности). Факторы, увеличивающие риск младенца, включают меньшую массу тела при рождении, дополнительные врожденные аномалии, генетический синдром или синдромы с сильно рестриктивной межпредсердной перегородкой.) Для пациентов без этих дополнительных факторов риска 5-летняя выживаемость теперь приближается к 80%. Исследования показывают, что около 75% детей, переживших операцию, демонстрируют задержку развития в одной или нескольких областях, таких как двигательные, когнитивные или языковые нарушения, при этом около трети детей с одним желудочком без генетического синдрома имеют значительные нарушения. Текущие исследования сосредоточены на выявлении взаимосвязей между повреждениями нервной системы, хирургическими вмешательствами и процедурами интенсивной терапии и генетической предрасположенностью с целью изменения вмешательств, ухудшающих психологические и психологические результаты развития нервной системы. Альтернативой традиционному Норвуду является процедура Гибрид.
Некоторые врачи предлагают милосердную помощь вместо операции, которая приводит к смерти ребенка, как правило, в течение 2 недель после рождения. Сострадательный уход находится под наблюдением врача и может осуществляться как в больнице, так и дома. Однако из-за значительного улучшения хирургического вмешательства, когда во многих больницах выживаемость превышает 90%, ведутся споры о том, следует ли по-прежнему предлагать семьям милосердный уход. Исследование, проведенное в 2003 году, показало, что группа врачей, являющихся экспертами по уходу за детьми с HLHS, была равномерно разделена, когда их спросили, что бы они сделали, если бы их собственные дети родились с HLHS, причем 1/3 заявили, что выбрали бы операцию1. / 3 заявили, что выбрали бы паллиативное (сострадательное) лечение без хирургического вмешательства, и 1/3 заявили, что не уверены, какой выбор они сделают.
Трехэтапная процедура является паллиативной процедурой (а не лечением), поскольку кровообращение ребенка работает только с двумя из четырех камер сердца.
Первый шаг - процедура Норвуда. В этой процедуре правый желудочек используется для перекачивания крови в большой круг кровообращения. Поскольку правый желудочек больше не перекачивает кровь напрямую в легкие, требуется шунт, чтобы пропускать дезоксигенированную кровь через легкие. Либо подключичная артерия может быть подключена к малому кругу кровообращения ( шунт Блэлока-Тауссига ), либо шунт проводится непосредственно из правого желудочка в малый круг кровообращения ( шунт Сано ). Узкая аорта увеличивается с помощью пластыря, чтобы улучшить приток крови к телу.
В это время ребенок может быть слабым с медицинской точки зрения и иметь проблемы с кормлением, потому что сердце очень сильно работает. В правом желудочке наблюдается значительная степень венозного перемешивания, что приводит к снижению насыщения кислородом. Кроме того, как шунты Блэлока-Тауссига, так и шунты Сано подвергают легкие системному артериальному давлению, что приводит к долговременной легочной гипертензии и, в конечном итоге, к сердечной недостаточности.
Гибридная процедура может использоваться вместо Норвуда. Гибридная процедура не требует использования искусственного кровообращения или выполнения стернотомии. Вместо шестичасовой операции на Гибрид обычно уходит от одного до двух часов. В этой процедуре стент помещается в артериальный проток для поддержания его проходимости, а ленты накладываются на левую и правую ветви легочной артерии, чтобы ограничить давление и избыточное кровообращение в легких. Результаты гибридного подхода сравнимы с результатами, полученными при использовании Norwood.
Вторая стадия - двунаправленная процедура Гленна или Хеми-Фонтана (см. Также процедуру Кавасима ) - снимает некоторые проблемы, вызванные паллиативной помощью Стадии I. В этой операции верхняя полая вена перевязана от сердца и соединена с малым кровообращением. В это время снимается шунт Блэлока-Тауссига или Сано. Легкие больше не подвергаются системному артериальному давлению, но гораздо ниже венозного давления. Хотя венозная кровь из верхней половины тела больше не смешивается с насыщенной кислородом кровью в правом желудочке, венозная кровь из нижней части тела все еще смешивается, что приводит к некоторой степени десатурации кислородом.
Последняя процедура, процедура Фонтана, завершает восстановление гипоплазии левого отдела сердца. Хотя существует несколько вариантов, функциональный эффект заключается в перенаправлении венозной крови из нижней части тела (через нижнюю полую вену) от правого предсердия в легочную артерию. Это должно исключить любое смешивание оксигенированной и деоксигенированной крови в правом желудочке. Правый желудочек выполняет традиционную работу левого, снабжая тело насыщенной кислородом кровью, в то время как пассивное системное венозное давление выполняет традиционную работу правого желудочка, передавая дезоксигенированную кровь в легкие.
Вмешательства, проводимые во время развития плода, изучаются. У плодов с гипоплазией левого желудочка и неповрежденной межпредсердной перегородкой была предпринята попытка чрескожной септостомии предсердий.
95% нелеченных младенцев с HLHS умирают в первые недели жизни.
Ранняя выживаемость улучшилась с момента введения процедуры Норвуда. Поскольку долгосрочных исследований взрослых HLHS не проводилось, статистические данные обычно получают от пациентов, перенесших Фонтан; по оценкам, 70% пациентов с HLHS могут достичь совершеннолетия.
Прогноз зависит от состояния здоровья ребенка, так как при распространенных детских заболеваниях у младенцев возрастает потребность в респираторной системе и частоте сердечных сокращений. Это уязвимое население имеет небольшой сердечный резерв, чтобы удовлетворить эти потребности и обеспечить стабильность гемодинамики во время болезней.
Дети с HLHS и другими сопоставимыми заболеваниями одного желудочка, как группа, имеют худшие результаты в области развития нервной системы, чем их здоровые сверстники. Был продемонстрирован дефицит речи, исполнительных функций и более высокий уровень тревожных и депрессивных расстройств. Некоторые из этих результатов могут быть следствием генетических факторов, связанных с HLHS, а другие могут быть изменены путем изменения процедур и среды здравоохранения. Клинический консенсус в отношении важности непрерывного наблюдения за развитием нервной системы с самых ранних лет до взрослого возраста формируется в последнее время.
Как и у пациентов с другими типами пороков сердца, связанных с деформированными клапанами, пациенты с HLHS подвержены высокому риску эндокардита и должны находиться под наблюдением кардиолога до конца своей жизни, чтобы проверить свою сердечную функцию.
Может быть показана трансплантация сердца, обычно после завершения операции по Фонтану. Одно многоцентровое исследование (пациентов, перенесших Фонтан в 1993-2001 гг.) Сообщило о 76% -ной годичной выживаемости у пациентов, доживших до трансплантации.
HLHS встречается примерно у 1 из 4300 живорождений в Соединенных Штатах, или примерно у 960 живорождений в год в этой стране. В целом, по оценкам, он составляет 2-3% всех случаев врожденных пороков сердца и является наиболее распространенным пороком одного желудочка. Считается, что это чаще встречается у младенцев мужского пола, в 1,5 раза чаще, чем у младенцев женского пола.
| Классификация | D |
|---|---|
| Внешние ресурсы |