Биогеохимия изотопов водорода - это научное исследование биологических, геологических и химических процессов в окружающей среде с использованием распределения и относительного содержания изотопов водорода. Существует два стабильных изотопа водорода, протий 1 H и дейтерий 2 H, относительное содержание которых колеблется в пределах нескольких сотен промилле. Соотношение между этими двумя видами можно рассматривать как отпечаток изотопного водорода вещества. Понимание изотопных отпечатков пальцев и источников фракционирования, которые приводят к различиям между ними, может применяться для решения широкого круга вопросов, начиная от экологии и гидрологии до геохимии и реконструкций палеоклимата. Поскольку для измерения соотношений изотопов природного водорода требуются специальные методы, область биогеохимии изотопов водорода предоставляет уникальные специализированные инструменты для более традиционных областей, таких как экология и геохимия.
Изучение стабильных изотопов водорода началось с открытия дейтерия химиком Гарольдом Юри в знаменитом эксперименте Юри и Миллера. Несмотря на то, что нейтрон не был реализован до 1932 года, Юри начал поиск «тяжелого водорода» в 1931 году. Юри и его коллега Джордж Мерфи вычислили красное смещение тяжелого водорода из серии Бальмера и наблюдали очень слабые линии при спектрографическом исследовании. Чтобы усилить спектральные линии для публикуемых данных, Мерфи и Юри объединились с Фердинандом Брикведде и дистиллировали более концентрированный пул тяжелого водорода, известного сегодня как дейтерий. Эта работа по изотопам водорода принесла Юри Нобелевскую премию по химии 1934 года.
 Гарольд Юри, чья новаторская работа по изотопам водорода принесла ему Нобелевскую премию по химии 1934 года.
Гарольд Юри, чья новаторская работа по изотопам водорода принесла ему Нобелевскую премию по химии 1934 года. Также в 1934 году ученые Эрнест Резерфорд, Марк Олифант и Пол Хартек произвели радиоактивный изотоп трития, поразив дейтерий ядрами высокой энергии. Дейтерий, использованный в эксперименте, был щедрым подарком тяжелой воды от физика из Беркли Гилберта Н. Льюиса. Бомбардировка дейтерия произвела два ранее необнаруженных изотопа, гелий-3 и водород-3. Резерфорд и его коллеги успешно создали тритий, но ошибочно предположили, что гелий-3 был радиоактивным компонентом. Работа Луиса Вальтера Альвареса и Роберта Корнога впервые выделила тритий и опровергла неверное представление Резерфорда. Альварес предположил, что тритий является радиоактивным, но не измерил период полураспада, хотя расчеты в то время предполагали более десяти лет. В конце второй мировой войны, то физикохимик Уиллард Либби обнаружена остаточная радиоактивность образца трития с счетчиком Гейгера, обеспечивая более точное представление о полужизни, в настоящее время принято на 12,3 лет.
Открытие изотопов водорода также повлияло на область физики в 1940-х годах, когда была впервые изобретена спектроскопия ядерного магнитного резонанса (ЯМР). Сегодня химики-органики используют ЯМР для картирования взаимодействий белков или идентификации небольших соединений, но ЯМР был первым увлечением физиков. Было обнаружено, что все три изотопа водорода обладают магнитными свойствами, подходящими для ЯМР-спектроскопии. Первым химиком, полностью описавшим применение ЯМР, был Джордж Пэйк, который измерил гипс () как кристалл и порошок. Наблюдаемый сигнал, названный дублетом Пейка, был от магнитоактивных водородов в воде. Затем Пэйк рассчитал расстояние протон-протонной связи. Дальнейшая революция в измерениях ЯМР произошла, когда в 1960-х годах стали доступны коммерческие машины. До этого эксперименты ЯМР включали в себя создание массивных объектов, обнаружение больших магнитов и ручную проводку миль медных катушек. Протонный ЯМР оставался самым популярным методом на протяжении последующих десятилетий, но дейтерий и тритий использовались в других разновидностях ЯМР-спектроскопии. Дейтерий имеет другой магнитный момент и спин, чем протий, но обычно имеет гораздо меньший сигнал. Исторически дейтериевый ЯМР - плохая альтернатива протонному ЯМР, но его использовали для изучения поведения липидов на мембранах. Недавно вариант дейтериевого ЯМР, названный 2 H-SNIF, показал потенциал для недооценки изотопных составов, специфичных для положения, и понимания путей биосинтеза. Тритий также используется в ЯМР, поскольку это единственное ядро, более чувствительное, чем протий, генерирующее очень большие сигналы. Однако радиоактивность трития препятствовала многим исследованиям Т-ЯМР.
Хотя радиоактивность трития не позволяет использовать его в спектроскопии, энергия распада необходима для ядерного оружия. Ученые начали понимать ядерную энергию еще в 1800-х годах, но большие успехи были сделаны в исследованиях атомной бомбы в начале 1940-х годов. Исследования военного времени, особенно Манхэттенский проект, значительно ускорили научное понимание радиоактивности. Тритий является побочным продуктом в реакторах, в результате удара литий-6 с нейтронами, производя почти 5 МэВ энергии.
 Фотография из проекта «Теплица» 1952 года, где было испытано первое ядерное оружие с реактивным двигателем.
Фотография из проекта «Теплица» 1952 года, где было испытано первое ядерное оружие с реактивным двигателем. В ядерном оружии с ускоренным делением смесь дейтерия и трития нагревается до тех пор, пока не произойдет термоядерное деление с образованием гелия и высвобождением свободных нейтронов. Затем поток быстрых нейтронных частиц вызовет дальнейшие реакции деления с ураном, создав "усиленную" ядерную бомбу. В 1951 году во время операции «Теплица» прототип по имени Джордж успешно подтвердил концепцию такого оружия. Тем не менее, первое настоящее ядерное устройство деления с форсированным двигателем, Greenhouse Item, было успешно испытано в 1952 году, получив 45,5 килотонн взрывоопасной мощности, что почти вдвое больше, чем у неусиленной системы. Соединенные Штаты прекратили производство трития в ядерных реакторах в 1988 году, но испытания ядерного оружия в 1950-х добавили в атмосферу большие выбросы радиоактивных элементов, особенно радиоуглерода и трития. Это сложные измерения для геологов с использованием радиометрического датирования углерода. Однако некоторые океанологи извлекли выгоду из увеличения содержания трития, используя сигнал в воде для отслеживания физического перемешивания водных масс.
В биогеохимии ученые сосредоточили свое внимание в первую очередь на стабильном изотопе дейтерия как индикаторе экологических процессов, особенно круговорота воды. Американский геохимик Хармон Крейг, когда-то аспирант университета Юри, обнаружил взаимосвязь между соотношением изотопов водорода и кислорода в дождевой воде. Линейная корреляция между двумя изотопами тяжелых сохраняются во всем мире и называется глобальной метеорными воды линии. К концу 1960-х годов изотопы водорода сместились с воды в сторону органических молекул. Растения используют воду для образования биомассы, но исследование 1967 года, проведенное Зебровски, Понтикорво и Риттенбергом, показало, что в органическом материале растений было меньше дейтерия, чем в источнике воды. В ходе исследования Зебровски была измерена концентрация дейтерия в жирных кислотах и аминокислотах, полученных из отложений в ходе проекта бурения на Мохоле. Дальнейшие исследования Брюса Смита и Сэмюэля Эпштейна в 1970 году подтвердили истощение дейтерия в органических веществах по сравнению с водой из окружающей среды. Другой дуэт в 1970 году, Шигль и Фогель, проанализировал состав изотопов водорода, когда вода превратилась в биомассу, когда биомасса превратилась в уголь и нефть, а когда нефть превратилась в природный газ. На каждом этапе они обнаруживали, что дейтерий еще больше истощался. Знаменательная статья 1980 года Мэрилин Эпстеп, ныне М. Фогель, и Томаса Херинга под названием «Биогеохимия стабильных изотопов водорода» уточнила связи между органическими материалами и источниками.
На этом раннем этапе изучения стабильных изотопов водорода большинство изотопных составов или фракций были зарегистрированы как объемные измерения всего органического материала или всего неорганического материала. Некоторые исключения включают целлюлозу и метан, поскольку эти соединения легко разделяются. Еще одно преимущество метана для конкретных измерений соединения - отсутствие водородного обмена. Целлюлоза имеет обменный водород, но химическая дериватизация может предотвратить замену водорода целлюлозы водой или минеральными источниками водорода. Исследования целлюлозы и метана в 1970-х и 1980-х годах установили стандарт современной геохимии изотопов водорода.
Измерения отдельных соединений стали возможными в конце 1990-х - начале 2000-х годов благодаря достижениям в масс-спектрометрии. Термо Delta + XL трансформировали измерения в качестве первого прибора, способного сложного анализа конкретных изотопов. Тогда появилась возможность смотреть на меньшие образцы с большей точностью. Применение изотопов водорода быстро появилось в нефтяной геохимии за счет измерения нефти, палеоклиматологии путем наблюдения за липидными биомаркерами и экологии за счет построения трофической динамики. Современные достижения в изучении изотопного состава слипшихся частиц метана после разработки карбонатного термометра. Точные измерения также позволяют сосредоточить внимание на путях микробного биосинтеза с участием водорода. Экологов, изучающих трофические уровни, особенно интересуют комплексные измерения для построения прошлых рационов и отслеживания отношений хищник-жертва. Высокотехнологичные аппараты в настоящее время занимают многообещающую позицию для анализа биомолекул и природного газа на основе изотопов водорода.
Все изотопы химического элемента содержат одинаковое количество протонов с различным количеством нейтронов. Элемент водород имеет три встречающихся в природе изотопа, 1 H, 2 H и 3 H, которые иногда называют протий (H), дейтерий (D) и тритий (T) соответственно. И 1 H, и 2 H стабильны бесконечно, в то время как 3 H нестабильно и подвергается бета-распаду с образованием 3 He. Хотя есть некоторые важные применения 3 H в геохимии (например, его использование в качестве индикатора циркуляции океана ), они здесь не обсуждаются.
Изучение биогеохимии стабильных изотопов включает описание относительного содержания различных изотопов в определенном химическом пуле, а также того, как физико-химические процессы изменяют долю этих изотопов в одном пуле по сравнению с другим. Для описания содержания и изменения содержания изотопов в этих процессах были разработаны различные типы обозначений, которые кратко излагаются ниже. В большинстве случаев интерес представляют только относительные количества изотопа, абсолютная концентрация любого изотопа не имеет большого значения.
Наиболее фундаментальное описание изотопов водорода в системе - это относительное содержание дейтерия и протия. Это значение может быть представлено как отношение изотопов 2 R или относительное содержание 2 F, определяемое как:
а также
где 2 H и 1 H - количества дейтерия и протия соответственно. Дробное содержание эквивалентно молярной доле и дает атомный процент при умножении на 100. В некоторых случаях используется избыток в атомных процентах, который показывает атомный процент образца минус атомный процент стандарта.
Изотопные отношения для данного вещества часто сравниваются со стандартом с известным изотопным составом, а измерения относительных масс всегда производятся вместе с измерением стандарта. В случае водорода используется стандарт Венской стандартной воды в океане с изотопным соотношением 155,76 ± 0,1 ppm. Значение дельты по сравнению с этим стандартом определяется как:
Эти значения дельты часто довольно малы и обычно указываются в процентах на милю (), которые получаются путем умножения приведенного выше уравнения на коэффициент 1000.
Изучение биогеохимии изотопа водорода основывается на том факте, что различные физико-химические процессы преимущественно обогащают или истощают дейтерий по сравнению с протием (см. Кинетический изотопный эффект и т. Д.). Для описания фракционирования изотопа между двумя пулами, часто продуктом и реагентом физико-химического процесса, были разработаны различные меры. Обозначение α описывает разницу между двумя пулами водорода A и B следующим уравнением:
где δ 2 H A - значение дельты пула A относительно VSMOW. Поскольку многие значения дельты не сильно отличаются друг от друга, значение α часто очень близко к единице. Часто используется связанная мера, называемая эпсилон (ε), которая задается просто:
Эти значения часто очень близки к нулю и сообщаются как значения на миллиметр путем умножения α-1 на 1000. Последний показатель - Δ, произносится как «cap delta», что просто:
Как обсуждалось выше, дейтерий и протий являются стабильными изотопами, которые никогда не подвергаются радиоактивному распаду. Следовательно, соотношение D / H в пуле, содержащем водород, будет оставаться постоянным до тех пор, пока водород не добавляется или не удаляется из системы, свойство, известное как сохранение массы. Когда два пула водорода A и B смешиваются с молярными количествами водорода m A и m B, каждый со своим начальным относительным содержанием дейтерия (F A и F B), то относительное содержание полученной смеси определяется следующим образом: точное уравнение:
Члены со знаком Σ представляют значения для объединенных пулов. Часто для расчетов смешения двух пулов с известным изотопным составом используется следующее приближение:
Это приближение удобно и с небольшой погрешностью применимо в большинстве приложений, имеющих дело с пулами водорода, образующимися в результате естественных процессов. Максимальная разница между рассчитанным значением дельты с приближенным и точным уравнениями определяется следующим уравнением:
Эта ошибка довольно мала для почти всех смешанных значений встречающихся в природе изотопов, даже для водорода, который может иметь довольно большие естественные вариации в значениях дельты. Оценки обычно избегают, когда встречаются неестественно большие значения изотопной дельты, что особенно часто встречается в экспериментах по изотопному мечению.
Естественные процессы приводят к широким вариациям в соотношении D / H, обнаруживаемых в различных резервуарах водорода. К наблюдаемым вариациям приводят кинетические изотопные эффекты и физические изменения, такие как осадки и испарение. Уровень воды в океане незначительно колеблется, от 0 до -10 промилле, в то время как атмосферная вода может варьироваться от примерно -200 до +100 промилле. Биомолекулы, синтезируемые организмами, сохранят некоторую характеристику D / H воды, на которой они были выращены, плюс большой коэффициент фракционирования, который может достигать нескольких сотен промилле. Большие различия D / H, составляющие тысячи промилле, могут быть обнаружены между Землей и другими планетными телами, такими как Марс, вероятно, из-за различий в фракционировании изотопов во время формирования планет и физической потери водорода в космос.
Ряд общих процессов фракционируют изотопы водорода для получения изотопных вариаций, встречающихся в природе. Общие физические процессы включают осадки и испарение. Химические реакции также могут сильно повлиять на распределение тяжелых и легких изотопов между пулами. Скорость химической реакции частично зависит от энергии химических связей, которые образуются и разрываются в ходе реакции. Поскольку разные изотопы имеют разные массы, энергии связи между разными изотопологами одного химического вещества различаются. Это приведет к различию в скорости реакции для разных изотопологов, что приведет к фракционированию различных изотопов между реагентом и продуктом в химической реакции. Это известно как кинетический изотопный эффект. Классическим примером такого изотопного эффекта является разница в соотношении D / H в равновесии между H 2 O и H 2, которая может иметь значение альфа до 3–4.
Во многих областях исследований центральное значение имеет происхождение химического вещества или группы химических веществ. Такие вопросы, как источник загрязнителей окружающей среды, происхождение гормонов в организме спортсмена или подлинность пищевых продуктов и ароматизаторов, - все это примеры, когда необходимо идентифицировать и получать химические соединения. Изотопы водорода нашли применение в этих и многих других областях исследований. Поскольку многие процессы могут влиять на соотношение D / H данного химического соединения, это соотношение может быть диагностической сигнатурой для соединений, произведенных в определенном месте или посредством определенного процесса. Как только отношения D / H ряда источников известны, измерение этого отношения для образца неизвестного происхождения часто может использоваться, чтобы связать его с определенным источником или методом производства.
Протий, или водород-1, с одним протоном и без нейтронов, является наиболее распространенным элементом в солнечной системе, образовавшимся в самых первых раундах звездных взрывов после Большого взрыва. После того, как Вселенная зародилась, горячее и плотное облако частиц начало охлаждаться, сначала образовав субатомные частицы, такие как кварки и электроны, которые затем конденсировались, образуя протоны и нейтроны. Элементы более крупные, чем водород и гелий, были образованы последовательными звездами, образовавшимися из энергии, выделяющейся во время сверхновых.
Известно также, что дейтерий или водород-2 с одним протоном и одним нейтроном имеет космическое происхождение. Как и протий, дейтерий был произведен очень рано в истории Вселенной во время нуклеосинтеза Большого взрыва. Когда протоны и нейтроны объединились, гелий-4 был произведен с промежуточным продуктом дейтерия. Альфа-реакции с гелием-4 производят многие из более крупных элементов, которые доминируют в сегодняшней Солнечной системе. Однако до того, как Вселенная остыла, фотоны высокой энергии разрушили дейтерий, предотвратив образование более крупных элементов. Это называется узким местом дейтерия, ограничением сроков нуклеосинтеза. Весь сегодняшний дейтерий возник в результате этого протон-протонного синтеза после достаточного охлаждения.
Тритий, или водород-3, с одним протоном и двумя нейтронами, также был произведен столкновениями протонов и нейтронов в ранней Вселенной, но с тех пор он радиоактивно распался до гелия-3. Современный тритий не может быть объяснен нуклеосинтезом Большого взрыва из-за короткого периода полураспада трития, составляющего 12,3 года. Вместо этого сегодняшняя концентрация трития определяется ядерными реакциями и космическими лучами. Радиоактивный бета-распад трития до гелия высвобождает электрон и антинейтрино со средним выделением энергии 18,6 МэВ. Важно отметить, что это относительно слабая бета-реакция, поэтому радиоактивность не может проникать через кожу. Таким образом, тритий опасен только при прямом проглатывании или вдыхании.
Протий - субатомная частица со спином 1/2 и, следовательно, фермион. Другие фермионы включают нейтроны, электроны и радиоактивный изотоп трития. Фермионы подчиняются принципу исключения Паули, согласно которому никакие две частицы не могут иметь одинаковое квантовое число. Однако бозоны, такие как дейтерий и фотоны, не связаны запретом, и несколько частиц могут занимать одно и то же энергетическое состояние. Это фундаментальное различие между 1 H и 2 H проявляется во многих физических свойствах. Частицы с целочисленным спином, такие как дейтерий, следуют статистике Бозе-Эйнштейна, а фермионы с полуцелым спином следуют статистике Ферми-Дирака. Волновые функции, описывающие множественные фермионы, должны быть антисимметричными по отношению к перестановкам частиц, в то время как волновые функции бозонов должны быть симметричными. Поскольку бозоны неразличимы и могут находиться в одном и том же состоянии, наборы бозонов ведут себя совсем иначе, чем фермионы, при более низких температурах. Когда бозоны охлаждаются и релаксируют до состояния с наименьшей энергией, возникают такие явления, как сверхтекучесть и сверхпроводимость.
Изотопы различаются по количеству нейтронов, которое напрямую влияет на физические свойства, основанные на массе и размере. Типичный водород называется водород-1 или протий и не имеет нейтронов. Дейтерий или водород-2 имеет один нейтрон, а тритий или водород-3 имеют два нейтрона. Эти дополнительные нейтроны значительно влияют на массу элемента, что приводит к различным химико-физическим свойствам. Этот эффект особенно распространен в изотопах водорода, поскольку добавление нейтрона удваивает массу протия до дейтерия. Для элементов более высокого порядка, таких как углерод, кислород, азот или сера, разница масс уменьшается.
Физические химики часто моделируют связь с квантовым гармоническим осциллятором, упрощая водородно-водородную связь как два шара, соединенных пружиной. Квантовый гармонический осциллятор основан на законе Гука и действует как хорошее приближение к потенциалу Морзе, который точно описывает связь. Моделирование водорода и дейтерия в химической реакции демонстрирует энергетическое распределение изотопов в продуктах и реагентах. Более низкие уровни энергии для более тяжелого изотопа дейтерия можно математически объяснить зависимостью гармонического осциллятора от величины, обратной приведенной массе, обозначенной μ. Таким образом, большая приведенная масса является большим знаменателем и, следовательно, меньшей энергией нулевой точки и более низким энергетическим состоянием в квантовой яме.
 Упрощенная модель химической реакции с путями прохождения изотопов водорода и D. Положения энергетических ям основаны на квантовом гармоническом осцилляторе. Обратите внимание на более низкое энергетическое состояние более тяжелого изотопа и более высокое энергетическое состояние более легкого изотопа. В условиях равновесия в продуктах отдается предпочтение тяжелому изотопу, поскольку он более стабилен. В кинетических условиях, таких как ферментативная реакция, предпочтение отдается более легкому изотопу из-за более низкой энергии активации.
Упрощенная модель химической реакции с путями прохождения изотопов водорода и D. Положения энергетических ям основаны на квантовом гармоническом осцилляторе. Обратите внимание на более низкое энергетическое состояние более тяжелого изотопа и более высокое энергетическое состояние более легкого изотопа. В условиях равновесия в продуктах отдается предпочтение тяжелому изотопу, поскольку он более стабилен. В кинетических условиях, таких как ферментативная реакция, предпочтение отдается более легкому изотопу из-за более низкой энергии активации. Эффекты этого распределения энергии проявляются в кинетическом изотопическом эффекте и равновесном изотопном эффекте. В обратимой реакции, в условиях равновесия, реакция будет идти вперед и назад, распределяя изотопы для минимизации термодинамической свободной энергии. Некоторое время спустя, при достижении равновесия, на стороне продукта будет больше тяжелых изотопов. Стабильность более низкой энергии заставляет продукты обогащаться дейтерием по сравнению с реагентами. И наоборот, в кинетических условиях реакции обычно необратимы. Лимитирующая стадия в реакции является преодоление энергии активации барьера, чтобы достичь промежуточного состояния. Более легкий изотоп имеет более высокое энергетическое состояние в квантовой яме и, таким образом, будет предпочтительно превращаться в продукты. Таким образом, в кинетических условиях продукт будет относительно обеднен дейтерием.
Кинетические изотопные эффекты распространены в биологических системах и особенно важны для биогеохимии изотопов водорода. Кинетические эффекты обычно приводят к большему фракционированию, чем равновесные реакции. В любой изотопной системе кинетические эффекты тем сильнее, чем больше разница масс. Легкие изотопы в большинстве систем также имеют тенденцию двигаться быстрее, но образуют более слабые связи. При высоких температурах энтропия объясняет большой сигнал в изотопном составе. Однако при понижении температуры изотопные эффекты становятся более выраженными, а случайность играет меньшую роль. Эти общие тенденции раскрываются при дальнейшем понимании разрыва связей, диффузии или излияния, а также реакций конденсации или испарения.
Одной из основных сложностей при изучении изотопов водорода является вопрос обмениваемости. Во многих временных масштабах, от часов до геологических эпох, ученые должны учитывать, являются ли водородные фрагменты в исследуемых молекулах исходными видами или они представляют собой обмен с водой или находящимся поблизости минеральным водородом. Исследования в этой области по-прежнему не позволяют сделать окончательных выводов в отношении скорости обмена, но, как правило, считается, что водородный обмен затрудняет сохранение информации при изучении изотопов.
Атомы водорода легко отделяются от электроотрицательных связей, таких как гидроксильные связи (ОН), азотные связи (NH) и тиол / меркаптосвязи (SH) в период от часа до дня. Такой быстрый обмен особенно проблематичен при измерениях объемного органического материала с этими функциональными группами, поскольку изотопный состав с большей вероятностью отражает исходную воду, а не изотопный эффект. По этой причине записи палеоклимата, которые не измеряют древние воды, полагаются на другие изотопные маркеры. Достижения 1990-х годов открыли многообещающий потенциал для решения этой проблемы: образцы были уравновешены двумя вариантами тяжелой воды и сравнивались. Их отношения представляют собой коэффициент обмена, который позволяет калибровать измерения с поправкой на замену водорода и дейтерия.
В течение некоторого времени исследователи считали, что большие молекулы углеводородов непроницаемы для водородного обмена, но недавняя работа идентифицировала многие реакции, которые позволяют переупорядочивать изотопы. Изотопный обмен становится актуальным в геологических масштабах времени и повлиял на работу биологов, изучающих липидные биомаркеры, а также геологов, изучающих древнюю нефть. Реакции, ответственные за обмен, включают:
 Тенденция стабильности карбокатиона. Обратите внимание на эффекты стабилизации от соседних атомов углерода, которые отдают электроны положительному заряду. Противоположная тенденция наблюдается в стабильности карбанионов. В изотопах с большей вероятностью теряется связанный с третичным водородом, потому что образующийся карбокатион является наиболее стабильной разновидностью.
Тенденция стабильности карбокатиона. Обратите внимание на эффекты стабилизации от соседних атомов углерода, которые отдают электроны положительному заряду. Противоположная тенденция наблюдается в стабильности карбанионов. В изотопах с большей вероятностью теряется связанный с третичным водородом, потому что образующийся карбокатион является наиболее стабильной разновидностью. Детальная кинетика этих реакций не определена. Однако известно, что глинистые минералы катализируют ионный водородный обмен быстрее, чем другие минералы. Таким образом, углеводороды, образующиеся в кластических средах, обмениваются больше, чем в карбонатных средах. Ароматический и третичный водород также имеют более высокие скорости обмена, чем первичный водород. Это связано с повышением стабильности связанных карбокатионов. Первичные карбокатионы считаются слишком нестабильными для физического существования и никогда не выделялись в спектрометре FT-ICR. С другой стороны, третичные карбокатионы относительно стабильны и часто являются промежуточными продуктами в реакциях органической химии. Эта стабильность, которая увеличивает вероятность потери протонов, обусловлена донорством электронов соседними атомами углерода. Резонанс и близлежащие неподеленные пары также могут стабилизировать карбокатионы через донорство электронов. Таким образом, обмен ароматических углеродов относительно легко.
Многие из этих реакций имеют сильную температурную зависимость, при этом более высокие температуры обычно ускоряют обмен. Однако в каждом температурном окне могут преобладать разные механизмы. Ионный обмен, например, имеет наибольшее значение при низких температурах. В такой низкотемпературной среде существует потенциал для сохранения исходного сигнала изотопа водорода в течение сотен миллионов лет. Однако многие породы в геологическое время достигли значительной термической зрелости. Даже при появлении масляного окна кажется, что большая часть водорода обменялась. Недавно ученые исследовались серебряную подкладку: обмен водорода является кинетической реакцией нулевого порядка (для углерода связанного водорода при 80-100 ° С, половинные раз, скорее всего, 10 4 - 10 5 лет). Применение математики констант скорости позволило бы экстраполировать исходный изотопный состав. Хотя это решение является многообещающим, в литературе слишком много разногласий по поводу надежных калибровок.
Изотопные эффекты пара возникают для протия, дейтерия и трития, потому что каждый изотоп имеет разные термодинамические свойства в жидкой и газовой фазах. Для молекул воды конденсированная фаза более обогащена, а пар более обеднен. Например, дождь, конденсирующийся из облака, будет тяжелее, чем исходная точка пара. Как правило, большие колебания концентрации дейтерия в воде связаны с фракционированием между жидкими, паровыми и твердыми резервуарами. В отличие от модели фракционирования воды, неполярные молекулы, такие как масла и липиды, имеют газообразные аналоги, обогащенные дейтерием по сравнению с жидкостью. Считается, что это связано с полярностью водородных связей в воде, которая не влияет на длинноцепочечные углеводороды.
 Изотопный состав водорода гидро-, био- и геосфер
Изотопный состав водорода гидро-, био- и геосфер Из-за процессов физического и химического фракционирования сообщается об изменении изотопного состава элементов, а стандартные атомные веса изотопов водорода публикуются Комиссией по атомным весам и изотопному содержанию ИЮПАК. Отношения стабильных изотопов H указаны относительно эталонной воды Международного агентства по атомной энергии (МАГАТЭ). В равновесных изотопных реакциях водорода и дейтерия в целом наблюдается обогащение тяжелого изотопа в соединении с более высокой степенью окисления. Однако в нашей естественной среде изотопный состав изотопов водорода сильно различается в зависимости от источников и организмов из-за сложности взаимодействия элементов в неравновесных состояниях. В этом разделе описаны наблюдаемые вариации содержания изотопов водорода в водных источниках (гидросфера), живых организмах (биосфера), органических веществах (геосфера) и внеземных веществах в Солнечной системе.

Наблюдаются вариации значений δD различных источников воды и ледяных шапок из-за процессов испарения и конденсации. [См. Более подробную информацию в разделе 6] Когда вода в океане хорошо перемешана, δD в состоянии равновесия близко к 0 ‰ (‰ SMOW) с отношением D / H, равным 0,00015576. Однако непрерывные изменения значений δD вызваны процессами испарения или осаждения, которые приводят к нарушению равновесия в процессах фракционирования. Большой изотопный градиент H (вариации значений δD) наблюдается в поверхностных водах океанов, а величина колебаний в поверхностных водах Северо-Западной Атлантики составляет около 20 ‰. Согласно данным исследования южного суперсегмента Тихого океана, по мере того, как широта (˚S) уменьшается с -65˚S до -40˚S, значение δD колеблется в пределах от -50 ‰ до -70 ‰.
Изотопный состав морской воды (а не только поверхностных вод) в основном находится в диапазоне 0 - (- 10) ‰. Оценки значений δD для различных частей Мирового океана показаны на карте.

Типичные значения δD для ледяных щитов в полярных регионах находятся в диапазоне от -400 ‰ до -300 ‰ (SMOW). На значения δD ледяных шапок влияют расстояние от открытого океана, широта, атмосферная циркуляция, а также количество инсоляции и температура. Изменение температуры влияет на содержание дейтерия в ледяных шапках, поэтому изотопный состав льда H / D может дать оценки исторических климатических циклов, таких как временные рамки межледниковых и ледниковых периодов. [См. Раздел 7.2. Подробнее о палео-реконструкции]
Значения δD ледяных шапок в 70 км к югу от станции Восток и в Восточной Антарктиде составляют -453,7 ‰ и -448,4 ‰ соответственно и показаны на карте.

Анализ, проведенный на основе данных спутниковых измерений, позволяет оценить значения δD атмосферы в различных регионах мира. Общая тенденция состоит в том, что значения δD более отрицательны в регионах с более высокими широтами, поэтому атмосфера над Антарктидой и арктическими регионами, как наблюдается, сильно обеднена D до примерно от −230 ‰ до −260 ‰ или даже ниже.
Оценки атмосферных значений δD показаны на карте.
Подавляющая часть глобального атмосферного водяного пара поступает из западной части Тихого океана вблизи тропической зоны (среднее значение 2009 г.), и изотопный состав атмосферы H / D меняется в зависимости от температуры и влажности. Как правило, более высокие значения δD наблюдаются во влажных регионах с высокой температурой. Водяной пар в атмосфере, как правило, более обеднен, чем водные источники на Земле, поскольку скорость испарения на 1 час16 2O быстрее, чем 1 HD 16 O из-за более высокого давления пара. С другой стороны, дождевая вода (осадки) в целом более богата, чем атмосферный водяной пар.

На карте показаны значения δD годовых осадков в разных регионах мира. Осадки более богаты D вблизи экватора в тропических регионах. Значения δD обычно лежат в диапазоне от -30 до -150 ‰ в северном полушарии и от -30 до + 30 ‰ над сушей в южном полушарии. В Северной Америке значения δD среднемесячных осадков по регионам более отрицательны в январе (примерно до –300 ‰ в Канаде) по сравнению с июлем (примерно до –190 ‰).
Общее среднее количество осадков определяется балансом между испарением воды из океанов и поверхностных источников воды и конденсацией атмосферного водяного пара в виде дождя. Чистое испарение должно равняться чистому количеству осадков, а значение δD для среднего изотопного состава глобальных осадков составляет около -22 ‰ (глобальное среднее). Глобальная сеть изотопов в осадках (GNIP) исследует и отслеживает изотопный состав осадков в различных местах по всему миру. Среднее количество осадков можно оценить по уравнению, δ 2 H = 8,17 (± 0,07) δ 18 O + 11,27 (± 0,65) VSMOW. (Розанское и др., 1993) Это уравнение представляет собой слегка модифицированный вариант от общего «Глобальной Метеорной ватерлинии (GMWL)» уравнения, δ 2 H = 8.13δ 18 O + 10.8, который обеспечивает среднее соотношение между amp; delta ; 2 H и δ 18 O природных наземных вод.

На карте показаны зависимости δD от VSMOW озер в разных регионах. Наблюдаемая общая картина показывает, что значения δD поверхностных вод, включая озера и реки, аналогичны значениям для местных осадков.
Изотопный состав почвы контролируется поступлением атмосферных осадков. Следовательно, значения δD почвы по регионам аналогичны значению местных осадков. Однако из-за испарения почва имеет тенденцию быть более обогащенной D, чем осадки. Степень обогащения сильно варьируется в зависимости от влажности воздуха, местной температуры, а также глубины почвы под поверхностью. Согласно исследованию, проведенному Meinzer et al. (1999), по мере увеличения глубины почвы δD почвенной воды уменьшается.
| Источник | δD | Ссылка |
|---|---|---|
| Поверхность океана | От −70 ‰ до −50 ‰ | Clog et al. (2013) |
| Глубокий океан | От −10 ‰ до 0 ‰ | Энглебрехт и Сакс (2005) |
| Ледяные шапки | От −450 ‰ до −300 ‰ | Lecuyer et al. (1998), Masson-Delmotte et al. (2008) |
| Атмосфера | От −260 ‰ до −80 ‰ | Франкенберг и др. (2009) |
| Осадки | От −270 ‰ до + 30 ‰ | waterisotopes.org |
| Озера | От −130 ‰ до + 50 ‰ | Sachse et al. (2012) |
| Почвенная вода | От −270 ‰ до + 30 ‰ | waterisotopes.org |
Факторы, влияющие на значения δD липидов водорослей, следующие: δD воды, виды водорослей (до 160%), тип липидов (до 170%), соленость (+ 0,9 ± 0,2% на PSU), скорость роста (0 ~ -30% в день) и температуры (-2 ~ -8% на ° C).
В исследовании, проведенном Zhang et al. (2009), значения δD жирных кислот в культурах хемостата Thakassiosira pseudonana составляли −197,3 ‰, −211,2 ‰ и −208,0 для жирных кислот C14, C16 и C18 соответственно. Кроме того, величина δD жирной кислоты C16 у вида водорослей, названного AE unicocca, при 25 ° C была определена с использованием эмпирического уравнения y = 0,890x - 91,730, где x - это δD воды при сборе урожая. Для другого вида водорослей, названного BV aureus, уравнение было y = 0,869x -74,651.
Степень фракционирования D / H в большинстве липидов водорослей увеличивается с повышением температуры и уменьшается с увеличением солености. Скорости роста по-разному влияют на фракционирование D / H в зависимости от типов видов.
Значения δD липидов фитопланктона в значительной степени зависят от δD воды, и, похоже, существует линейная корреляция между этими двумя значениями. ΔD большинства других продуктов биосинтеза, обнаруженных в фитопланктоне или цианобактериях, более отрицательны, чем у окружающей воды. Значения δD жирных кислот у метанотрофов, обитающих в морской воде, находятся в диапазоне от –50 до –170 ‰, а значения δD стеринов и гопанолов - от –150 до –270.
Изотопный состав H фотоавтотрофов можно оценить с помощью следующего уравнения:
где R 1, R w и R s - отношения D / H липидов, воды и субстратов соответственно. X w - мольная доля липида H, полученного из внешней воды, тогда как α l / w и α l / s обозначают чистые изотопные фракции, связанные с поглощением и использованием воды и водорода в субстрате, соответственно.
Для фототрофов, R л вычисляется в предположении, что X ш равна 1. изотопное фракционирование между липидами и метана ( α л / м) составляет 0,94 для жирных кислот и 0,79 для изопреноидных липидов. Изотопное фракционирование между липидами и водой ( α l / w) составляет 0,95 для жирных кислот и 0,85 для изопреноидных липидов. Для растений и водорослей изотопное фракционирование между липидами и метаном ( α л / м) составляет 0,94 для жирных кислот и 0,79 для изопреноидных липидов.

Значения δD для алкана nC 29 () в сравнении с VSMOW для различных групп растений следующие. В уравнениях y представляет значения δD для алкана nC 29 () по сравнению с VSMOW, а x представляет значения δD для среднегодовых осадков () по сравнению с VSMOW).
| Группа заводов | Уравнение для оценки δD |
|---|---|
| Кустарники | у = 0,867х - 112 |
| Деревья | у = 0,524х - 134 |
| Форбс | y = 1,158x - 120 |
| C3 злаки | у = 1,209х - 129 |
| C4 злаки | у = 0,777х - 142 |
Для воска листьев растений относительная влажность, время образования воска листьев и условия роста, включая уровень освещенности, влияют на фракционирование D / H воска растений. Из модели Крейга-Гордона можно понять, что листовая вода в газах камеры роста значительно обогащена D из-за транспирации.
Относительное глобальное содержание D в растениях находится в следующем порядке: фенилпропаноиды gt; углеводы gt; сыпучий материалgt; гидролизуемые липидыgt; стероиды. У растений значения δD углеводов, которые обычно находятся в диапазоне от -70 ‰ до -140 ‰, являются хорошими индикаторами фотосинтетического метаболизма. Фотосинтетически произведенные водороды, которые связаны с углеродными скелетами, обеднены примерно на 100–170 ‰ D больше, чем вода, содержащаяся в тканях растений.
Гетеротрофная переработка углеводов включает изомеризацию из триозов фосфатов и взаимопревращения между фруктозо-6-фосфатом и глюкозо-6-фосфатом. Эти клеточные процессы способствуют обмену между органическими H и H 2 O в тканях растений, что приводит к примерно 158% D-обогащению этих участков обмена. ΔD растений C3, таких как сахарная свекла, апельсин и виноград, колеблется от -132 ‰ до -117 ‰, а δD растений C4, таких как сахарный тростник и кукуруза, колеблется от -91 ‰ до -75 ‰. Значение δD САМ, такого как ананас, оценивается примерно в -75 ‰. Сахарная свекла и сахарный тростник содержат сахарозу, а кукуруза - глюкозу. Апельсин и ананас - источники глюкозы и фруктозы.
Содержание дейтерия в сахарах вышеуказанных видов растений не отличается. В растениях C3 водороды, присоединенные к атомам углерода в 4 и 5 положениях глюкозы, обычно поступают из НАДФН в пути фотосинтеза и, как было обнаружено, более обогащены D. В то время как в растениях C4 водороды, присоединенные к положениям атомов углерода 1 и 6, более D-обогащены. Паттерны D-обогащения у CAM-видов, как правило, ближе к таковым у C3-видов.
Изотопный состав H / D воды листа меняется во время биосинтеза, и обогащение всего листа можно описать уравнением △ D leaf = △ D e * ((1-e −p) / P)
Типичное значение δD для массового производства составляет около -160, тогда как значения δD для целлюлозы и лигнина составляют -110 ‰ и -70 ‰ соответственно.
Изотопный состав водорода в тканях животных трудно оценить из-за сложности рациона и изотопного состава окружающих источников воды. Когда исследовались виды рыб, средний изотопный состав водорода белков находился в широком диапазоне от –128 ‰ ~ +203. Было обнаружено, что в основной ткани организмов все липиды обеднены D, и значения δD для липидов имеют тенденцию быть ниже, чем для белков. Среднее значение δD для хирономид и рыбьего белка оценивается в диапазоне от –128 ‰ до + 203 ‰.
Большинство водородов в гетеротрофных тканях поступает из воды, а не из диетических источников, но их доля из воды варьируется. Как правило, водород из воды передается НАДФН, а затем попадает в ткани. Очевидный трофический эффект (эффект компаундирования) можно наблюдать для δD у гетеротрофов, поэтому значительное обогащение D происходит в результате поглощения окружающей воды в водных пищевых сетях. В некоторых случаях на δD белков в тканях животных больше влияют источники питания, чем окружающая вода.
Хотя разные значения δD для одного и того же класса соединений могут возникать у разных организмов, растущих в воде с одинаковым значением δD, эти соединения обычно имеют одинаковое значение δD внутри каждого организма. [См. Раздел 7.5. Подробнее об экологии]
Значения δD жирных кислот, обнаруженных в живых организмах, обычно находятся в диапазоне от -73 ‰ до -237 ‰. Значения δD для отдельных жирных кислот широко варьируются между культурами (от -362 ‰ до + 331 ‰), но обычно менее чем примерно на 30 ‰ между разными жирными кислотами одного и того же вида.
Различия в δD для соединений одного и того же класса липидов обычно меньше 50, тогда как разница находится в диапазоне 50–150 ‰ для соединений из разных классов липидов.
Значения δD для типичных липидных групп определяются с использованием следующего уравнения:
Полиизопреноидные липиды более обеднены, чем ацетогенные (н-алкильные) липиды с более отрицательными значениями δD.
| Тип | Источник | δD | Ссылка |
|---|---|---|---|
| Липид | Морские отложения | От −470 ‰ до −30 ‰ | Zhang et al. (2008) |
| Морские водоросли | От −211 ‰ до −197 ‰ | Zhang et al. (2008) | |
| Метанотрофы | От −170 ‰ до −50 ‰ | Сеансы (2002) | |
| Гетеротрофы | Обогащение от −50 ‰ до + 200 ‰ по отношению к воде | Zhang et al. (2008) | |
| Фотоавтотрофы | Обогащение от + 50 ‰ до + 190 ‰ по отношению к воде | Zhang et al. (2008) | |
| Растения | От −270 ‰ до −120 ‰ | Sachse et al. (2012) | |
| Сахар | Углеводы | От −140 ‰ до −70 ‰ | Schmidt et al. (2003) |
| C3 растения | От −132 ‰ до −117 ‰ | Schmidt et al. (2003) | |
| C4 растения | От −91 ‰ до −75 ‰ | Schmidt et al. (2003) | |
| САМ | около −75 ‰ | Schmidt et al. (2003) | |
| Масса | Растения | около −160 ‰ | Schmidt et al. (2003) |
| Животные (например, рыба) | От −128 ‰ до + 203 ‰ | Soto et al. (2013) |
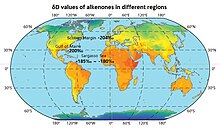
Изотопный состав алкенонов часто отражает изотопное обогащение или истощение окружающей среды, а значения δD алкенонов в различных регионах показаны на карте.

Согласно исследованиям, проведенным Reddings et al., ΔD для углей из различных источников колеблется от -90 ‰ до -170 ‰.
На карте показаны значения δD углей в разных регионах.
Метан, произведенный из морских метаногенов, обычно более обогащен D, чем метан, произведенный из метаногенов, выращенных в пресной воде. Значения δD для термогенного метана колеблются от -275 ‰ до -100 ‰ и от -400 ‰ до -150 ‰ для микробного метана.
Значение δD, наблюдаемое для атмосферного H 2, составляет около + 180 ‰, что является самым большим значением дельты, наблюдаемым для естественных наземных источников. (Мольная доля 2 H: 0,0001838) Значение δD для природного газа из скважины в Канзасе составляет около -836 ‰ (мольная доля дейтерия составляет 0,0000255). В процессе электролиза воды на катоде образуется газообразный водород, но неполный электролиз воды может вызвать изотопное фракционирование, ведущее к обогащению D в пробе воды и образованию газообразного водорода с компонентами дейтерия.
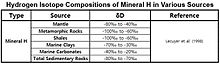
Значения δD гидроксилсодержащих минералов мантии были оценены как -80 ‰ ~ -40 ‰ на основе анализа изотопного состава ювенильной воды. Водородные минералы обычно обладают значительными изотопными эффектами, и изотопный состав часто соответствует образцу, наблюдаемому для осадков.
Фракции D / H в глинах, таких как каолинит, иллит, смектит, в большинстве случаев стабильны, если не действуют значительные внешние силы при постоянной температуре и давлении.
Ниже приведено эмпирически определенное уравнение для оценки коэффициента фракционирования D / H: 1000 In α каолинит-вода = -2,2 × 10 6 × T −2 - 7,7.
Значения δD в зависимости от ‰ SMOW для водородных минералов, обнаруженных в мантии, метаморфических породах, сланцах, морских глинах, морских карбонатах и осадочных породах, показаны в таблице.
| Источник | δD | Ссылка |
|---|---|---|
| Масло | От −135 ‰ до −90 ‰ | Васеда (1993), душ Сантуш Нету и Хейс (1999) |
| Алкеноны | От −204 ‰ до −181 ‰ | Энглебрехт и Сакс (2005) |
| Угли | От −170 ‰ до −50 ‰ | Реддинг (1980), Ригби и Смит (1981), Смит (1983) |
| Природный газ (метан) | От −400 ‰ до −100 ‰ | Whiticar (1999) |
| H 2 газ | От −836 ‰ до + 180 ‰ | Hoefs (2009) |
| Минерал H | От −100 ‰ до −20 ‰ | Lecuyer et al. (1998) |
Вариации отношения D / H в солнечной системе
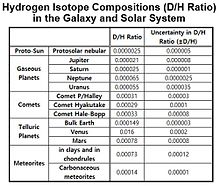
Отношения D / H для Юпитера и Сатурна почти составляют порядка 10 −5, а отношения D / H Урана и Нептуна ближе к порядку 10 −4.
Водород - самый распространенный элемент во Вселенной. Вариации изотопного состава внеземных материалов происходят из-за планетарной аккреции или других планетарных процессов, таких как атмосферный выброс, и они больше для H и N, чем для C и O. Сохранение D-обогащения наблюдается в хондритовых метеоритах, частицах межпланетной пыли и кометах. летучие вещества.
Исходя из данных о содержании изотопа гелия, значение космического D / H оценивается примерно в 20 ppm, что намного ниже земного отношения D / H, равного 150 ppm. Обогащение D / H из протосолнечного резервуара происходит для большинства планет, за исключением Юпитера и Сатурна, массивных газообразных планет. Отношения D / H атмосфер Венеры и Марса составляют ~ 2 10 −2 и ~ 8 10 −4 соответственно. Отношение D / H Урана и Нептуна примерно в 3 раза больше, чем у протосолнечного резервуара, из-за их ледяных ядер, богатых дейтерием. Отношения D / H для комет намного больше, чем значения для планет Солнечной системы со значением δD около 1000 ‰.
Изотопный состав водорода в галактике и Солнечной системе представлен в таблице.
Определение отношения D / H может быть выполнено с помощью комбинации различных методов подготовки и инструментов для разных целей. Существует несколько основных категорий измерений изотопов водорода: (i) органический водород или вода сначала преобразуются в H 2, а затем проводится высокоточное измерение IRMS ( масс-спектрометрия изотопного отношения ) с высокой точностью; (ii) D / H и 18 O / 16 O непосредственно измеряются как H 2 O с помощью лазерной спектроскопии, также с высокой точностью; (iii) неповрежденные молекулы непосредственно измеряются с помощью ЯМР или масс-спектрометрии с относительно более низкой точностью, чем IRMS.
Преобразование в простые молекулы (например, H 2 для водорода) требуется до измерения IRMS для стабильных изотопов. В отношении водорода это связано с несколькими причинами:
Классической автономной подготовкой к конверсии является сжигание над CuO приgt; 800 ° C в герметичных кварцевых трубках с последующим выделением образующейся воды и восстановлением до H 2 над чугунным металлом при 400 ~ 1000 ° C на вакуумной линии. Затем полученный газ напрямую вводится в масс-спектрометр с двойным входом для измерения. Металлы, используемые для восстановления до H 2, включают U, Zn, Cr, Mg и Mn и т. Д. U и Zn широко использовались с 1950-х годов, пока Cr не был успешно использован в конце 1990-х годов.
Автономное сжигание / восстановление имеет высочайшую точность и прецизионность для измерения изотопов водорода без ограничений для типов проб. Аналитическая неопределенность обычно составляет 1 ~ 2 ‰ в δD. Таким образом, он все еще используется сегодня, когда требуется высочайший уровень точности. Однако процедура офлайн-подготовки очень трудоемка и сложна. Также требуется большой размер образца (несколько 10 2 мг). Таким образом, в настоящее время более широко используется онлайн-подготовка, основанная на сжигании / восстановлении в сочетании с последующей системой непрерывного потока-IRMS (CF-IRMS). Восстановление хрома или высокотемпературное преобразование являются доминирующими онлайн-методами получения для обнаружения изотопа водорода с помощью IRMS.
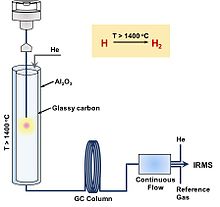 Принципиальная схема TC / EA-IRMS и принцип обнаружения изотопов водорода TC / EA
Принципиальная схема TC / EA-IRMS и принцип обнаружения изотопов водорода TC / EA TC / EA (или HTC, высокотемпературная конверсия; HTP, высокотемпературный пиролиз ; HTCR, высокотемпературное восстановление углерода) - это метод подготовки «в режиме онлайн» или «непрерывный поток», за которым обычно следует обнаружение IRMS. Это «объемный» метод, который измеряет весь водород в данном образце и обеспечивает средний изотопный сигнал. Взвешенный образец помещается в оловянную или серебряную капсулу и опускается в трубку для пиролиза TC / EA. Трубка сделана из стеклоуглерода с наполнителем из стеклоуглерода, что позволяет одновременно измерять изотоп кислорода без кислородного обмена с керамической (Al 2 O 3) поверхностью. Затем молекулы восстанавливаются до CO и H 2 при высокой температуре (gt; 1400 ° C) в реакторе. Газообразные продукты разделяют с помощью газовой хроматографии (ГХ) с использованием гелия в качестве газа-носителя, затем разделяют на границе раздела потоков и, наконец, обнаруживают с помощью IRMS. Метод TC / EA может быть проблематичным для органических соединений с галогеном или азотом из-за конкуренции между побочными продуктами пиролиза (например, HCl и HCN) и образованием H 2. Кроме того, он подвержен загрязнению водой, поэтому образцы необходимо тщательно высушивать.
Адаптация этого метода заключается в определении необмениваемого (CH) и обмениваемого водорода (связанного с другими элементами, например, O, S и N) в органическом веществе. Образцы уравновешивают водой в герметичных каруселях автосэмплера при 115 ° C, а затем переносят в пиролизный EA с последующим измерением IRMS.
Метод TC / EA быстрый с относительно высокой точностью (~ 1). Это было ограничено твердыми образцами, однако в последнее время жидкие образцы также можно измерять в системе TC / EA-IRMS, адаптировав автоматический пробоотборник для жидкостей. Недостатком TC / EA является относительно большой размер образца (~ мг), который меньше, чем автономное сжигание / восстановление, но больше, чем GC / пиролиз. Он не может разделять различные соединения, как это делает ГХ / пиролиз, и поэтому может быть предоставлено только среднее значение для всего образца, что также является недостатком для некоторых исследований.
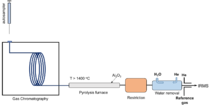 Принципиальная схема ГХ / пиролиз-IRMS
Принципиальная схема ГХ / пиролиз-IRMS GC-интерфейс (сжигание или пиролиз) также является онлайн-методом подготовки с последующим обнаружением IRMS. Это «специфичный для соединения» метод, позволяющий разделить аналиты перед измерением и, таким образом, предоставить информацию об изотопном составе каждого отдельного соединения. После разделения с помощью ГХ образцы преобразуются в более мелкие газообразные молекулы для изотопных измерений. ГХ / пиролиз использует интерфейс пиролиза между ГХ и IRMS для преобразования H и O в молекулах в H 2 и CO. GC-IRMS был впервые введен Мэтьюзом и Хейсом в конце 1970-х годов и позже использовался для δ 13 C, δ 15 N, δ 18 O и δ 34 S. Гелий используется в качестве газа-носителя в системах ГХ. Однако отделение сигнала DH (m / z = 3) от хвоста пучка 4 He + было проблематичным из-за интенсивного сигнала 4 He +. В начале 1990-х годов были предприняты активные усилия по устранению трудностей, связанных с измерением δD методом ГХ / пиролиз-IRMS. В 1999 году Hilkert et al. разработали надежный метод, интегрировав высокотемпературное преобразование (TC) в GC-IRMS и добавив электростатический сектор перед чашкой и замедляющую линзу перед коллектором чашки m / z = 3. Над этим одновременно работали несколько разных групп. Эта ГХ / пиролиз-IRMS, основанная на TC, в настоящее время широко используется для измерения δD. Коммерческие продукты GC-IRMS включают интерфейсы как горения, так и пиролиза, так что δ 13 C и δD могут быть измерены одновременно.
Существенным преимуществом метода ГХ / пиролиза для измерения изотопов водорода является то, что он может разделять различные соединения в образцах. Он требует наименьшего размера образца (типичный размер ~ 200 нг) по сравнению с другими методами, а также имеет высокую точность 1 ~ 5. Но этот метод относительно медленный и ограничен образцами, которые могут быть применены в системе ГХ.
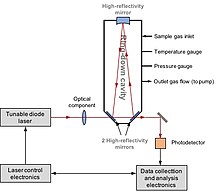 Принципиальная схема резонатора кольцевой спектроскопии с тремя зеркалами с высоким коэффициентом отражения (gt; 99,995%). Лазер быстро включается и выключается, и интенсивность света измеряется по мере его уменьшения с течением времени.
Принципиальная схема резонатора кольцевой спектроскопии с тремя зеркалами с высоким коэффициентом отражения (gt; 99,995%). Лазер быстро включается и выключается, и интенсивность света измеряется по мере его уменьшения с течением времени. Лазерная спектроскопия (или спектроскопия резонатора вниз по кольцу, CRDS) может напрямую измерять состав изотопов D / H, 17 O / 16 O и 18 O / 16 O в воде или метане. О применении лазерной спектроскопии к изотопам водорода впервые сообщили Bergamaschi et al. в 1994 году. Они непосредственно измерили 12 CH 3 D / 12 CH 4 в атмосферном метане с помощью перестраиваемой диодной лазерной спектроскопии на основе соли свинца. О разработке CRDS впервые сообщили O'Keefe et al. в 1988 г. В 1999 г. Kerstel et al. успешно применил этот метод для определения D / H в пробе воды. Система состоит из лазера и резонатора, оснащенного зеркалами с высокой точностью отражения. Лазерный свет вводится в полость, в которой происходит резонанс из-за конструктивной интерференции. Затем лазер выключается. Измеряется уменьшение интенсивности света. В присутствии образца воды фотопоглощение изотопологами воды следует кинетическому закону. Оптический спектр получается путем регистрации времени спада интересующих спектральных характеристик H 2 O при определенной длине волны лазера. Концентрация каждого изотополога пропорциональна площади под каждым измеренным спектральным признаком изотополога.
Лазерная спектроскопия - это быстрая и простая процедура, относительно невысокая стоимость и портативное оборудование. Таким образом, его можно использовать в полевых условиях для измерения проб воды. D / H и 18 O / 16 O могут быть определены одновременно при однократном впрыске. Для воды требуется небольшой объем образца lt;1 мкл. Типичная точность составляет ~ 1. Однако это прибор для конкретного соединения, т.е. можно измерить только одно конкретное соединение. А сосуществующие органические соединения (например, этанол ) могут мешать оптическому поглощению света водой, что приводит к перекрестному загрязнению.
2 H-сайт-специфическое естественное фракционирование изотопов - ядерный магнитный резонанс ( 2 H-SNIF-ЯМР ) - это тип ЯМР, специализирующийся на измерении концентрации дейтерия в органических молекулах в естественных количествах. Спектры ЯМР различают атомы водорода в различных химических средах (например, порядок углерода, с которым связывается водород, соседние функциональные группы и даже геминальные положения метиленовых групп), что делает его мощным инструментом для анализа изотопов с определенным положением. Химический сдвиг (в единицах частоты) от 2 H 6,5 раза ниже, чем у 1 Н. Таким образом, это трудно решить 2 H пиков. Чтобы обеспечить достаточно высокое разрешение для разделения пиков 2 H, применяются приборы с сильным магнитным полем (~ 11,4 Тл). Применение ЯМР для изучения изотопов водорода природных продуктов было впервые предложено Жераром Мартином и его сотрудниками в 1980-х годах. В течение нескольких десятилетий он развивался и расширялся. Измерение D / H ЯМР иногда сочетается с измерением ИК-МС для создания справочного стандарта. Чувствительность SNIF-ЯМР относительно низкая, обычно для каждого измерения требуется ~ 1 ммоль образца. Точность отношения изотопов также относительно низкая по сравнению с масс-спектрометрией. Даже современные инструменты могут измерять только отношения D / H с погрешностью около 50 ~ 200 ‰ в зависимости от соединения. Таким образом, до сих пор техника может различать только большие вариации D / H в консервированных материалах. В 2007 году Филипп Лесо и его коллеги усовершенствовали эту технику с помощью двумерного ЯМР с использованием хиральных жидких кристаллов (ХЖК) вместо изотропных растворителей для растворения органических молекул. Это позволяет проводить измерения квадрупольных дублетов для каждого неэквивалентного атома дейтерия. Таким образом сокращается перекрытие пиков и предоставляется более подробная информация о химической среде водорода.
Основное применение 2 H-SNIF-ЯМР - атрибуция источников, судебная медицина и исследования биосинтетических путей. (См. Также раздел Грея «Атрибуция источников и судебная экспертиза»). При измерении соединений сахара стратегия экономии времени заключается в их превращении в этанол путем ферментации, поскольку 2 H-SNIF ЯМР для этанола хорошо известен. Несколько исследований доказали, что на изотопы водорода в метильном и метиленовом положении образующегося этанола не влияет ни скорость ферментации, ни среда. Другой пример - изучение монотерпенов. с 1980-х годов исследование α-пинена с помощью SNIF-ЯМР обнаружило большие вариации в соотношении D / H между его участками. В частности, положение ex-C2 имеет сильное истощение (~ -750 ‰), что противоречило общепринятому биосинтетическому механизму (мевалонатный механизм) в то время, и привело к новому развитию путей. Совсем недавно Ина Элерс опубликовала свою работу о соотношении D6 S / D6 R в молекулах глюкозы. Было обнаружено, что стереохимическое распределение дитетериума коррелирует с соотношением фотодыхания / фотосинтеза. Соотношение фотодыхания / фотосинтеза определяется удобрением CO2, таким образом, это может привести к новым показателям при восстановлении концентрации палео-CO2. Также была проведена работа с длинноцепочечными жирными кислотами, и было обнаружено, что участки с четными номерами, которые, как считается, происходят из положения C2 ацетильной группы, более обогащены дейтерием, чем водород с нечетными номерами, которые происходят из положения C1 группы ацетильная группа. Дуан и др. сообщили о сильном кинетическом изотопном эффекте (KIE) во время десатурации от олеиновой кислоты до линолевой кислоты.
Таким образом, физика, лежащая в основе SNIF-ЯМР, позволяет измерять изотопомеры. Еще одно преимущество проведения ЯМР-измерений перед масс-спектрометрией состоит в том, что он анализирует образцы неразрушающим образом. 2 Н-ЯМР SNIF был хорошо промышлен в идентификации и судебно - медицинской экспертизе источника, и внес большой вклад в биохимические исследования пути. Применение 2 H-SNIF-ЯМР для геологических записей носит спорадический характер и все еще требует изучения.
Обычно масс-спектрометрия, такая как газовая хроматография-масс-спектрометрия ( ГХ-МС ) и газовая хроматография - время полета ( GC-TOF ), является распространенным методом анализа молекул, меченных изотопами. Этот метод включает ионизацию и анализ изотопологов интактной интересующей органической молекулы, а не ее продуктов пиролиза или превращения. Однако он не работает для изотопов водорода в естественном изобилии, поскольку обычные масс-спектрометры не обладают достаточной масс-разрешающей способностью для измерения изотопологов 13 C / D интактных органических молекул или молекулярных фрагментов в естественном изобилии. Например, для разрешения одиночного пика замещенного изотополога D любых углеводородов вам нужно будет, по крайней мере, исключить одиночный пик замещенного изотополога 13 C, который имеет ту же кардинальную массу, но на 0,0029 AMU легче и на несколько порядков больше. обильный.
Последние достижения в области аналитических приборов позволяют напрямую измерять отношения D / H в естественных условиях в органических молекулах. Новые инструменты имеют ту же структуру, что и любой обычный источник газа IRMS, но включают новые функции, такие как увеличенный магнитный сектор, секторы с двойной фокусировкой, квадрупольный фильтр масс и мультиколлекторы. Двумя коммерческими примерами являются Nu Panorama и Thermo Scientific 253 Ultra. Эти инструменты обычно обладают хорошей чувствительностью и точностью. Используя всего десятки наномолей метана, Ultra может достичь стабильно высокой точности с погрешностью около 0,1 ‰ в δD. Одним из первых примеров этого типа измерения были слипшиеся изотопы метана. (См. Раздел «Природный газ» в Ископаемом топливе). Еще одной сильной стороной этого типа инструментов является возможность проводить измерения изотопного отношения на конкретном участке. Этот метод основан на измерении отношений D / H фрагментов из источника ионов (например, CH 3 CH+ 2 молекулы пропана), который отбирает атомы водорода из разных частей молекулы.
Таким образом, прямая молекулярная масс-спектрометрия обычно используется для измерения лабораторных индикаторов изотопов с добавками. Недавно усовершенствованные масс-спектрометры с высоким разрешением для источников изотопов газа могут напрямую измерять изотопы водорода в органических молекулах. Эти масс-спектрометры могут обеспечить высокую точность и высокую чувствительность. Недостатком этого типа инструментов является высокая стоимость и сложность стандартизации. Кроме того, изучение сайт-специфических изотопов с помощью масс-спектрометрии менее прямолинейно и требует больше ограничений, чем метод SNIF-ЯМР, и позволяет различать только изотопологи, но не изотопомеры.
 Фракционирование изотопов водорода в гидрологическом цикле (на основе диаграммы гидрологического цикла). Изотопное фракционирование рассчитывается как разница между продуктом и исходной водой в каждом процессе при типичных условиях температуры и влажности.
Фракционирование изотопов водорода в гидрологическом цикле (на основе диаграммы гидрологического цикла). Изотопное фракционирование рассчитывается как разница между продуктом и исходной водой в каждом процессе при типичных условиях температуры и влажности. Вода является основным источником водорода для всех живых организмов, поэтому изотопный состав воды в окружающей среде является контролем первого порядка по сравнению с биосферой. Гидрологический цикл движется вода вокруг различных водоемов на поверхности Земли, в течение которых изотопы водорода в воде значительно фракционированных. Являясь основным источником влаги в атмосфере, океан имеет относительно однородный изотопный состав водорода по всему земному шару около 0 ‰ (VSMOW). Вариации δD более 10 ‰ в океане обычно ограничиваются поверхностными водами из-за испарения, образования морского льда и добавления метеорных вод с осадками, реками или айсбергами. В гидрологическом цикле двумя основными процессами, которые фракционируют изотопы водорода из океанской воды, являются испарение и конденсация. Следует отметить, что изотопный состав кислорода ( 18 O / 16 O) воды также является важным индикатором в гидрологическом цикле и не может быть отделен от изотопов водорода, когда мы говорим о процессах фракционирования изотопов, связанных с водой.
Во время испарения воды из океана в атмосферу возникают как равновесные, так и кинетические изотопные эффекты, определяющие изотопный состав водорода и кислорода образующегося водяного пара. На границе раздела вода-воздух застойный пограничный слой насыщен водяным паром ( относительная влажность 100%), а изотопный состав водяного пара в пограничном слое отражает равновесное фракционирование с жидкой водой. Равновесное фракционирование жидкость-пар для изотопов водорода и кислорода зависит от температуры:
(‰)
(‰)
Величина равновесного фракционирования жидкость-пар для изотопов водорода примерно в 8 раз больше, чем для изотопов кислорода при температурах поверхности земли, что отражает относительную разницу масс двух изотопных систем ( 2 H на 100% тяжелее 1 H, 18 O - На 12,5% тяжелее 16 O). Выше пограничного слоя находится переходная зона с относительной влажностью менее 100%, а также происходит кинетическое фракционирование изотопов, связанное с диффузией водяного пара из пограничного слоя в переходную зону, которое эмпирически связано с относительной влажностью (h):
‰
‰
Кинетический изотопный эффект, связанный с диффузией, отражает разницу масс молекул воды, замещенных тяжелыми изотопами (HD 16 O и H18 2O) относительно нормального изотополога (H16 2О).
После того, как вода испаряется в атмосферу, она переносится и возвращается на поверхность в результате конденсации и осаждения. Конденсация водяного пара происходит в восходящих воздушных массах, которые развивают более низкую температуру и давление насыщенного пара. Поскольку охлаждение и конденсация происходят относительно медленно, это процесс с равновесными изотопными эффектами. Однако, поскольку водяной пар постепенно конденсируется и теряется из воздуха во время переноса влаги, изотопный состав оставшегося пара, а также образующиеся осадки могут быть в значительной степени истощены из-за процесса рэлеевской перегонки. Уравнение для перегонки Рэлея:
 Процесс рэлеевской перегонки в осадке. По мере того, как температура воздуха падает от тропиков к полюсам, водяной пар постепенно удаляется из воздушной массы путем конденсации, оставляя остаточный пар обедненным тяжелыми изотопами. Тот же процесс происходит, когда воздушные массы перемещаются вглубь суши от океанов или поднимаются над горным хребтом.
Процесс рэлеевской перегонки в осадке. По мере того, как температура воздуха падает от тропиков к полюсам, водяной пар постепенно удаляется из воздушной массы путем конденсации, оставляя остаточный пар обедненным тяжелыми изотопами. Тот же процесс происходит, когда воздушные массы перемещаются вглубь суши от океанов или поднимаются над горным хребтом.
В уравнении R 0 представляет собой соотношение изотопов в исходном водяном паре, R r представляет собой соотношение изотопов в оставшемся водяном паре после некоторой конденсации, f - доля водяного пара, остающегося в воздухе, а α - жидкость-пар. коэффициент равновесного фракционирования (α = 1 + ε). Изотопный состав образовавшихся осадков (R p) может быть получен из состава оставшегося пара:
По мере того, как f постепенно уменьшается во время конденсации, оставшийся пар становится все более и более обедненным тяжелыми изотопами, и величина истощения становится больше, когда f приближается к нулю. Процесс рэлеевской дистилляции может объяснить некоторые пространственные закономерности первого порядка, наблюдаемые в изотопном составе осадков по всему земному шару, включая истощение изотопов от тропиков до полюсов, истощение изотопов от прибрежных до внутренних регионов и истощение изотопов с возвышением над горным хребтом., [2] все это связано с прогрессирующей потерей влаги во время транспортировки. Модель дистилляции Рэлея также может быть использована для объяснения сильной корреляции между δD и δ 18 O, наблюдаемой в глобальных осадках, выраженных как глобальная линия метеорной воды (GMWL): δD = 8δ 18 O + 10 (позже обновлено до δD = 8.17 ± 0,07 δ 18 O + 11,27 ± 0,65) Наклон GMWL отражает относительную величину фракционирования изотопов водорода и кислорода во время конденсации. Перехват GMWL не равен нулю (так называемый избыток дейтерия или d-избыток), что означает, что вода океана попадает на GMWL. Это связано с кинетическим изотопным эффектом при испарении, когда водяной пар диффундирует из насыщенного пограничного слоя в ненасыщенную переходную зону, и не может быть объяснено моделью Рэлея. Тем не менее, устойчивый образец GMWL убедительно указывает на единственный доминирующий источник влаги в глобальной атмосфере, которым является тропическая зона западной части Тихого океана. Следует также отметить, что местная линия метеорной воды может иметь другой наклон и пересечение с GMWL из-за различий в влажности и интенсивности испарения в разных местах. Таким образом, изотопы водорода и кислорода в воде служат отличным индикатором гидрологического цикла как на глобальном, так и на местном уровне.
На основе процессов фракционирования изотопов в гидрологическом цикле изотопный состав метеорной воды можно использовать для вывода связанных переменных окружающей среды, таких как температура воздуха, количество осадков, прошлые высоты, уровни озера, а также для отслеживания источников влаги. Эти исследования составляют область изотопной гидрологии. Примеры приложений изотопной гидрологии включают следующее:
Изотопный состав осадков можно использовать для вывода изменений температуры воздуха на основе процесса Рэлея. Более низкая температура соответствует более низкому давлению насыщенного пара, что приводит к большей конденсации, которая приводит остаточный пар к истощению изотопов. Таким образом, образующиеся осадки имеют более отрицательные значения δD и δ 18 O при более низкой температуре. Этот изотопный термометр для осадков более чувствителен при более низких температурах и широко применяется в высоких широтах. Например, было обнаружено, что δD и δ 18 O имеют температурную чувствительность 8 / ° C и 0,9 / ° C в антарктическом снегу и чувствительность 5,6 / ° C и 0,69 ‰ / ° C в арктических районах. δD и δ 18 O ледяных кернов в Гренландии, Антарктиде и альпийских ледников являются важными архивами изменений температуры в геологическом прошлом.
В отличие от регулирования температуры в высоких широтах, на изотопный состав осадков в тропиках в основном влияет количество осадков (отрицательная корреляция). Этот «эффект количества» наблюдается и для летних осадков в субтропиках. Вилли Дансгаард, который первым предложил термин «эффект количества», предложил несколько возможных причин корреляции: (1) По мере охлаждения и конденсации изотопный состав дождя отражает интегрированное истощение изотопов в результате процесса Рэлея; (2) Небольшое количество осадков, скорее всего, будет зависеть от испарения и обмена с окружающей влагой, что, как правило, делает ее более изотопно обогащенной. В низких широтах объемный эффект для δ 18 O составляет около -1,6 на 100 мм увеличения количества осадков на островных станциях и -2,0 на 100 мм на континентальных станциях. Также было отмечено, что эффект количества был наиболее выражен при сравнении изотопного состава ежемесячных осадков в разных местах тропиков. Эффект количества также ожидается для изотопов водорода, но калибровочных исследований не так много. В Юго-Восточной Азии чувствительность δD к ежемесячному количеству осадков колеблется от –15 до –25 ‰ / 100 мм в зависимости от местоположения. В регионах с умеренным климатом в изотопном составе осадков преобладает количество осадков летом, но в большей степени зависит от температуры зимой. Эффект количества также может осложняться изменениями в региональных источниках влаги. Реконструкции количества осадков в тропиках в геологическом прошлом в основном основаны на δ 18 O образований или δD биогенных липидов, которые считаются косвенными показателями изотопного состава осадков.
Изотопы водорода и кислорода также работают как индикаторы баланса воды в наземных водоемах, включая озера, реки, грунтовые воды и почвенные воды. Для озера как количество воды в озере, так и изотопный состав воды определяются балансом между входами (осадки, поток и приток грунтовых вод) и выходами (испарение, сток и отток грунтовых вод). Изотопный состав воды в озере часто можно использовать для отслеживания испарения, которое вызывает обогащение изотопов в воде озера, а также для наклона δD-δ 18 O, который является более мелким, чем линия метеорной воды. Изотопный состав речной воды сильно варьируется и имеет сложные источники в разных временных масштабах, но, как правило, может рассматриваться как проблема смешения двух конечных элементов, концевых элементов основного течения (в основном подпитка грунтовых вод) и концевых элементов наземного потока (в основном штормовых). События). Изотопные данные показывают, что долгосрочная интегрированная конечная часть базового стока более важна для большинства рек, даже во время пикового стока летом. Систематические данные об изотопах рек были собраны по всему миру Глобальной сетью изотопов в реках (GNIR) [3]. Изотопный состав подземных вод также может быть использован для отслеживания их источников и путей течения. Примером может служить исследование изотопного картирования подземных вод в Сакраменто, Калифорния, которое показало боковой поток речной воды с определенным изотопным составом в подземные воды, что привело к значительному понижению уровня грунтовых вод из-за откачивания воды для использования людьми. То же исследование также показало изотопный сигнал о том, что сельскохозяйственная вода пополняется гигантским аллювиальным водоносным горизонтом в Центральной долине Калифорнии. Наконец, изотопный состав почвенной воды важен для изучения растений. Ниже уровня грунтовых вод почва имеет относительно постоянный источник воды с определенным изотопным составом. Выше уровня грунтовых вод изотопный состав почвенной воды увеличивается за счет испарения до максимума на поверхности. Вертикальный профиль изотопного состава почвенной воды поддерживается за счет диффузии как жидкой, так и паровой воды. Сравнение δD воды в почве и воды ксилемы растений может быть использовано для определения глубины, на которой корни растений получают воду из почвы.
 Данные ледового керна Востока по изотопам водорода, температуре и концентрации парниковых газов за последние 420 000 лет. Данные, полученные от Petit et al. (1999).
Данные ледового керна Востока по изотопам водорода, температуре и концентрации парниковых газов за последние 420 000 лет. Данные, полученные от Petit et al. (1999). Изотопный состав ледяных кернов континентальных ледяных щитов и альпийских ледников был разработан в качестве температурных заместителей с 1950-х годов. Сэмюэл Эпштейн был одним из первых, кто продемонстрировал применимость этого показателя, измеряя изотопы кислорода в антарктическом снегу, а также указал на сложности в стабильной корреляции изотоп-температура, вызванные историей воздушных масс, из которых сформировался снег. Ледяные керны в Гренландии и Антарктиде могут иметь толщину в тысячи метров и фиксировать изотопный состав снега за последние несколько ледниково-межледниковых циклов. Ледяные керны могут быть датированы подсчетом слоев на вершине и моделированием ледяного потока на глубине, с дополнительными возрастными ограничениями по вулканическому пеплу. Керны из Гренландии и Антарктиды можно сопоставить по возрасту с высоким разрешением путем сравнения глобально хорошо перемешанных газовых примесей (например, CH 4) в пузырьках воздуха, захваченных в кернах. Некоторые из первых записей ледяных кернов из Гренландии и Антарктиды с оценками возраста относятся к последним 100 000 лет и показали уменьшение δD и δ 18 O в последний ледниковый период. С тех пор рекорд ледяных кернов увеличился до последних 800 000 лет в Антарктиде и не менее 250 000 лет в Гренландии. Один из лучших показателей температуры керна льда на основе δD получен по керну Востока в Антарктиде, возраст которого составляет 420 000 лет. Преобразование δD-температуры ( инверсионного слоя, в котором образуется снег) в Восточной Антарктиде на основе современного пространственного градиента δD (9 ‰ / ° C) составляет ΔT I = (ΔδD льда -8Δδ 18 O sw) / 9, что учитывает учитывать вариации изотопного состава морской воды, вызванные глобальными изменениями объема льда. Помимо температуры, на δD льда могут влиять многие местные эффекты. Эти эффекты включают происхождение и пути переноса влаги, условия испарения и сезонность осадков, которые могут быть учтены в более сложных моделях. Тем не менее, данные по керну льда Востока показывают некоторые очень важные результаты: (1) последовательное снижение δD на ~ 70 ‰ в течение последних четырех ледниковых периодов по сравнению с межледниковым периодом, что соответствует похолоданию в Антарктиде на 8 ° C; (2) Последовательное падение концентрации CO 2 в атмосфере на 100 ppmv и падение CH 4 на ~ 300 ppbv в ледниковые периоды по сравнению с межледниковыми периодами, предполагая роль парниковых газов в регулировании глобального климата; (3) Изменения температуры воздуха в Антарктике и концентрации парниковых газов предшествуют изменениям глобального объема льда и температуры воздуха в Гренландии во время прекращения ледникового покрова, а парниковые газы могут быть усилителем инсоляционного воздействия во время ледниково-межледниковых циклов. Изотопные записи ледяных кернов Гренландии, помимо показа ледниково-межледниковых циклов, также показывают колебания климата в масштабе тысячелетия, которые могут отражать реорганизацию океанической циркуляции, вызванную зарядами таяния льда. Были также обнаружены записи кернов льда в альпийских ледниках на разных континентах. Запись в Андах в Перу показывает снижение температуры на 5-6 ° C в тропиках во время последнего ледникового периода. Запись с Тибетского плато показывает аналогичный изотопный сдвиг и похолодание во время последнего ледникового периода. Другие существующие записи альпийских ледниковых изотопов включают гору Килиманджаро в Танзании, гору Алтай и западное плато Белуха в России, гору Логан в Канаде, ледник Фремонт в Вайоминге, США, и ледяное ядро Илимани в Боливии, большая часть которых покрывает интервал Эпоха голоцена. [4]
Изотопные составы биомолекул, сохранившиеся в осадочных записях, могут быть использованы в качестве косвенного показателя для реконструкций палеосреды. Поскольку вода является основным источником водорода для фотоавтотрофов, изотопный состав водорода в их биомассе может быть связан с составом воды для выращивания и, таким образом, использоваться для понимания некоторых свойств древней окружающей среды. Изучение изотопов водорода может быть очень ценным, поскольку водород более напрямую связан с климатом, чем другие соответствующие системы стабильных изотопов. Однако атомы водорода, связанные с атомами кислорода, азота или серы, могут обмениваться с водородом окружающей среды, что делает эту систему менее простой [см. Предыдущий раздел об обмене водорода]. Для изучения изотопного состава водорода биомолекул предпочтительно использовать соединения, в которых водород в значительной степени связан с углеродом и, следовательно, не подлежит обмену в экспериментальных временных масштабах. По этим критериям липиды - гораздо лучший объект для изучения изотопов водорода, чем сахара или аминокислоты.
Чистое фракционирование между исходной водой и липидами обозначается как ε l / w и может быть представлено как
где w относится к воде, а l относится к липидам.
Хотя δD исходной воды оказывает наибольшее влияние на δD липидов, расхождения между значениями коэффициента фракционирования, полученными из наклона и из пересечения регрессии, предполагают, что взаимосвязь более сложна, чем фракционирование с двумя пулами. Другими словами, существует несколько этапов фракционирования, которые необходимо учитывать при понимании изотопного состава липидов.
Связанный углеродом изотопный состав водорода целлюлозы, унаследованный от листовой воды, имеет потенциал сохранения исходного сигнала метеорной воды. Впервые это было продемонстрировано в 1970-х годах. В ходе систематического исследования в Северной Америке было обнаружено, что δD древесной целлюлозы имеет температурную чувствительность 5,8 / ° C, что аналогично чувствительности δD осадков, равной 5,6 / ° C. Эта пространственная корреляция может осложняться локальными эффектами испарения почвы и транспирации листьев, а пространственный градиент может не отражать временные изменения целлюлозы годичных колец в одном месте. Механизм, который генерирует сигнал δD в целлюлозе из метеорной воды, полностью не изучен, но, по крайней мере, включает транспирацию листовой воды, синтез углеводов, синтез целлюлозы из фотосинтетических сахаров и обмен сахаров с ксилемной водой. Исследования по моделированию показывают, что наблюдаемая δD целлюлозы из древесных колец может быть получена, когда 36% водорода в сахарах могут обмениваться с ксилемной водой, а такие эффекты, как влажность и сезонность осадков, могут усложнить прокси-функцию δD целлюлозы. Несмотря на эти сложности, древесные кольца δD использовались для палеоклиматических реконструкций последних нескольких тысячелетий. Например, записи δD древесных колец целлюлозы из сосен в Белых горах, Калифорния, показывают снижение на 50 ‰ с 6800 лет назад по настоящее время. Тенденция к похолоданию, начиная с теплового максимума в середине голоцена, согласуется с данными ледяного керна и пыльцы, но соответствующая величина похолодания неуловима из-за сложных влияний местных эффектов, таких как влажность и состав почвенной воды. Значение изотопов в целлюлозе и ее применения все еще активно изучаются.
 Фотография листа с отражением солнечного света от восковой поверхности.
Фотография листа с отражением солнечного света от восковой поверхности. Наземные растения производят воск для листьев, чтобы покрыть поверхность своих листьев в качестве приспособления, чтобы минимизировать потерю воды. Эти воски в основном представляют собой n -алкильные липиды с прямой цепью. Они нерастворимы, нелетучие, химически инертны и устойчивы к разложению, что позволяет легко сохранять их в осадочной записи и, следовательно, является хорошей мишенью в качестве биомаркеров.
Основным источником воды для наземных растений является почвенная вода, которая в значительной степени напоминает изотопный состав водорода дождевой воды, но варьируется в зависимости от окружающей среды и с обогащением за счет осадков, истощения за счет испарения и обмена с атмосферным водяным паром. Может быть значительный сдвиг между значением δD исходной воды и значением δD воды листа в месте биосинтеза липидов. Никакое фракционирование не связано с поглощением воды корнями - процессом, обычно вызываемым капиллярным напряжением, за одним исключением ксерофитов, которые сжигают АТФ для перекачивания воды в чрезвычайно засушливых средах (с истощением примерно на 10 ‰). Однако листовая вода может быть существенно обогащена по сравнению с почвенной водой за счет транспирации, процесса испарения, на который влияют температура, влажность и состав окружающего водяного пара. Изотопный состав водорода листовой воды может быть описан с помощью модифицированной модели Крейга-Гордона, где ΔD e - это стационарное обогащение листовой воды, ε eq - зависящее от температуры равновесное фракционирование между жидкой водой и паром, ε k - кинетический изотоп. эффект от диффузии между внутренним воздушным пространством листа и атмосферой, ΔD v - неравновесие между листом и воздухом, e a - атмосферное давление пара, а e i - внутреннее давление пара листа.
Эффект Пекле, который описывает противоположные силы адвекции и диффузии, может быть добавлен к модели как
где E - скорость транспирации, L - масштаб переноса, C - концентрация воды, D - коэффициент диффузии.
В то время как роль δD дождевой воды как фундаментального контроля конечного δD липидов хорошо задокументирована, важность влияния фракционирования дождевой воды на почвенную воду и листовую воду на ε l / w оценивается, но остается малоизученной.
Органические биомолекулы обычно обеднены по сравнению с δD воды листа. Однако различия между организмами, биосинтетическими путями и биологической ролью разных молекул могут привести к огромной вариативности фракционирования; Разнообразие липидных биомаркеров охватывает диапазон значений δD 600. Биосинтез липидов сложен с биохимической точки зрения и включает несколько ферментно-зависимых стадий, которые могут привести к фракционированию изотопов. Существует три основных пути биосинтеза липидов, известных как мевалонатный путь, ацетогенный путь и 1-дезоксиD-ксилулозо-5-фосфат / 2-метилэритроил-4-фосфатный путь. Ацетогенный путь отвечает за продукцию n- алкиллипидов, таких как воск листьев, и связан с меньшим истощением δD по сравнению с исходной водой, чем два других пути биосинтеза липидов. Хотя листовая вода является основным источником водорода в биомолекулах листа, относительно обедненный водород из ацетата или НАДФН часто добавляется во время биосинтеза и вносит свой вклад в водородный состав конечной молекулы. Вторичные реакции водородного обмена, то есть реакции гидрогенизации и дегидрирования вне основного пути биосинтеза, также вносят существенный вклад в изменчивость изотопного состава водорода липидов.
Важно отметить, что биологические различия в фракционировании происходят не только из-за биохимических различий между разными молекулами, но также из-за физиологических различий между разными организмами. Например, значения δD множественных молекул листового воска у кустарников выше (медиана ~ -90 ‰) по сравнению с деревьями (медиана ~ -135), которые сами по себе обогащены как по C3 (медиана ~ -160), так и по C4. травы (медиана ~ -140 ‰). Между отдельными видами были зарегистрированы существенные различия в значениях δD. Другие физиологические факторы, которые способствуют изменчивым значениям δD парафина листьев, включают сезонные сроки развития листьев, реакцию на внешний стресс или изменчивость окружающей среды, а также наличие или отсутствие устьиц.
Иногда бывает трудно отличить физиологические факторы от факторов окружающей среды, когда многие физиологические адаптации напрямую связаны с окружающей средой.
Было показано, что несколько факторов окружающей среды вносят вклад в изменчивость δD парафина листьев в дополнение к влиянию окружающей среды на δD исходной воды. Известно, что влажность влияет на значения δD липидов при умеренных уровнях влажности, но не при особенно высоких (gt; 80%) или низких (lt;40%) уровнях влажности, и широкая тенденция увеличения значений δD, означающих меньшие ε l / w, является замечено в засушливых регионах. Температура и интенсивность солнечного света, коррелированные с географической широтой, оказывают сильное влияние на скорость метаболизма и транспирации, а также на ε l / w. Кроме того, средняя длина цепи молекул листового воска изменяется в зависимости от географической широты, и было показано, что ε l / w увеличивается с увеличением длины цепи.
При использовании биомаркеров в качестве косвенного показателя для реконструкции древней окружающей среды важно знать о предвзятости, присущей осадочной записи. Вещество листьев, включенное в отложения, в основном оседает осенью, поэтому следует учитывать сезонные колебания воска листьев. Кроме того, отложения усредняют восковые массы листьев на множестве разных растений как в пространстве, так и во времени, что затрудняет калибровку биологических ограничений на ε l / w. Наконец, сохранение биомолекул в геологической летописи не точно отражает целостные экосистемы, и всегда существует угроза водородного обмена, особенно если отложения подвергаются воздействию высоких температур.
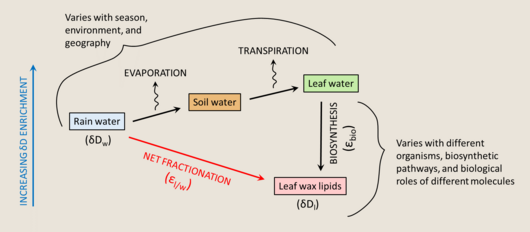 Связь изотопов водорода между дождевой водой и липидами воска листьев. По материалам Sachse et al., 2012.
Связь изотопов водорода между дождевой водой и липидами воска листьев. По материалам Sachse et al., 2012. Изотопный состав водорода восков листьев можно суммировать как δD дождевой воды с тремя основными этапами фракционирования - испарение из почвенной воды, транспирация из листовой воды и биосинтез липидов, которые можно объединить и измерить как чистое фракционирование, или ε л / ж. Благодаря применению постоянно улучшающихся методов измерения одиночных молекул и корреляции с другими независимыми примерами в геологической летописи, которые могут помочь ограничить некоторые переменные, исследование изотопного состава водорода восков листьев может быть чрезвычайно продуктивным. Данные δD парафина листьев были успешно применены для улучшения нашего понимания климатических изменений в гидрологии суши, демонстрируя, что циркуляция океана и температура поверхности оказывают значительное влияние на континентальные осадки. Значения δD парафина листьев также использовались в качестве записей палеоальтиметрии для восстановления градиентов высот в древних горных хребтах на основе влияния высоты на δD дождевой воды.
 Основная структура алкенона. Алкеноны имеют от 35 до 41 углеродной цепи с 1-4 двойными связями.
Основная структура алкенона. Алкеноны имеют от 35 до 41 углеродной цепи с 1-4 двойными связями. Другая группа молекул, часто используемых в палеореконструкциях, - это алкеноны, длинноцепочечные в значительной степени ненасыщенные липиды, продуцируемые исключительно кокколитофоридами. Кокколитофориды - это морские гаптофитные водоросли, в том числе всемирно известный вид Emiliania huxleyi, один из основных продуцентов CaCO 3 в океане. Значения δD алкенонов сильно коррелируют со значениями δD морской воды и, следовательно, могут использоваться для реконструкции палеоэкологических свойств, которые ограничивают изотопный состав морской воды. Наиболее заметная реконструкция, к которой применяются значения δD алкенона, - это соленость древних океанов.
 Сканирующая электронная микрофотография одиночной клетки Эмилианы Хаксли.
Сканирующая электронная микрофотография одиночной клетки Эмилианы Хаксли. И значения δD морской воды, и фракционирование, связанное с биохимией гиптофитов (ε bio), достаточно хорошо изучены, поэтому алкеноны можно легко использовать для наблюдения вторичного влияния солености на δD. Существует четко установленная положительная линейная корреляция между соленостью и ε l / w, порядка ~ 3 ‰ изменения фракционирования на единицу солености. Предполагаемые механизмы этого эффекта включают обогащение D во внутриклеточной воде из-за снижения обмена с внеклеточной водой при более высокой солености, удаление H из внутриклеточной воды из-за увеличения производства растворенных веществ для поддержания осмотического давления при более высокой солености и более низкие скорости роста гаптофитов при более высокой соленость
Значения δD алкенона успешно использовались для реконструкции прошлых изменений солености в Средиземном море, Черном море, Панамском бассейне и Мозамбикском проливе. Как расширение солености, эти данные также использовались, чтобы сделать дальнейшие выводы о древних средах, таких как древние пресноводные наводнения и эволюция планктона в ответ на изменения окружающей среды.
Возможность использования истощения изотопов воды с высотой для восстановления палеоальтиметрии была продемонстрирована еще в конце 1960-х годов, когда геохимик из Калифорнийского технологического института Сэмюэл Эпштейн попытался собрать дождевую воду на разных высотах во время одного шторма. Интенсивность градиента δ 18 O и δD варьируется в пределах от -1 до -5 / км и от -10 до -40 / км соответственно, но может меняться в зависимости от местоположения и сезона и не является строго линейной с высотой. Одно из первых исследований в области палеоальтиметрии стабильных изотопов продемонстрировало сигнатуру δD метеорной воды от -90 до -139 ‰ во флюидных включениях в кварце и адуляре в эпитермальном золото-серебряном месторождении в Неваде и предложило применение стабильных изотопов в реконструкции древних времен. топография в Большом бассейне. С тех пор изотопы водорода и кислорода водосиликатных минералов использовались для реконструкции топографической истории горных хребтов по всему миру, включая Североамериканские Кордильеры, Скалистые горы, Гималаи, Европейские Альпы и Южные Альпы в Новой Зеландии. Лабораторные эксперименты с глинистыми минералами показали, что изотопные составы водорода и кислорода относительно устойчивы к изменениям при умеренной температуре (lt;100 ° C) и могут сохранять исходный сигнал метеорной воды. Одним из важных эффектов горных хребтов на стабильные изотопы дождя является эффект тени дождя, при котором изотопное истощение происходит в осадках с подветренной стороны по сравнению с наветренной стороной. Изменение разницы в изотопном составе осадков на двух сторонах горы можно использовать для определения величины эффекта тени от дождя. В одном из таких исследований было обнаружено изотопное обогащение смектита на восточной стороне Сьерра-Невады в Калифорнии с середины миоцена до позднего плиоцена, что указывает на снижение высоты в этот период. Другое исследование обнаружило значения δD около -140 ‰ в мусковите в Кордильерах Северной Америки в раннем эоцене, что предполагает высоту на 1000 м выше, чем сегодня в то время. В дополнение к водным минералам изотопы водорода в биомаркерах, таких как воск листьев, также были разработаны для палеоальтиметрических исследований. Падение δD восков листьев (-21 ‰ / км) попадает в диапазон наблюдений за метеорной водой. В качестве примера исследования данные δD парафина листьев использовались для подтверждения палеоальтиметрии водных минералов на возвышенности Сьерра-Невады в эоцене.
Изотопный состав водорода нефти, газа и угля является важным геохимическим инструментом для изучения образования, хранения, миграции и многих других процессов. Изотопный сигнал водорода ископаемого топлива является результатом как наследования исходного материала и воды, так и фракционирования во время образования углеводородов и последующего изменения такими процессами, как изотопный обмен или биодеградация. При интерпретации данных по изотопу водорода осадочного органического вещества необходимо принимать во внимание все процессы, которые могут иметь изотопный эффект.
Практически весь органический водород в той или иной степени можно обменять. Изотопный обмен органического водорода изменит порядок распределения дейтерия и часто включает внешний водород. Как правило, обмен более зрелыми материалами происходит более существенно. При эффективном обмене алифатический водород может наконец достичь изотопного равновесия на последней стадии. Фактор равновесного фракционирования варьируется между различными водородными участками. Например, фракционирование алифатических изотопов водорода зависит от атома углерода, с которым связан атом водорода. В первом порядке изотопный состав алкильного водорода следует этой тенденции: δD Первичный углерод lt;δD Вторичный углерод lt;δD Третичный углерод. Коэффициенты фракционирования между центрами углерода также уменьшаются с повышением температуры. Это потенциально может быть использовано как индикатор термоистории. Фракционирование между целой молекулой и водой можно оценить путем усреднения всех водородных позиций, и это приводит к относительно небольшому изменению равновесного фракционирования между различными группами углеводородов и водой. Согласно теоретическому прогнозу, это значение составляет от -80 ‰ до -95 ‰ для стеранов, от -90 ‰ до -95 ‰ для гопанов и от -70 ‰ до -95 для типичных циклопарафинов при температуре от 0 ° C до 100 ° C. При температуре масляного окна и газового окна равновесное фракционирование между различными группами органических молекул относительно мало по сравнению с большими первичными сигналами.
Изучение изотопов водорода в ископаемом топливе применяется в качестве заместителей и инструментов в следующих аспектах:
Первая стадия, которую осадочное органическое вещество (ПОВ) испытывает после отложения, - это диагенез. Во время диагенеза биологическое разложение может изменить соотношение D / H органических веществ. Несколько экспериментальных исследований показали, что некоторые биоразлагаемые материалы становятся немного обогащенными D (менее 50 ‰). Большинство органических веществ становится керогеном к концу диагенеза. Обычно δD керогена имеет широкий диапазон. Керогену, который мы наблюдаем в геологических записях, способствует множество факторов, в том числе:
Исследования австралийских бассейнов показали, что δD керогена из озерных водорослей с наземным вкладом варьируется от −105 ‰ до −200 ‰, а δD керогена из прибрежной среды осадконакопления имеет более узкий диапазон от −75 ‰ до −120 ‰. Считается, что меньший диапазон отношений D / H прибрежного керогена отражает относительно стабильный региональный климат. Педентчук и его коллеги сообщили о значениях δD от -70 ‰ до -120 ‰ в незрелом и низкозрелом керогене из озерных отложений раннего мела в Западной Африке.
Уголь состоит из керогена типа III, в основном получаемого из наземных растений, которые должны иметь первичный сигнал D / H, чувствительный к местной метеорной воде. Reddings et al. проанализировали угли различного происхождения и обнаружили, что они случайным образом разбросаны в диапазоне от –90 ‰ до –170 ‰. Rigby et al. обнаружили, что содержание D снижается с -70 ‰ до -100 ‰ с увеличением зрелости угля из бассейна Басс, и приписывают это последнему обмену с водой с низким содержанием D. Smith et al. изучили изотопы H в образцах угля Антарктиды и Австралии. Они обнаружили сильную отрицательную корреляцию между δD и предполагаемой палеоширотой. Для образцов угля, происходящих из приэкваториальных областей, δD составляет около -50 ‰, в то время как для образцов, происходящих из полярных регионов, δD составляет около -150 ‰. Этот тренд δD вдоль широты соответствует тренду метеорных вод и, таким образом, свидетельствует о том, что угли могут сохранять большую часть исходных сигналов.
Существует два типа подхода к изучению изменения соотношений D / H керогена во время катагенеза: 1) лабораторная инкубация органического вещества, которая позволяет механистические исследования с контролируемыми экспериментами. 2) измерение естественной пробы, которое предоставляет информацию о комбинированных эффектах в геологических временных масштабах. Сложный состав и химический состав керогена усложняют результаты. Тем не менее, большинство исследований изотопов водорода керогена показывают обогащение D с увеличением зрелости. Кероген типа II (морской) из сланцев Нью-Олбани, как сообщается, имеет увеличение δD с -120 ‰ до -70 ‰ по мере увеличения отражательной способности витринита с 0,3% до 1,5%. Было предложено два основных механизма обогащения. Один из них - кинетическое фракционирование во время образования углеводородов, а другой - изотопный обмен с окружающей водой. Эксперименты по безводной инкубации показали, что продукты, как правило, более обеднены D, чем их предшественники, что приводит к обогащению остаточным керогеном. Schimmelmann et al. изучили взаимосвязь между нефтью, добываемой на суше, и керогенами в нефтематеринских породах четырех австралийских бассейнов. Они обнаружили, что в среднем нефть обеднена до соответствующего керогена на 23. Эксперименты по водной инкубации показывают, что 36–79% органического водорода может поступать из воды средней степени зрелости. Хотя все еще ведутся дискуссии, кажется вероятным, что включение изотопов водорода в воду является более доминирующим процессом для обогащения керогена D во время катагенеза.
Таким образом, содержание D в керогене и углях сложно определить из-за сложного химического состава. Тем не менее, исследования обнаружили возможную корреляцию между δD угля и палеоширотой.
Обычно изотопный состав водорода природного газа из одной и той же скважины имеет тенденцию: δD метана lt;δD этана lt;δD пропана lt;δD C4 +. Это связано с тем, что большая часть природного газа, как считается, образуется в результате ступенчатого термического крекинга, который в основном необратим и, таким образом, регулируется обычными кинетическими изотопными эффектами, которые благоприятствуют легким изотопам. Та же тенденция, известная как «нормальный порядок», сохраняется для изотопов углерода природного газа. Например, газ Анголы имеет диапазон δD метана от -190 ‰ до −140 ‰, δD этана от −146 ‰ до −107 ‰, δD пропана от −116 ‰ до −90 ‰ и δD бутана. от −118 ‰ до −85 ‰. Однако некоторые недавние исследования показывают, что могут существовать и противоположные закономерности, означающие, что δD метана gt; δD этана gt; δD пропана. Это явление часто называют «изотопным обращением» или «изотопным обращением». Изотопный порядок также может быть частично обратным, например, δD метан gt; δD этан lt;δD пропан или δD метан lt;δD этан gt; δD пропан. Burruss et al. обнаружили, что в самых глубоких образцах бассейна северных Аппалачей изотопный порядок водорода для метана и этана перевернут. Лю и др. Также обнаружили частичное разворачивание нефтяного газа из Таримского бассейна. Механизм, вызывающий это обращение, до сих пор неизвестен. Возможные объяснения включают смешение газов с разной зрелостью и источниками, окисление метана и т. Д. Джон Теллинг и др., Синтезировали изотопно-обращенные (как в C, так и в H) низкомолекулярные алканы с использованием реакций газофазной рекомбинации радикалов в экспериментах с электрическим разрядом. предоставление другого возможного механизма.
Метан - основной компонент природного газа. Геосферный метан интригует своим большим вкладом в микробный метаногенез. Этот процесс демонстрирует сильный изотопный эффект, приводящий к большему обеднению D метаном по сравнению с другими углеводородами. δD колеблется от -275 ‰ до -100 ‰ в термогенном метане и от -400 ‰ до -150 ‰ в микробном метане. Кроме того, метан, образованный морскими метаногенами, обычно обогащен D по сравнению с метаном из пресноводных метаногенов. График δD метана был нанесен вместе с другими геохимическими инструментами (например, δ 13 C, влажность газа) для классификации и идентификации природного газа. Диаграмма δD-δ 13 C (иногда называемая диаграммой CD, диаграммой Уитикара или диаграммой Шоелла) широко используется для помещения метана в одну из трех отдельных групп: термогенный метан, который имеет более высокие значения как δ 13 C, так и δD; морской микробный метан, более обедненный 13 C, и пресноводный микробный метан, более обедненный D. Гидрогенотрофный метаногенез производит менее обедненный D метан по сравнению с ацетокластическим метаногенезом. Место, где обитает организм, и концентрация субстрата также влияют на изотопный состав: метаногенез в рубце, который происходит в более закрытой системе и с более высоким парциальным давлением водорода, демонстрирует большее фракционирование (от -300 до -400 ‰), чем метаногенез заболоченных земель (-250 до −170 ‰).
 Это диаграмма δD-δ13C, которая хорошо известна для классификации и идентификации изотопов метана на основе изотопов углерода и изотопов водорода. Перерисовано с Whiticar, 1999 г.
Это диаграмма δD-δ13C, которая хорошо известна для классификации и идентификации изотопов метана на основе изотопов углерода и изотопов водорода. Перерисовано с Whiticar, 1999 г. Недавние достижения в аналитической химии сделали возможным высокоточные измерения многократно замещенных изотопологов (или «сгруппированных изотопологов»), таких как 13 CH 3 D. Это стало новым инструментом для изучения образования метана. Этот показатель основан на изобилии слипшихся изотопологов метана, которые должны быть обогащены по сравнению со стохастическим распределением при термодинамическом равновесии, потому что приведенная энергия нулевой точки для связывания тяжелых и тяжелых изотопов более чем в два раза превышает приведенную энергию нулевой точки тяжелого изотопов. -легкая изотопная связь. Степень обогащения уменьшается с повышением температуры, поскольку более высокая энтропия имеет тенденцию к случайному распределению изотопов. Столпер и др. установил эту калибровку температуры с использованием лабораторного уравновешенного метана и метана из месторождения, исходя из известной температуры пласта, и применил ее к нескольким газовым коллекторам для изучения образования и смешения природного газа. Wang et al. также сообщили о сильном неравновесном изотопном эффекте в изотопах, связанных с комками метана, полученных из лабораторных культур метаногенов и полевых проб. Эти образцы метана имеют относительно низкое содержание слипшихся изотопологов, иногда даже ниже, чем стохастическое распределение. Это указывает на то, что в ферментативных реакциях во время метаногенеза происходят необратимые этапы фракционирования против слипшихся изотопологов для создания обедненного сигнала. Скопление изотопов в метане доказало свою надежность, и теперь ученые переходят к молекулам алканов более высокого порядка, таким как этан, для дальнейшей работы.
Нефть обычно является продуктом термического разложения керогена типа I и типа II во время катагенеза. Содержание дейтерия должно отражать сигнал источника керогена, фракционирование генерации, изотопный обмен и другие эффекты созревания. Термическое созревание в масляном окне может стереть большую часть первичных сигналов изотопов водорода. Образование нефти включает разрыв связей CC и CH, что приводит к истощению 13 C и D в продуктах и обогащению остаточными реагентами из-за кинетических изотопных эффектов. Юнчун Тан и его коллеги смоделировали этот процесс на основе данных кинетики, откалиброванных в лаборатории, и обнаружили, что отношение частотного фактора для D / H составляет 1,07. Более того, на нефть также влияет фракционирование изотопов в результате фазового перехода. Однако поведение газожидкостного фракционирования нефти отличается от водного, поскольку паровая фаза нефти обогащена D. Это приведет к истощению остаточной нефти по мере ее испарения. Также ожидается, что биологическое разложение нефти приведет к фракционированию изотопов водорода, поскольку ферментативный разрыв связи CH имеет нормальный кинетический изотопный эффект. Несколько экспериментов по деградации показывают, что это фракционирование обычно мягкое, в пределах от -11 ‰ до -79. Этот процесс также должен обогащать частично разложившуюся нефть. Наконец, нефть, хранящаяся в резервуаре, часто мигрировала через недра (также известную как «геохроматография») из другого источника, взаимодействуя с водой. Не было опубликовано никаких данных, подтверждающих фракционирование, связанное с миграцией, но теоретический прогноз показывает, что это, вероятно, будет очень небольшим.
Многие исследования природных образцов показали небольшое увеличение δD с термической зрелостью. Амане Васеда сообщил, что δD образцов нефти на северо-востоке Японии увеличится с примерно -130 ‰ до примерно -110 ‰ с более высокой зрелостью. При низкой термической зрелости душ Сантуш Нето и Хейс сообщили, что δD насыщенной фракции нефти в бассейне Портигуар, полученной из озерной среды, составляет -90 ‰, а из морской эвапоритовой среды составляет от -120 ‰ до -135 ‰.
Массовый анализ нефти, который дает сложную смесь органических соединений, скрывает большую часть ценной информации. Переход к изучению конкретных соединений значительно расширил наши представления об изотопах водорода нефти. Анализ содержания дейтерия на уровне соединений позволяет избежать проблем, связанных с различиями в обменных курсах, упрощает взаимоотношения с источниками и продуктами и позволяет получить более подробную картину. Обычно считается, что δD н-алканов является репрезентативным для нефти, поскольку они являются основными компонентами. Schimmelmann et al. подтвердили, что алкановые фракции имеют почти такое же отношение D / H, как и цельные масла. В зависимости от типа исходного материала и зрелости δD н-алканов может изменяться от –100 ‰ до –180 ‰. Обычным явлением для различных н-алканов, полученных из нефти и созревшей породы, является тенденция увеличения δD с увеличением длины цепи. Например, Ли и др. проанализировали нефть из осадочного бассейна Западной Канады и обнаружили, что δD увеличилось между 20 ‰ и 40 ‰ с C 13 до C 27. Этот «изотопный наклон» является артефактом кинетического фракционирования, связанного с термическим растрескиванием углеродных цепей. Эта тенденция была экспериментально воспроизведена и теоретически смоделирована Tang et al.
Также известно, что N-алканы сохраняют подробную информацию об исходном материале. Ли и др. изучили нефть из морских отложений второго белого крапчатого сланца верхнего мела и обнаружили сильный обедненный сигнал около -180 ‰ в C 12 -C 18. Низкие значения δD этих морских образцов были объяснены стоком крупной высокоширотной реки. Schimmelmann et al. обнаружили, что δD нефти, отобранной из угольной фации группы раков, достигает -230 ‰, тогда как нефти, отобранной из водорослевой фации той же группы, составляет около -100 ‰. Такие огромные различия трудно объяснить какими-либо другими причинами, кроме отделения Австралии от антарктического континента в позднем меловом периоде. Другой особый случай, описанный xiong et al. изучили карбонаты ордовика из бассейна Бохайского залива. Они обнаружили, что существуют большие различия между δD н-алканов, отражающие то, что исходный сигнал сохраняется, а не гомогенизируется. Результат неочевиден, поскольку образец очень зрелый (предполагаемый коэффициент отражения витринита R 0 до 2,3). Таким образом, это убедительное доказательство того, что карбонатные системы имеют гораздо более низкую каталитическую эффективность водородного обмена на углеводородах. Сильное обогащение (~ 40 ‰) алканов с нечетным углеродным номером до алканов с четным углеродным номером также обнаружено в некоторых подмножествах образцов, и причина этого на данный момент неясна. Этот эффект нечетно-четного наблюдается и в незрелых обломочных отложениях.
Область экогидрологии занимается взаимодействием между экосистемами и круговоротом воды, от измерения мелкомасштабного дренажа воды в почву до отслеживания широких движений воды, испаряющейся с деревьев. Поскольку дейтерий действует как консервативный индикатор, он хорошо работает для отслеживания движения воды через растения и экосистемы. Хотя движение воды в однопроцессных явлениях, таких как испарение, относительно просто отследить, многие системы (например, облачные леса ) в окружающей среде имеют несколько источников, и отслеживание движения воды становится более сложным. Добавление изотопов также может быть выполнено для определения переноса воды через почву в растения путем закачки дейтерированной воды непосредственно в землю.
Анализ стабильных изотопов ксилемной воды можно использовать для отслеживания движения воды из почвы в растения и, следовательно, для регистрации глубины поглощения воды. Преимущество использования ксилемной воды состоит в том, что теоретически содержание дейтерия должно напрямую отражать поступающую воду, не подвергаясь транспирации листьев. Например, Доусон и Элерингер использовали этот подход, чтобы определить, используют ли деревья, растущие рядом с ручьями, поверхностные воды этого ручья. Вода с поверхности будет иметь тот же изотопный состав, что и поток, в то время как вода, идущая дальше под землей, будет из прошлых осадков. В этом случае более молодые деревья имели изотопный состав воды ксилемы, очень близкий к соседнему ручью, и, вероятно, использовали поверхностные воды для укоренения. Более старые деревья истощили ксилемную воду по сравнению с ручьем, что свидетельствует о том, что они получают воду из более глубоких подземелий. Другие исследования стабильных изотопов также показали, что растения в лесах из секвойи не просто поглощают воду из своих корней, но получают значительную долю воды через устьичное поглощение листьями.
Вода растений может использоваться для характеристики других физиологических процессов растений, влияющих на гидрологический цикл ; например, листовые воды широко используются для моделирования транспирации и эффективности водопользования. Что касается транспирации, то экспериментально выяснилось, что модель Крейга-Гордона для обогащения воды в озере за счет испарения хорошо подходит для моделирования обогащения воды в листьях. Транспирацию можно измерить путем прямого впрыска дейтерированной воды в основание дерева, улавливая весь водяной пар, выходящий из листьев, и измеряя последующий конденсат. Использование воды также можно измерить и рассчитать по закачке тяжелой воды следующим образом:
Где WU - потребление воды в килограммах / день, M - масса закачанной дейтерированной воды в граммах, T - последний день эксперимента, C i - концентрация дейтерия в интервале времени i в граммах / килограмм, а Δt i - длина временного интервала i в днях. Хотя расчетное потребление воды с помощью зондирования рассеяния тепла некоторых тропических растений, таких как бамбук, сильно коррелирует с измеренным использованием воды, определенным путем отслеживания движения D 2 O, точные значения не совпадают. Фактически, у бобовых видов деревьев Gliricidia sepium, производящих сердцевину, просачиваемая вода даже не сильно коррелировала с концентрациями введенного D 2 O, что еще больше усложнило бы измерения водопотребления с помощью прямых инъекций. Возможно, это произошло потому, что сердцевина могла накапливать тяжелую воду, а не перемещать воду непосредственно через ксилему к листьям.
Эффективность водопользования (WUE), которая представляет собой отношение фиксации углерода к транспирации, ранее была связана с отношениями 13 C / 12 C с использованием следующего уравнения:
В этом уравнении
, φ - вдыхаемая доля связанного углерода, p CO 2парциальное давление CO 2в атмосфере ε carb - фракционирование карбоксилирования, а ε diff - фракционирование диффузии в воздухе. Отношение δD в восках листьев растений к δ 13 Cбыл измерен эмпирически и дает отрицательную корреляцию между δD и эффективностью использования воды. Частично это можно объяснить тем, что более низкая эффективность водопользования связана с более высокими показателями транспирации. Транспирация проявляет нормальный изотопный эффект, вызывая обогащение воды листьев растений дейтерием и, следовательно, обогащение восков листьев.
Изобилие дейтерия может быть полезно для отслеживания миграции различных животных. Животные с метаболически инертной тканью (например, перьями или волосами) будут синтезировать эту ткань, используя водород из исходной воды и пищи, но в идеале не будут включать последующую воду в ходе миграции. Поскольку δD имеет тенденцию меняться географически, разница между δD тканей животных и δD воды после миграции после учета биологического фракционирования ассимиляции может предоставить информацию о перемещении животных. В монарх бабочек, например, крыло хитин является метаболический инертным после того, как он был построен, так что он может отражать изотопный состав окружающей воды в то время и место роста крыла. Затем создается запись о происхождении бабочки, которую можно использовать для определения расстояния миграции. Этот подход также можно использовать для летучих мышей и птиц, используя волосы и перья соответственно. Поскольку дождевая вода истощается по мере увеличения высоты, этот метод также может отслеживать высотную миграцию. Однако это технически сложно сделать, а разрешение кажется слишком низким для отслеживания небольших высотных изменений. Дейтерий наиболее полезен для отслеживания перемещения видов между районами с большими вариациями континентальных вод, поскольку перемещение видов может быть затруднено из-за сходства локальных значений δD воды в разных географических регионах. Например, исходная вода из Нижней Калифорнии может иметь такое же δD, что и вода из штата Мэн. Кроме того, часть изотопного состава водорода в ткани может обмениваться с водой и усложнять интерпретацию измерений. Чтобы определить этот процент изотопного обмена, который варьируется в зависимости от местного уровня влажности, могут быть сконструированы стандарты метаболически инертной ткани интересующего вида и уравновешены с местными условиями. Это позволяет сравнивать измеренные δD из разных географических регионов друг с другом.
Ассимиляция диеты в ткани имеет тканеспецифическое фракционирование, известное как фактор трофической дискриминации. Источники питания можно отслеживать через пищевую сеть с помощью профилей изотопов дейтерия, хотя это осложняется тем, что дейтерий имеет два потенциальных источника - воду и пищу. Пища сильнее влияет на δD, чем обмен с окружающей водой, и этот сигнал виден на всех трофических уровнях. Однако разные организмы получают органический водород в разном соотношении воды к пище: например, у перепелов 20-30% органического водорода было из воды, а остальное - из пищи. Точный процент водорода из воды зависел от источника ткани и метаболической активности. У хирономид 31-47% водорода биомассы, полученного из воды, а у микробов до 100% водорода жирных кислот может быть получено из воды в зависимости от субстрата. У гусениц δD рациона из органического вещества линейно коррелирует с δD ткани. Однако такая же взаимосвязь, по-видимому, не соблюдается для рациона δD из воды - вода, полученная либо от гусеницы, либо от ее кормового растения, более обогащена дейтерием, чем их органический материал. Повышение трофических уровней от добычи (растения) до хищника (гусеницы) приводит к изотопному обогащению. Та же тенденция к обогащению наблюдается у многих других животных - плотоядных, всеядных и травоядных - и, по-видимому, соответствует относительной численности 15 N. Плотоядные животные на одном и том же трофическом уровне, как правило, демонстрируют одинаковый уровень обогащения 2 H. Поскольку, как упоминалось ранее, количество органического водорода, производимого из воды, варьируется между видами, модель трофического уровня, связанного с абсолютным фракционированием, трудно создать, если участвующие виды неизвестны. Последовательность измерения одних и тех же тканей также важна, поскольку разные ткани фракционируют дейтерий по-разному. В водных системах отслеживание трофических взаимодействий ценно не только для понимания экологии системы, но и для определения степени воздействия суши. Модели обогащения дейтерием, согласованные на трофических уровнях, являются полезным инструментом для оценки природы этих взаимодействий в окружающей среде.
Биологическое фракционирование дейтерия посредством метаболизма в значительной степени зависит от организма и пути обмена, что приводит к широкому разнообразию фракций. Несмотря на это, некоторые тенденции сохраняются. Изотопы водорода имеют тенденцию к очень сильному фракционированию у автотрофов по сравнению с гетеротрофами во время биосинтеза липидов - хемоавтотрофы производят чрезвычайно обедненные липиды с фракционированием в диапазоне примерно от -200 до -400 ‰. Это наблюдалось как в лабораторных культурах, которым давали известное количество дейтерированной воды, так и в окружающей среде. Белки, однако, не имеют такой значительной тенденции, поскольку как гетеротрофы, так и автотрофы способны генерировать большие и переменные фракции. Частично кинетическое фракционирование более легкого изотопа во время образования восстанавливающих эквивалентов НАДН и НАДФН приводит к получению липидов и белков, которые изотопно легче.
Соленость, по-видимому, также играет роль в степени фракционирования дейтерия; более соленая вода влияет на скорость роста, скорость водородного обмена и скорость испарения. Все эти факторы влияют на δD липидов на включение водорода в биомассу. В кокколитофорид Emiliania huxleyi и Gephyrocapsa Oceanica, alkenone δD Было обнаружено, что сильно коррелирует с темпом роста организма, деленной на солености. Взаимосвязь между фракционированием дейтерия и соленостью потенциально может быть использована при реконструкции палеосреды с сохранением липидов в летописи горных пород для определения, например, солености океана во время роста организмов. Однако степень фракционирования не обязательно одинакова для разных организмов, что усложняет определение палеозолености этим методом. Также, по-видимому, существует отрицательная корреляция между скоростью роста и фракционированием этих кокколитофорид. Дальнейшие эксперименты с одноклеточными водорослями Eudorina unicocca и Volvox aureus не показали влияния скорости роста (контролируемого ограничением азота) на δD жирных кислот. Однако стеролы становятся более обедненными по D по мере увеличения скорости роста, что согласуется с изотопным составом алкенона в кокколитофоридах. В целом, хотя есть некоторые сильные тенденции в отношении δD липидов, конкретные фракции являются специфическими для соединения. В результате любая попытка создать соломер с помощью измерений δD обязательно будет относиться к одному типу соединения.
Важной целью химии окружающей среды является отслеживание источника и разложения загрязнителей. Для снятия отпечатков пальцев с пулов загрязнителей окружающей среды использовались различные методы, такие как общий химический состав разлива, изотопные отношения основной химической смеси или изотопные отношения отдельных составляющих соединений. Стабильные изотопы углерода и водорода можно использовать в качестве дополнительных методов снятия отпечатков пальцев для природного газа. Недавно отношение D / H углеводородов из разлива нефти Deepwater Horizon было использовано для подтверждения того, что их происхождение было вероятным из скважины Macondo. Отношения изотопов водорода также использовались в качестве меры относительного количества биоразложения, которое произошло в нефтяных резервуарах в Китае, а исследования чистых культур организмов, разлагающих н-алкан, показали зависимость длины цепи от количества фракционирования изотопов водорода. во время деградации. Дополнительные исследования также показали влияние изотопов водорода на разложение метил-трет-бутилового эфира и толуола, которые были предложены как полезные при оценке уровня разложения этих загрязняющих соединений в окружающей среде. В обоих случаях остаточные непрореагировавшие соединения обогащались дейтерием до нескольких десятков промилле, с вариациями между различными организмами и степенью полноты реакции. Эти наблюдения тяжелых остаточных соединений были применены для полевых наблюдений за реакциями биоразложения, такими как удаление бензола и этилбензола, которые дали фракционирование D / H 27 и 50 промилле соответственно. Кроме того, анализ о-ксилола на загрязненном участке показал высокие остаточные отношения D / H после биодеградации, что согласуется с активацией связей CH, которая является этапом, ограничивающим скорость в этом процессе.
Стабильные соотношения изотопов находят применение в различных случаях, когда под сомнение ставится подлинность или происхождение химического соединения. Такие ситуации включают оценку подлинности еды, вина и натуральных ароматов; скрининг на наркотики в спорте (см. допинг ); фармацевтические препараты; запрещенные наркотики; и даже помощь в опознании человеческих останков. В этих случаях часто бывает недостаточно обнаружить или количественно определить определенное соединение, поскольку вопрос заключается в происхождении соединения. Сила изотопного анализа водорода в ответе на эти вопросы заключается в том, что во многих случаях отношение D / H природного продукта связано со значениями D / H природной воды в районе, где был образован продукт (см. Гидрологический цикл). Поскольку отношения D / H значительно различаются в разных географических регионах, это может служить мощным инструментом для определения первоначального источника множества различных веществ.
Продукты питания, ароматизаторы и ароматизаторы часто продаются с гарантией того, что химические добавки происходят из натуральных источников. Это утверждение становится трудно оценить, когда химическое соединение имеет известную структуру и легко синтезируется в лаборатории. При проверке подлинности заявлений о происхождении этих химикатов хорошо использовались различные стабильные изотопы, включая изотопы водорода. Комбинированный анализ изотопов углерода и водорода использовался для проверки подлинности (E) -метилциннамата, γ-декалактона и δ-декалактона. Соотношения изотопов водорода и азота использовались для аутентификации алкилпиразинов, используемых в качестве «натуральных» ароматизаторов кофе.
Изотопное соотношение углерода в стероидах спортсменов использовалось для определения того, происходят ли эти стероиды из тела спортсмена или из экзогенного источника. Этот тест использовался в ряде громких антидопинговых дел и имеет различные преимущества по сравнению с простым измерением концентрации различных соединений. Предпринимаются попытки создать аналогичные тесты на основе стабильных изотопов водорода, которые можно было бы использовать в дополнение к существующим методам тестирования. Одна из проблем, связанных с этим методом, заключалась в том, что натуральные стероиды, производимые человеческим организмом, могут значительно различаться в зависимости от содержания дейтерия в питьевой воде, что приводит к ложному обнаружению допинга на основе различий изотопов водорода. Эта проблема была рассмотрена в недавнем исследовании, в котором сделан вывод о том, что влияние отношения D / H питьевой воды не является непреодолимым источником ошибок для этой стратегии антидопингового тестирования.
Фармацевтическая промышленность имеет доходы в сотни миллиардов долларов в год во всем мире. С такой большой промышленностью подделка и нарушение авторских прав представляют собой серьезные проблемы, и снятие отпечатков пальцев изотопов водорода стало полезным инструментом для проверки подлинности различных лекарств. Как описано в предыдущих разделах, полезность соотношений D / H наиболее высока в сочетании с измерениями других соотношений изотопов. В раннем исследовании состава стабильных изотопов тропикамида, гидрокортизона, хинина и триптофана, стабильные изотопы углерода, азота, кислорода и водорода были проанализированы с помощью EA-IRMS, и удалось провести четкие различия между производителями и даже партиями препаратов на основе по их изотопным сигнатурам. В этом исследовании было определено, что соотношения изотопов водорода и кислорода были двумя лучшими «отпечатками пальцев» для различения различных источников лекарств. Последующее исследование, посвященное анализу напроксена из различных партий и производителей, также показало аналогичную способность различать источники лекарств. Эти изотопные сигнатуры можно использовать не только для различения разных производителей, но и для различения различных путей синтеза одного и того же соединения. Эти исследования основывались на естественных вариациях, происходящих при синтезе этих лекарств, но в других исследованиях использовались исходные ингредиенты, которые намеренно помечены как D и 13C, и было показано, что эти метки могут быть прослежены в конечном фармацевтическом продукте. Отношения D / H также могут быть определены для конкретных участков в лекарстве с помощью 2H ЯМР и использовались для различения различных методов синтеза ибупрофена и напроксена в одном исследовании и прозака и флуоксетина в другом. Эти исследования показывают, что информация об общем соотношении D / H для EA-IRMS и сайт-специфические отношения D / H из 2H ЯМР имеют большую полезность для тестирования подлинности фармацевтических препаратов.
Источники и механизмы производства незаконных наркотиков - еще одна область, в которой успешно применяется характеристика изотопов водорода. Обычно, как и в случае с другими применениями методов стабильных изотопов, наилучшие результаты достигаются, когда комбинация нескольких стабильных изотопов сравнивается друг с другом. δ 2 H, δ 13 C и δ 15 N использовались вместе для анализа таблеток МДА и МДМА и успешно выявили различия, которые можно использовать для различения различных источников или механизмов производства. Такая же комбинация стабильных изотопов с добавлением δ 18 O применялась к героину и связанной с ним упаковке, и с ее помощью можно было успешно различать разные образцы. Анализ с использованием дейтериевого ЯМР также позволил пролить свет на происхождение и переработку как кокаина, так и героина. В случае героина эта сайт-специфическая природная изотопная фракция, измеренная методом ЯМР дейтерия (SNIF-ЯМР), может быть использована для определения географического происхождения молекулы путем анализа так называемых природных сайтов (которые присутствовали в морфине, из которого героин производится), а также получение информации о процессе синтеза путем анализа искусственных сайтов (добавленных в процессе обработки лекарств).
Географические различия в соотношении D / H в питьевой воде человека регистрируются в волосах. Исследования показали очень сильную связь между соотношением D / H между волосами и питьевой водой.
Поскольку соотношение D / H в водопроводной воде сильно зависит от географического положения, соотношение D / H волос человека можно использовать для определения регионов, в которых они, скорее всего, жили во время роста волос. Эта идея использовалась в уголовных расследованиях, чтобы попытаться ограничить передвижения человека до его смерти, почти так же, как соотношение D / H использовалось для отслеживания миграций животных. Анализируя участки волос разного возраста, можно определить, в каких областях D / H человек жил в определенное время до своей смерти.