| Вирус герпеса человека 6 | |
|---|---|
 | |
| Электронная микрофотография одного из видов HHV6 | |
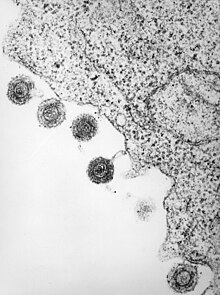 | |
| HHV-6 высвобождается из инфицированного лимфоцита | |
| Научная классификация | |
| (без рейтинга): | Вирус |
| Царство: | Дуплоднавирия |
| Королевство: | Heunggongvirae |
| Тип: | Пепловирикота |
| Класс: | Herviviricetes |
| Порядок: | Герпесвиралес |
| Семья: | Herpesviridae |
| Подсемейство: | Betaherpesvirinae |
| Род: | Розеоловирус |
| Включенные группы | |
| Кладистически включенные, но традиционно исключенные таксоны | |
| Все остальные виды Roseolovirus: | |
Человеческий герпесвирус 6 ( HHV-6) - это общее собирательное название для человеческого бета- герпесвируса 6A (HHV-6A) и человеческого бета-герпесвируса 6B (HHV-6B). Эти близкородственные вирусы являются двумя из девяти известных вирусов герпеса человека, герпесвирусов, основным хозяином которых является человек.
HHV-6A и HHV-6B представляют собой двухцепочечные ДНК-вирусы в подсемействе Betaherpesvirinae и рода Roseolovirus. HHV-6A и HHV-6B инфицируют почти все протестированные человеческие популяции.
HHV-6A был описан как более нейровирулентный и поэтому чаще обнаруживается у пациентов с нейровоспалительными заболеваниями, такими как рассеянный склероз. Уровни HHV-6 (и HHV-7) в головном мозге также повышены у людей с болезнью Альцгеймера.
Первичная инфекция HHV-6B является причиной распространенной детской болезни exanthema subitum (также известной как младенческая розеола или шестая болезнь). Он передается от ребенка к ребенку. Взрослые редко заражаются этой болезнью, поскольку большинство людей заразились ею в детском саду, и после заражения возникает иммунитет, который предотвращает повторное заражение в будущем. Кроме того, у реципиентов трансплантата часто встречается реактивация HHV-6B, которая может вызывать несколько клинических проявлений, таких как энцефалит, угнетение костного мозга и пневмонит.
Для обнаружения HHV-6 используются различные тесты, некоторые из которых не позволяют дифференцировать эти два вида.
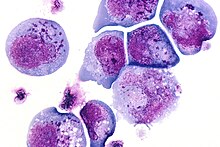 Гистологический слайд вируса герпеса-6 человека показывает инфицированные клетки с тельцами включения как в ядре, так и в цитоплазме. Слайд окрашен Hamp;E.
Гистологический слайд вируса герпеса-6 человека показывает инфицированные клетки с тельцами включения как в ядре, так и в цитоплазме. Слайд окрашен Hamp;E. В 1986 году Сайед Заки Салахуддин, Дхарам Аблаши и Роберт Галло культивировали мононуклеарные клетки периферической крови пациентов со СПИДом и лимфопролиферативными заболеваниями. Были зарегистрированы короткоживущие, большие, рефрактильные клетки, которые часто содержали внутриядерные и / или внутрицитоплазматические тельца включения. Электронная микроскопия показала новый вирус, который они назвали В-лимфотрофным вирусом человека (HBLV).
Вскоре после его открытия Ablashi et al. описали пять клеточных линий, которые могут быть инфицированы недавно обнаруженным HBLV. Они опубликовали, что HSB-2, определенная линия Т-клеток, очень восприимчива к инфекции. Новаторское исследование Аблаши завершилось предложением изменить название вируса с HBLV на HHV-6 в соответствии с опубликованной предварительной классификацией вирусов герпеса.
Спустя годы HHV-6 был разделен на подтипы. Раннее исследование (1992) описало два очень похожих, но уникальных варианта: HHV-6A и HHV-6B. Это различие было оправдано благодаря уникальным расщеплениям эндонуклеазами рестрикции, реакциям моноклональных антител и моделям роста.
HHV-6A включает несколько штаммов, происходящих от взрослых, и спектр его заболеваний не определен, хотя некоторые считают его более нейровирулентным. HHV-6B обычно выявляется у детей с младенческой розеолой, поскольку он является этиологическим агентом этого состояния. Внутри этих двух вирусов гомология последовательностей составляет 95%.
В 2012 году HHV-6A и HHV-6B были официально признаны отдельными видами.
HHV-6A и HHV-6B были признаны Международным комитетом по таксономии вирусов (ICTV) отдельными видами в 2012 году. Розеоловирусы человека включают HHV-6A, HHV-6B и HHV-7.
Герпесвирус был установлен как род в 1971 году в первом отчете ICTV. Этот род состоял из 23 вирусов из 4 групп. В 1976 году был выпущен второй отчет ICTV, в котором этот род был повышен до уровня семейства - herpetoviridae. Из-за возможной путаницы с вирусами, полученными от рептилий, фамилия была изменена в третьем отчете (1979) на herpesviridae. В этом отчете семейство Herpesviridae было разделено на 3 подсемейства ( alphaherpesvirinae, betaherpesvirinae и gammaherpesvirinae) и 5 безымянных родов; 21 вирус был признан членом семейства.
В 2009 году создан отряд Herpesvirales. Это было вызвано открытием того факта, что вирусы герпеса рыб и моллюсков лишь отдаленно родственны вирусам птиц и млекопитающих. Отряд Herpesvirales включает три семейства: Herpesviridae, которое содержит давно признанные герпесвирусы млекопитающих, птиц и рептилий, а также два новых семейства - семейство Alloherpesviridae, которое включает вирусы герпеса костистых рыб и лягушек, и семейство Malacoherpesviridae, которое содержит вирусы моллюски.
По состоянию на 2012 г. в этом отряде в настоящее время насчитывается 3 семейства, 4 подсемейства (1 не назначено), 18 родов (4 не назначено) и 97 видов.
Диаметр вириона HHV-6 составляет около 2000 ангстрем. Внешняя часть вириона состоит из двухслойной липидной мембраны, которая содержит вирусные гликопротеины и происходит от мембраны хозяина. Под этой оболочкой мембраны находится тегумент, который окружает икосаэдрический капсид, состоящий из 162 капсомеров. Защитный капсид HHV-6 содержит двухцепочечную линейную ДНК.
Во время созревания вирионов HHV-6 человеческие клеточные мембраны используются для формирования вирусных липидных оболочек (что характерно для всех оболочечных вирусов). Во время этого процесса HHV-6 использует липидные рафты, которые представляют собой мембранные микродомены, обогащенные холестерином, сфинголипидами и белками, заякоренными гликозилфосфатидилинозитолом. Ранние исследователи подозревали, что вирионы HHV-6 созревают в ядре; некоторые даже неправильно опубликовали это, поскольку они обобщили и применили к HHV-6 то, что было известно о других вирусах. Однако исследование, опубликованное в 2009 году, предполагает, что вирус HHV-6 использует для сборки везикулы, происходящие из сети Гольджи.
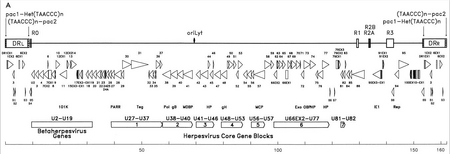 Геном HHV-6B от Dominguez et al. 1999 г.
Геном HHV-6B от Dominguez et al. 1999 г. Генетический материал HHV-6 состоит из линейной (кольцевой во время активной инфекции) двухцепочечной ДНК, которая содержит начало репликации, два левых и правых конца прямых повторов размером 8–10 т.п.н., а также уникальный сегмент размером 143–145 т.п.н..
Источник репликации (часто обозначаемый в литературе как «oriLyt») - это место, где начинается репликация ДНК. Концы прямого повтора (DR L и DR R) обладают повторяющейся последовательностью TTAGGG, идентичной последовательности теломер человека. Вариабельность количества теломерных повторов наблюдается в диапазоне 15–180. Эти концы также содержат сигналы расщепления и упаковки pac-1 и pac-2, которые являются консервативными среди герпесвирусов.
Уникальный сегмент содержит семь основных блоков основных генов (U27 – U37, U38 – U40, U41 – U46, U48 – U53, U56 – U57, U66EX2 – U77 и U81 – U82), что также характерно для герпесвирусов. Эти консервативные гены кодируют белки, которые участвуют в репликации, расщеплении и упаковке вирусного генома в зрелый вирион. Кроме того, они кодируют ряд иммуномодулирующих белков. Уникальный сегмент также содержит блок генов (U2 – U19), консервативных среди вирусов HHV-6, HHV-7 и цитомегаловирусов (бета-герпесвирусов). Ряд уникальных сегментных генов связан, например, с семейством HCMV US22 ( InterPro : IPR003360 ). В таблице ниже представлены некоторые из их известных свойств.
| Ген | Этап | Характеристики |
|---|---|---|
| IE-A (IE1? U89?) | Немедленно рано | Часть локуса IE - нарушает экспрессию гена интерферона, чтобы ограничить развитие клеточных противовирусных мер, способствуя успешному заражению - не в мембране - активирует вирусные ДНК-полимеразы, участвующие в репликации по кругу - экспрессия этого гена может модулироваться микро РНК |
| IE-B | Немедленно рано | Часть локуса IE Активирует вирусные ДНК-полимеразы, участвующие в репликации катящегося круга |
| DR1 | Семейство генов HCMV US22 | |
| DR6 | Семейство генов HCMV US22, трансактиватор, онкоген | |
| DR7 / U1 | Домен SR, злокачественная трансформирующая активность, связывается с p53 | |
| U2 | Семейство генов HCMV US22 - белок тегумента | |
| U3 | Гомолог UL24 HCMV, семейство генов US22 HCMV, белок тегумента - трансактивирующая активность | |
| U4 | Устойчивость HCMV к марибавиру | |
| U7 | Семейство генов HCMV US22 | |
| U10 | семейство dUTPase | |
| U11 | Сильно иммунореактивный белок вириона - антигенный белок тегумента | |
| U12 | Хемокин G-рецептор, связанный с белком | |
| U13 | CMV: подавляет транскрипцию US3 | |
| U14 | Связывает и включает p53 в вирусные частицы - семейство генов UL25 HCMV - антигенный белок тегумента | |
| U15 | Семейство генов UL25 HCMV | |
| U17 | Семейство генов HCMV UL25 - белок тегумента | |
| U18 | IE-B | Мембранный гликопротеин |
| U19 | Белок IE-B | Гликопротеин |
| U20 | Гликопротеин (специфичный для розеоловируса) предсказал структуру иммуноглобулина | |
| U21 | Связывается с молекулами MHC-1 и предотвращает представление антигенпрезентирующими клетками пептидов HHV-6 - гликопротеина, подавляет HLA I (специфичный для розеоловируса) | |
| U22 | Поздний ген | Гликопротеин (отсутствует в HHV-7, специфичен для розеоловируса) |
| U23 | Гликопротеин (специфичный для розеоловируса ) | |
| U24 | Подавляет правильную активацию Т-клеток, снижая секрецию цитокинов в месте инфекции - мишень фосфорилирования для киназ - гликопротеин M (gM) (специфичный для розеоловируса ) | |
| U25 | Семейство генов UL22 HCMV, белок тегумента | |
| U26 | Предполагаемый множественный трансмембранный белок | |
| U27 | Фабрика процессивности ДНК-полимеразы | |
| U28 | Большая субъединица рибонуклеотидредуктазы, белок тегумента | |
| U29 | Сборка капсида и созревание ДНК | |
| U30 | Белок тегумента | |
| U31 | Большой белок тегумента | |
| U32 | Капсидный белок, гексоновые наконечники | |
| U33 | Белок вириона | |
| U34 | Мембранно-ассоциированный фосфопротеин, первичная оболочка | |
| U35 | Компонент терминазы, упаковка ДНК | |
| U36 | Упаковка ДНК | |
| U37 | Белок тегумента, первичная оболочка, фосфопротеин | |
| U38 | ДНК-полимераза | |
| U39 (GB, GP116) | Гликопротеин | |
| U40 | Транспорт, сборка капсида | |
| U41 | Ранний ген | Главный ДНК-связывающий белок |
| U42 | Белок тегумента, блок клеточного цикла, трансактиватор | |
| U43 | Комплекс ДНК- геликаза-примаза | |
| U44 | Белок тегумента | |
| U45 | dUTPase | |
| U46 | Гликопротеин N, мембранный белок | |
| U47 (gO, O) | Гликопротеин O, ассоциированный с липидными рафтами, существует в двух формах, gO-120K и gO-80K, а gO-80K содержит N-связанные олигосахариды сложного типа, которые включены в вирусные частицы. | |
| U48 (gH, gp100) | Гликопротеин gH, составляющая вириона, часть лигандного комплекса CD46 gQ1 / gQ2 / gL / gH, ассоциирует с липидными рафтами | |
| U49 | Связанный с вирионом регуляторный белок, гибридный белок | |
| U50 | Упаковка ДНК | |
| U51 | Ранний ген | Хемокиновый рецептор, связанный с G-белком, предотвращая экспрессию, значительно снижает репликацию - увеличивает внутриклеточные уровни вторичного мессенджера инозитолфосфата, способствует хемотаксису - ранний ген, наряду с U41 и U69 |
| U52 | ||
| U53 | Протеаза, белок сборки капсида | |
| U54 | Белок тегумента, трансактиватор вириона | |
| U55 | Роль в синтезе РНК, dUTPase | |
| U56 | Капсидный белок | |
| U57 | Основной белок капсида | |
| U58 | ||
| U59 | Белок тегумента | |
| U61 | ||
| U62 | ||
| U63 | ||
| U64 | Упаковка ДНК: белок тегумента | |
| U65 | Белок тегумента | |
| U66 | Компонент Terminase | |
| U69 | Ранний ген | Тегументная протеинкиназа (ганцикловиркиназа) участвует в репликации |
| U70 | Щелочная экзонуклеаза | |
| U71 | Миристилированный белок вириона | |
| U72 (gM) | Гликопротеин М | |
| U73 | Связывающий белок | |
| U74 | Комплекс ДНК-хеликаза-примаза | |
| U75 | Белок тегумента | |
| U76 | Упаковка ДНК, вирионный белок | |
| U77 | Комплекс геликаза-примаза | |
| U79 | Активация транскрипции | |
| U80 | Прогнозируемая структура иммуноглобулина | |
| U81 | Урацил-ДНК гликозилаза | |
| U82 (gL, gp80) | Гликопротеин L, составляющая вириона, часть лигандного комплекса CD46 gQ1 / gQ2 / gL / gH, ассоциирует с липидными рафтами | |
| U83 | Секретируемый хемотаксический (хемоаттрактант) гликопротеин, связывается с рецепторами хемокинов, рекрутирует клетки-хозяева, которые секретируют хемокины, специфичные для U51 | |
| U85 | Гликопротеин (специфичный для розеоловируса) | |
| U86 | IE-2 | Трансактиватор IE-2 |
| U88 | IE-A | |
| U90 | IE-A (IE 1) | Трансактиватор |
| U91 | IE-A, гликопротеин | |
| U94 | Латентность (немедленный или ранний ген) | Участвует в репрессии транскрипции литических генов - способствует специфической интеграции HHV-6A / HHV-6B в теломеры - высоко экспрессируется в латентный период - гомолог реповируса парвовируса (отсутствует в HHV-7) |
| U95 | Семейство генов CMV US22 - колокализуется и взаимодействует с митохондриальным белком GRIM-19, важным компонентом системы окислительного фосфорилирования - связывается с ядерным фактором каппа B (NF-κB), нарушение регуляции которого, как предполагается, способствует развитию рака. | |
| У100 (ГП82-105) | Поздний ген | Гликопротеин Q, составляющий вирион, ассоциирует с липидными рафтами |
| gQ1 | Гликопротеин, комплексы с gH и gL с образованием вирусного лиганда рецептора CD46 - модифицированные N-гликозилированием - экспрессируются только в двух разных формах: форме 80 кДа (gQ1-80K) и форме 74 кДа (gQ1-74K) - только gQ1-80K, но не gQ1-74K, образует комплекс лиганда CD46 с gQ2, gH и ассоциатами gL с липидными рафтами. | |
| gM1 | Ганглиозид, специфичный для липидных рафтов, включен в вирион | |
| gQ2 | Гликопротеин, образует комплекс gH / gL / gQ1 / gQ2, часть лиганда рецептора - необходимая для роста вируса, ассоциируется с липидными рафтами - существует в двух формах: gQ2-34K и gQ2-37K. | |
| Микро РНК | hhv6b-miR-Ro6-1, -Ro6-2, -Ro6-3 и -Ro6-4. Может регулировать раннюю транскрипцию | |
| P100 он же p101 | Иммуногенный, входящий в состав тегумента | |
| ORF-1 (DR7) | Связывает и подавляет транскрипционную активность p53 - может трансформировать эпидермальные кератиноциты человека и клетки NIH 3T3 in vitro - клетки, экспрессирующие белок ORF-1, образуют фибросаркомы при введении голым мышам |
Когда внеклеточный вирион HHV-6 встречается с клетками человека, он сталкивается с дифференцировочным кластером 46 рецепторного белка человека ( CD46 ), который играет роль в регуляции системы комплемента. Белок CD46 обладает единственной вариабельной областью в результате альтернативного сплайсинга. Таким образом, существует по крайней мере четырнадцать изоформ CD46, каждая из которых связывает HHV-6a.
Внеклеточная область CD46 содержит четыре коротких консенсусных повтора из примерно 60 аминокислот, которые складываются в компактный бета-бочкообразный домен, окруженный гибкими петлями. Как было продемонстрировано для CD46 с другими лигандами, структура белка CD46 линеаризуется при связывании HHV-6. Хотя их точное взаимодействие еще не определено, было продемонстрировано, что второй и третий домены SCR необходимы для связывания рецептора HHV-6 и входа в клетку.
Mori et al. впервые идентифицировали продукт гена gQ1, гликопротеин, уникальный для HHV-6, и обнаружили, что он образует комплекс с гликопротеинами gH и gL. Они полагали, что этот комплекс гетеротримеров служит вирусным лигандом для CD46. Вскоре после этого был идентифицирован другой гликопротеин, названный gQ2, и было обнаружено, что он является частью комплекса лиганд gH / gL / gQ1, образуя гетеротетрамер, который был положительно идентифицирован как вирусный лиганд CD46. Точный процесс входа еще не совсем понятен.
Слюнные железы описаны как резервуар in vivo для инфекции HHV-6.
Исследователи провели исследование, чтобы показать, что Т-клетки очень подвержены заражению HHV-6.
В течение 2011 года исследователи из Национального института здоровья попытались выяснить неизвестный тогда метод, посредством которого HHV-6a проникает в нервную систему. Таким образом, они вскрыли мозг около 150 человек. Когда различные анатомические области были проанализированы на их вирусную нагрузку, было обнаружено, что обонятельные ткани имеют самое высокое содержание HHV-6. Они пришли к выводу, что эти ткани являются отправной точкой для HHV-6a.
Приведенные выше результаты согласуются с результатами предыдущих исследований, в которых участвовал HSV-1 (и ряд других вирусов), который также распространяется в ЦНС через обонятельную ткань.
Исследователи также выдвинули гипотезу о том, что обонятельные клетки (OEC), группа специализированных глиальных клеток, обнаруженных в полости носа, могут играть роль в инфекционности HHV-6. Они заподозрили эту связь в результате того, что OEC обладают свойствами, аналогичными свойствам астроцитов, другого типа глиальных клеток, которые ранее были идентифицированы как восприимчивые к инфекции HHV-6. Исследования продолжались путем заражения OEC in vitro обоими типами HHV-6. В конечном счете, только OEC, в которых использовался HHV-6a, дали положительный результат на признаки вирусного синтеза de novo, что также характерно для астроцитов.
При попадании внутрь описаны два исхода: активные и неактивные инфекции.
Активные инфекции включают циркуляризацию линейного генома дцДНК за счет ковалентных связей конец-конец. Впервые об этом процессе сообщили для вируса простого герпеса. После циркуляризации HHV-6 начинает экспрессировать так называемые «немедленные» гены. Эти генные продукты считаются активаторами транскрипции и могут регулироваться экспрессией вирусных микроРНК. Затем происходит последующая экспрессия «ранних генов», которая активирует, например, вирусные ДНК-полимеразы. Ранние гены также участвуют в последующей репликации по катящемуся кругу.
Репликация HHV-6 приводит к образованию конкатемеров, которые представляют собой длинные молекулы, содержащие несколько повторов последовательности ДНК. Эти длинные конкатемеры затем расщепляются между участками pac-1 и pac-2 рибозимами для упаковки генома в отдельные вирионы.
Не все вновь инфицированные клетки начинают репликацию по катящемуся кругу. Герпесвирусы могут перейти в латентную стадию, неактивно заражая своего человеческого хозяина. С момента открытия в 1993 году это явление было обнаружено среди всех бета-герпесвирусов.
Другие бета-герпесвирусы устанавливают латентный период в виде ядерной эписомы, которая представляет собой кольцевую молекулу ДНК (аналогичную плазмидам ). Считается, что для HHV-6 латентность происходит исключительно за счет интеграции вирусных теломерных повторов в субтеломерные области человека. Известно, что только один другой вирус, вирус болезни Марека, достигает латентного периода таким образом. Это явление возможно в результате наличия теломерных повторов на концах прямых повторов генома HHV-6.
Правый конец прямого повтора интегрируется в пределах от 5 до 41 повтора теломер человека, и предпочтительно делает это в проксимальном конце хромосом 9, 17, 18, 19 и 22, но также иногда обнаруживается в хромосомах 10 и 11. Почти 70 миллионов. подозревается, что люди являются носителями хромосомно интегрированного HHV-6.
Ряд генов, экспрессируемых HHV-6, уникален для его неактивной латентной стадии. Эти гены включают поддержание генома и предотвращение разрушения клетки-хозяина. Например, считается, что белок U94 подавляет гены, которые участвуют в клеточном лизисе (апоптозе), а также может способствовать интеграции теломеров. После хранения в теломерах человека вирус периодически реактивируется.
Конкретные триггеры реактивации не совсем понятны. Некоторые исследователи предположили, что могут быть связаны травмы, физический или эмоциональный стресс и гормональный дисбаланс.
В 2011 году исследователи обнаружили, что реактивация может положительно запускаться in vitro ингибиторами гистондеацетилазы. Как только начинается реактивация, начинается процесс катящегося круга и образуются конкатемеры, как описано выше.
Человеческий герпесвирус 6 живет в основном на людях и, хотя варианты вируса могут вызывать легкие или смертельные заболевания, могут жить комменсально на своем хозяине. Было продемонстрировано, что HHV-6 способствует прогрессированию ВИЧ-1 при коинфекции в Т-клетках. HHV-6 усиливает экспрессию CD4 первичного рецептора ВИЧ, тем самым расширяя диапазон чувствительных к ВИЧ клеток. Несколько исследований также показали, что инфекция HHV-6 увеличивает выработку воспалительных цитокинов, которые усиливают экспрессию ВИЧ-1 in vitro, таких как TNF-альфа, IL-1 бета и IL-8. Более недавнее исследование in vivo показывает, что коинфекция HHV-6A резко ускоряет прогрессирование от ВИЧ к СПИДу у макак с косичками.
Также было продемонстрировано, что HHV-6 трансактивирует вирус Эпштейна-Барра.
Люди заражаются вирусом в раннем возрасте, некоторые даже в возрасте менее одного месяца. Первичные инфекции HHV-6 составляют до 20% обращений в отделения неотложной помощи новорожденных по поводу лихорадки в США и связаны с несколькими более серьезными осложнениями, такими как энцефалит, лимфаденопатия, миокардит и миелосупрессия. Распространенность вируса в организме увеличивается с возрастом (уровень инфицирования наиболее высок среди детей в возрасте от 6 до 12 месяцев), и предполагается, что это происходит из-за потери у ребенка материнских антител, которые защищают его или ее от инфекций..
Существуют несоответствия между корреляциями между возрастом и серопозитивностью: согласно некоторым сообщениям, наблюдается снижение серопозитивности с возрастом, в то время как некоторые указывают на отсутствие значительного снижения, а другие сообщают о повышении уровня серопозитивности у лиц в возрасте 62 лет и старше. После первичной инфекции латентный период устанавливается в слюнных железах, гемопоэтических стволовых клетках и других клетках и сохраняется в течение всей жизни хозяина.
Известно, что вирус широко распространен по всему миру. Сообщается о том, что уровень инфицирования HHV-6 составляет 64–83% к возрасту 13 месяцев в таких странах, как США, Великобритания, Япония и Тайвань. Исследования показали, что серологическая распространенность колеблется «примерно от 39 до 80% среди этнически разнообразного взрослого населения из Танзании, Малайзии, Таиланда и Бразилии». Существенных различий между этническими группами, проживающими в одном географическом районе, или между полами нет. В то время как HHV-6B присутствует почти во всех популяциях мира, HHV-6A, по-видимому, реже встречается в Японии, Северной Америке и Европе.
Считается, что передача вируса чаще всего происходит через попадание вирусных частиц в слюну. И HHV-6B, и HHV-7 обнаруживаются в слюне человека, причем первый встречается с меньшей частотой. Исследования сообщают о различных уровнях распространенности HHV-6 в слюне (от 3 до 90%), а также описывают слюнные железы как резервуар для HHV-6 in vivo. Вирус поражает слюнные железы, устанавливает латентный период и периодически реактивируется, чтобы распространить инфекцию на других хозяев.
Вертикальная передача также описана и встречается примерно у 1% рождений в Соединенных Штатах. Эту форму легко идентифицировать, поскольку вирусный геном содержится в каждой клетке инфицированного человека.
Диагностика инфекции HHV-6 проводится как серологическими, так и прямыми методами. Наиболее известным методом является количественное определение вирусной ДНК в крови, других жидкостях организма и органах с помощью ПЦР в реальном времени.
Классическое проявление первичной инфекции HHV-6b - это экзантема subitum (ES) или «розеола», характеризующаяся высокой температурой, за которой следует сыпь. Однако одно исследование (1997) показало, что сыпь не является отличительным признаком инфекции HHV-6, с частотой, аналогичной инфекциям, не связанным с HHV-6 (10–20% детей с лихорадкой в обеих группах). Инфекции HHV-6 чаще проявляются при высоких температурах (более 40 ° C) - около двух третей по сравнению с менее чем половиной у пациентов без HHV-6. Столь же значимые различия наблюдались в отношении недомогания, раздражительности и воспаления барабанной перепонки.
Первичная инфекция у взрослых, как правило, протекает тяжелее.
Диагностика вируса, особенно HHV-6B, жизненно важна для пациента из-за побочных эффектов инфекции. Симптомы, указывающие на эту инфекцию, такие как сыпь, остаются незамеченными у пациентов, получающих антибиотики, потому что они могут быть ошибочно приняты за побочный эффект лекарства. Известно, что HHV-6B связан с детской болезнью roseola infantum, а также с другими заболеваниями, вызванными этой инфекцией. К ним относятся гепатит, фебрильные судороги и энцефалит. У детей, страдающих от экзантемы, вызванной инфекцией HHV-6B, лихорадка сохраняется от 3 до 5 дней; высыпания на туловище, шее и лице; а иногда и фебрильные судороги, однако симптомы не всегда присутствуют вместе. Первичные инфекции у взрослых редки, поскольку чаще всего встречаются у детей. Когда инфекция возникает впервые у взрослого человека, симптомы могут быть серьезными.
Вирус периодически повторно активируется из своего латентного состояния, при этом ДНК HHV-6 выявляется у 20–25% здоровых взрослых в Соединенных Штатах. В иммунокомпетентных условиях эти реактивации часто протекают бессимптомно, но у лиц с ослабленным иммунитетом могут возникнуть серьезные осложнения. Реактивация HHV-6 вызывает тяжелое заболевание у реципиентов трансплантата и может привести к отторжению трансплантата, часто совместно с другими betaherpesviridae. Точно так же при ВИЧ / СПИДе повторная активация HHV-6 вызывает диссеминированные инфекции, ведущие к заболеванию органов-мишеней и смерти. Несмотря на то, что до 100% населения подвержено воздействию (серопозитивных) HHV-6, чаще всего к 3 годам, у взрослых наблюдаются редкие случаи первичных инфекций. В Соединенных Штатах они были больше связаны с HHV-6a, который считается более патогенным и более нейротропным и связан с несколькими расстройствами, связанными с центральной нервной системой.
HHV-6 был зарегистрирован у пациентов с рассеянным склерозом и был вовлечен в качестве кофактора в несколько других заболеваний, включая синдром хронической усталости, СПИД и височную эпилепсию.
Рассеянный склероз (РС) - это аутоиммунное и воспалительное заболевание нервной системы, которое приводит к демиелинизации аксонов в головном и спинном мозге. История рассеянного склероза в контексте HHV-6 началась в 1995 году, когда Питер Чаллонер, ученый из компании PathoGenesis Corporation в Сиэтле, начал поиск нечеловеческих генетических последовательностей в головном мозге пациентов с рассеянным склерозом. Он обнаружил необычно высокую экспрессию ДНК HHV-6 в олигодендроцитах. Он также заметил более высокую концентрацию инфицированных клеток в областях, где произошла демиелинизация. Его исследование, вероятно, было первым опубликованным исследованием, предполагающим связь между HHV-6 и MS.
Распространенность рассеянного склероза увеличивается по мере удаления от экватора. Заболеваемость в три раза выше у тех, кто родился на 42 градусе северной широты и выше, чем у тех, кто родился на 37 градусе северной широты и ниже. Люди также с меньшей вероятностью заболеют РС во взрослом возрасте, если их детство прошло в регионе с низкой заболеваемостью. Возможность наличия возбудителя инфекции в связи с РС оценивалась через призму этих эпидемиологических данных.
Для объяснения приведенных выше данных были предложены две гипотезы. Первая известна как гипотеза полиомиелита и предполагает, что инфекция в молодом возрасте дает иммунитет, а инфицирование взрослых увеличивает риск РС. Вторая известна как гипотеза распространенности и предполагает, что РС вызывается патогеном, который чаще встречается в регионах с высокими показателями РС. Этот патоген может быть широко распространенным и вызывать бессимптомную (латентную) инфекцию у большинства людей. Лишь изредка и спустя годы после первичного заражения этот гипотетический агент вызывает неврологические симптомы РС. Третья гипотеза по существу объединяет эти две и также предполагает участие нескольких патогенов. Третий вариант лучше всего относится к эпидемиологическим данным.
Парадокс вируса Эпштейна-Барра (EBV) также заслуживает внимания, поскольку сообщалось, что HHV-6 трансактивирует EBV. Люди имеют в 10 раз меньший риск развития рассеянного склероза, если они серонегативны по ВЭБ. Однако среди людей с положительным диагнозом те, кто заражается ВЭБ в более позднем возрасте, подвергаются в 3 раза большему риску развития рассеянного склероза.
Исследования показывают, что вирусные инфекции могут быть еще более связаны с рассеянным склерозом. Антитела к ВЭБ у здоровых людей остаются постоянными, тогда как уровни антител у лиц, у которых позже разовьется РС, начинают повышаться и выходить на плато в возрасте от 20 до 30 лет, независимо от возраста начала.
Более конкретно в отношении HHV-6, исследователи в 2004 году обнаружили, что начальные стадии рассеянного склероза связаны с высоким уровнем активного вируса. Вскоре после этого исследователи обнаружили, что уровни активного HHV-6 также повышаются во время рецидивов / обострений рассеянного склероза.
Исследователи продемонстрировали, что уровни антител IgG1 и IgM к HHV-6 повышены у пациентов с РС по сравнению с контрольной группой. Фактически, исследование, опубликованное в 2014 году, показало, что повышение титров IgG и IgM к HHV-6A / B является прогностическим фактором рецидива рассеянного склероза.
Анализ приведенных выше эпидемиологических, серологических и иммунологических данных подтверждает связь между инфекционным агентом и РС. Однако точный механизм возможного вирусного влияния на проявление РС менее ясен. Хотя было предложено несколько механизмов: молекулярная мимикрия, пути фосфорилирования и цитокины.
Первое исследование, специально посвященное изучению демиелинизации, связанной с HHV-6, появилось в литературе в 1996 году, когда у ранее здорового 19-месячного ребенка развилась острая энцефалопатия. Уровни основного белка миелина были повышены в спинномозговой жидкости, что свидетельствует о демиелинизации. Об этой связи почти забыли, пока четыре года спустя не было опубликовано исследование, связанное с РС, которое показало, что распространенность HHV-6 среди демиелинизированных тканей мозга составляет 90%. Для сравнения, вирус был обнаружен только в 13% здоровых тканей мозга.
Гипотеза молекулярной мимикрии, согласно которой Т-клетки по существу путают вирусный белок HHV-6 с основным белком миелина, впервые появилась примерно в это время. В начале разработки этой гипотезы (2002 г.) итальянские исследователи использовали вариант HHV-6a вместе с основным белком бычьего миелина для создания перекрестно-реактивных Т-клеточных линий. Их сравнивали с Т-клетками людей с РС, а также с клетками контрольной группы, и между ними не было обнаружено значительных различий. Их ранние исследования показали, что молекулярная мимикрия не может быть механизмом, участвующим в рассеянном склерозе.
Несколько месяцев спустя исследователи из США создали синтетический пептид с последовательностью, идентичной последовательности пептида HHV-6. Им удалось показать, что Т-клетки активировались этим пептидом. Эти активированные Т-клетки также распознают и инициируют иммунный ответ против синтетически созданной пептидной последовательности, которая идентична части основного белка миелина человека. В ходе своего исследования они обнаружили, что уровни этих перекрестно-реактивных Т-клеток значительно повышены у пациентов с рассеянным склерозом. Их исследование завершилось предположением, что HHV-6 действительно может быть возбудителем рассеянного склероза.
Последовало несколько подобных исследований. Исследование, проведенное в октябре 2014 года, подтвердило роль долгосрочной инфекции HHV-6 с демиелинизацией в прогрессирующих неврологических заболеваниях.
Основной белок миелина (ОБМ) регулярно обменивает фосфатные группы с окружающей средой, и его способность делать это имеет значение для надлежащей целостности миелиновой оболочки. Более конкретно, два остатка треонина на MBP были идентифицированы как мишени фосфорилирования киназы гликогенсинтазы и митоген-активируемой протеинкиназы. Считается, что их действие на MBP способствует его способности полимеризовать и связывать миелин. Фосфорилированный МВР также более устойчив к нескольким протеазам.
Было обнаружено, что среди людей с РС эти целевые треонины реже фосфорилируются. Фактически, HHV-6 продуцирует трансмембранный белок, известный как U24, который также является мишенью фосфорилирования киназ, упомянутых ранее. Наши киназы действуют на белок HHV-6 благодаря общей последовательности из семи аминокислот (MBP 92–104 = IVT PRTPPPS QGK; U24 1–13 = MDP PRTPPPS YSE). В результате существенные посттрансляционные модификации могут не происходить для MBP у людей с активными инфекциями HHV-6.
Было показано, что HHV-6 инфицирует обонятельные клетки (OEC). OEC были тщательно исследованы в отношении повреждений спинного мозга, бокового амиотрофического склероза и других нейродегенеративных заболеваний. Исследователи предполагают, что эти клетки обладают уникальной способностью ремиелинизировать поврежденные нейроны.
Некоторые гены, экспрессируемые HHV-6, влияют на уровни различных цитокинов в организме хозяина (см. Раздел о генных продуктах). Например, инфицированные клетки имеют повышенный уровень интерлейкина-8, который, как полагают, индуцирует репрессию ММР-9. Повышенные уровни ММП-9 были обнаружены среди людей с РС.
Реактивация HHV-6 также вовлечена в обострение MS через сдвиг в субпопуляциях Th-лимфоцитов.
Синдром хронической усталости (СХУ) - изнурительное заболевание, причина которого неизвестна. Пациенты с CFS имеют ненормальные неврологические, иммунологические и метаболические признаки.
У многих, но не у всех пациентов, соответствующих критериям СХУ, болезнь начинается с острого инфекционного синдрома. Случаи CFS могут следовать за хорошо задокументированными инфекциями, вызванными несколькими инфекционными агентами. В исследовании 259 пациентов с «CFS-подобным» заболеванием, опубликованном вскоре после обнаружения HHV-6, использовались первичные культуры лимфоцитов для выявления людей с активной репликацией HHV-6. Такая активная репликация была обнаружена у 70% пациентов по сравнению с 20% контрольных субъектов (). Вопрос, поднятый в этом исследовании, но не получивший ответа, заключался в том, вызвало ли заболевание тонкий иммунный дефицит, который привел к реактивации HHV-6, или реактивация HHV-6 привела к появлению симптомов болезни.
Последующие исследования с использованием только серологических методов, которые не позволяют отличить активную инфекцию от латентной, дали смешанные результаты: большинство, но не все, обнаружили связь между CFS и инфекцией HHV-6.
В других исследованиях использовались анализы, которые могут обнаруживать активную инфекцию: первичная клеточная культура, ПЦР сыворотки или плазмы или анализы антител к раннему антигену IgM. Большинство этих исследований показали связь между СХУ и активной инфекцией HHV-6, хотя в некоторых исследованиях этого не произошло.
Таким образом, активная инфекция HHV-6 присутствует у значительной части пациентов с CFS. Кроме того, известно, что HHV-6 инфицирует клетки нервной системы и иммунной системы, системы органов с очевидными отклонениями при CFS. Несмотря на эту связь, остается недоказанным, что реактивированная инфекция HHV-6 является причиной CFS.
Тиреоидит Хашимото - наиболее распространенное заболевание щитовидной железы, характеризующееся обильным инфильтратом лимфоцитов и нарушением функции щитовидной железы. Недавние исследования предполагают потенциальную роль HHV-6 (возможно, варианта A) в развитии или запуске тиреоидита Хашимото.
Изучена роль HHV-6 во время беременности, приводящего к воспалению амниотической полости.
ДНК HHV-6A была обнаружена в эндометрии почти у половины группы бесплодных женщин, но ни у одной из контрольной группы фертильности. Естественные клетки-киллеры, специфичные для HHV-6A, и высокие уровни определенных цитокинов в матке также были обнаружены в эндометрии бесплодных женщин, положительных на HHV-6A. Авторы предполагают, что HHV-6A может оказаться важным фактором женского бесплодия.
Идентифицировано множество онкогенных вирусов человека. Например, HHV-8 связан с саркомой Капоши, вирус Эпштейна-Барра - с лимфомой Беркитта, а ВПЧ - с раком шейки матки. Фактически, по оценкам Всемирной организации здравоохранения (2002 г.), 17,8% случаев рака у человека были вызваны инфекцией. Типичные методы, при которых вирусы инициируют онкогенез, включают подавление иммунной системы хозяина, вызывая воспаление или изменяя гены.
HHV-6 был обнаружен при лимфомах, лейкозах, раке шейки матки и опухолях головного мозга. Было продемонстрировано, что различные клеточные линии медуллобластомы, а также клетки других опухолей головного мозга экспрессируют рецептор CD46. Вирусная ДНК также была обнаружена во многих других непатологических тканях мозга, но ее уровни ниже.
Белок Р53 человека действует как опухолевый супрессор. Люди, которые не вырабатывают этот белок должным образом, чаще страдают раком - феноменом, известным как синдром Ли-Фраумени. Один из продуктов гена HHV-6, белок U14, связывает P53 и включает его в вирионы. Другой продукт гена, белок ORF-1, также может связывать и инактивировать P53. Было даже показано, что клетки, экспрессирующие ген ORF-1, при инъекции мышам вызывают фибросаркомы.
Другой продукт ВГЧ-6, немедленного раннего белка U95, было показано, что связывают ядерный фактор каппа B. Нарушение регуляции этого фактора связано с раком.
О глазном воспалении, вызванном HHV-6, сообщалось трижды. Все три были зарегистрированы у пожилых людей, двое в 2007 году и один в 2011 году. Первые два были зарегистрированы в Японии и Франции, а последний - в Японии.
Считалось, что это произошло в результате реактивации, поскольку уровни антител IgM к HHV-6 были низкими.
Эпилепсия мезиальной височной доли связана с инфекцией HHV-6. В этой области мозга существуют три структуры: миндалевидное тело, гиппокамп и парагиппокампальная извилина. Мезиальная височная эпилепсия (MTLE) является наиболее распространенной формой хронической эпилепсии, и ее основной механизм до конца не изучен.
Исследователи постоянно сообщают об обнаружении ДНК HHV-6 в тканях, удаленных от пациентов с MTLE. Исследования продемонстрировали склонность HHV-6 к агрегации в височной доле с самыми высокими концентрациями в астроцитах гиппокампа.
Однако одна группа исследователей в конечном итоге пришла к выводу, что HHV-6 может не участвовать в MTLE, связанном с мезиальным височным склерозом.
Вирус является частой причиной дисфункции печени и острой печеночной недостаточности, а недавно был связан с перипортальным сливным некрозом. Кроме того, ДНК HHV-6 часто обнаруживается только в тканях биопсии, поскольку в устойчивых случаях уровни ДНК опускаются ниже уровня обнаружения в крови.
Не существует фармацевтических препаратов, одобренных специально для лечения инфекции HHV-6, хотя использование цитомегаловирусных препаратов ( валганцикловир, ганцикловир, цидофовир и фоскарнет ) показало определенный успех. Эти препараты вводятся с целью ингибирования надлежащей полимеризации ДНК путем конкуренции с дезокситрифосфатными нуклеотидами или специфической инактивации вирусных ДНК-полимераз.
Поиск лечения может быть затруднен, когда реактивация HHV-6 происходит после операции по трансплантации, потому что лекарства для трансплантации включают иммунодепрессанты.