 ион феррата (VI), [FeO 4]
ион феррата (VI), [FeO 4]Высоковалентное железо обычно обозначает соединения и промежуточные соединения, в которых железо находится в формальной степени окисления >3, которая показывает число связей >6 с координационным числом ≤ 6. термин довольно необычен для гептакоординированных соединений железа. Его следует отличать от терминов гипервалентный и гиперкоординированный, поскольку соединения высоковалентного железа не обязательно нарушают правило 18-электронов и не обязательно имеют координационные числа>6. Ион феррата (VI) [FeO 4 ] был первой синтезированной структурой в этом классе. Синтетические соединения, обсуждаемые ниже, обычно содержат сильно окисленное железо, так как эти концепции тесно связаны.
разновидности оксоферрила обычно предлагаются в качестве промежуточных продуктов в каталитических циклах, особенно в биологических системах, в которых O 2 требуется активация. Двухатомный кислород имеет высокий потенциал восстановления (E = 1,23 В), но первым шагом, необходимым для использования этого потенциала, является термодинамически неблагоприятное восстановление одного электрона E = -0,16 В. Это восстановление происходит в природе за счет образования супероксида . комплекс, в котором восстановленный металл окислен O 2. Продуктом этой реакции является более активный перекисный радикал. Обилие этих видов в природе и доступный для них химический состав - вот причины, по которым изучение этих соединений важно. Широко применяемый метод получения высоковалентных оксоферрильных разновидностей - окисление йодозобензолом :

 оксоирон (IV), лигированный тиолатом
оксоирон (IV), лигированный тиолатом Сообщалось о нескольких синтезах оксо-железа (IV). Эти соединения моделируют биологические комплексы, такие как цитохром P450, NO-синтаза и изопенициллин-N-синтаза. Два таких соединения - это оксоирон с тиолат-лигированием (IV) и оксоирон с ацетатом циклама (IV). Оксоирон (IV), связанный с тиолятом, образуется в результате окисления предшественника, [Fe (TMCS)] (PF 6) (TMCS = 1-меркаптоэтил-4,8,11-триметил-1,4, 8,11-тетразациклотетрадекан) и 3-5 эквивалентов H 2O2при -60 ° C в метаноле. Соединение железа (IV) имеет темно-синий цвет и демонстрирует интенсивные абсорбционные характеристики при 460 нм, 570 нм, 850 нм и 1050 нм. Этот вид Fe (= O) (TMCS) + стабилен при -60 ˚C, но сообщается о разложении при повышении температуры. Соединение 2 было идентифицировано с помощью мессбауэровской спектроскопии, высокого разрешения ионизации электрораспылением масс-спектрометрии (ESI-MS), рентгеновской абсорбционной спектроскопии, расширенной X- тонкая структура поглощения лучей (EXAFS), ультрафиолетовая-видимая спектроскопия (УФ-видимая область), инфракрасная спектроскопия с преобразованием Фурье (FT-IR), и результаты сравнивались с Расчеты по теории функционала плотности (DFT).
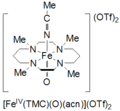 оксоирон (IV) на основе тетраметилциклама (IV)
оксоирон (IV) на основе тетраметилциклама (IV) Тетраметилциклам оксоирон (IV) образуется в результате реакции Fe (TMC) (OTf) 2, TMC = 1,4,8,11-тетраметил-1,4,8,11-тетраазациклотетрадекан; OTf = CF 3SO3, с иодозилбензолом (PhIO) в CH 3 CN при -40 ° C. О втором способе образования оксоирона циклама (IV) сообщается как реакция Fe (TMC) (OTf) 2 с 3 эквивалентами H 2O2в течение 3 часов. Этот вид имеет бледно-зеленый цвет и имеет максимум поглощения при 820 нм. Сообщается, что он стабилен не менее 1 месяца при -40 ˚C. Он был охарактеризован с помощью мессбауэровской спектроскопии, ESI-MS, EXAFS, УФ-видимой, рамановской спектроскопии и FT-IR.
Комплексы высоковалентного железа биспидин может окислять циклогексан до циклогексанола и циклогексанона с выходом 35% при соотношении спирта к кетону до 4.
FeTAML (= O), TAML = тетраамидо макроциклический лиганд, образуется в результате реакции [Fe (TAML) (H 2 O)] ( PPh 4) с 2-5 эквивалентами мета-хлорпербензойной кислоты при -60 ° C в н-бутиронитриле. Это темно-зеленое соединение (два λ max при 445 и 630 нм соответственно) стабильно при 77 К. Стабилизация Fe (V) объясняется сильной π-донорной способностью депротонированных амидных атомов азота.
Феррат (VI) представляет собой неорганический анион химической формулы [FeO 4 ]. Он светочувствителен и придает своим соединениям и растворам бледно-фиолетовый цвет. Это один из самых сильных известных водостойких окислителей. Хотя он классифицируется как слабое основание, концентрированные растворы феррата (VI) стабильны только при высоких. pH.
Была рассмотрена электронная структура соединений оксо-железа порфирина.
 образование комплекса нитридо-железа (VI)
образование комплекса нитридо-железа (VI) Нитридо-железо и соединения имидо-железа тесно связаны с химией железо-диазот. Рассмотрена биологическая значимость нитридоирон (V) порфиринов. Широко применяемым методом получения форм высокомолекулярного нитридо железа является термическое или фотохимическое окислительное отщепление молекулярного азота из комплекса азид.

Существует несколько структурно охарактеризованных соединений нитридо железа (IV).
Было синтезировано первое соединение нитридо железа (V) и охарактеризован Вагнером и Накамото (1988, 1989) с использованием фотолиза и рамановской спектроскопии при низких температурах.
A Сообщалось о втором виде Fe, кроме иона феррата (VI), [(Me 3 cy-ac) FeN] (PF 6)2. Этот вид образован окисление с последующим фотолизом с образованием частиц Fe (VI). Характеристика комплекса Fe (VI) была проведена расчетами Мёссбауэра, EXAFS, IR и DFT. В отличие от иона феррата (VI), соединение 5 является диамагнитным.
Мостиковые μ-нитридодийжелезные фталоцианиновые соединения катализируют окисление метана до метанол, формальдегид и муравьиная кислота с использованием перекиси водорода в качестве жертвенного окислителя.
Нитридоирон (IV) и виды нитридо железа (V) были впервые теоретически исследованы в 2002 году.