| Вирус гепатита C | |
|---|---|
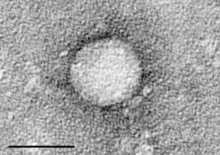 | |
| Электронная микрофотография гепатита C, очищенного из клеточной культуры. Масштабная шкала = 50 нанометров | |
| Классификация вирусов | |
| (без рейтинга): | Вирус |
| Область: | Рибовирия |
| Королевство: | Орторнавиры |
| Тип: | Kitrinoviricota |
| Класс: | Flasuviricetes |
| Порядок: | Amarillovirales |
| Семейство: | Flaviviridae |
| Род: | Hepacivirus |
| Виды: | Hepacivirus C |
| Синонимы | |
Вирус гепатита C | |
Вирус гепатита C (HCV ) представляет собой небольшой (55–65 нм размер), окруженный, положительно-смысловой одноцепочечной РНК вируса семейства Flaviviridae. Вирус гепатита С является причиной гепатита С и некоторых видов рака, таких как рак печени (гепатоцеллюлярная карцинома, сокращенно ГЦК) и лимфомы у людей.
Вирус гепатита С принадлежит к роду Hepacivirus, члену семейства Flaviviridae. До 2011 года считался единственным представителем этого рода. Однако представитель этого рода был обнаружен у собак : гепацивирус собак. В этом роду также есть как минимум один вирус, поражающий лошадей. Несколько дополнительных вирусов этого рода были описаны у летучих мышей и грызунов.
 Структура вируса гепатита C
Структура вируса гепатита C Частица вируса гепатита C состоит из липидной мембраны конверт диаметром от 55 до 65 нм. Два вирусных оболочки гликопротеина, E1 и E2 встроены в липидную оболочку. Они принимают участие в прикреплении вируса и проникновении в клетку. Внутри оболочки находится икосаэдрическое ядро диаметром от 33 до 40 нм. Внутри ядра находится РНК-материал вируса.
E1 и E2 ковалентно связаны при внедрении в оболочку HCV и стабилизируются дисульфидные связи. E2 является глобулярным и, судя по изображениям, полученным с помощью электронного микроскопа, кажется, выступает на 6 нм из оболочки оболочки.
Эти гликопротеины играют важную роль во взаимодействиях гепатита C с иммунной системой. гипервариабельная область, гипервариабельная область 1 (HVR1) может быть обнаружена на гликопротеине E2. HVR1 гибкий и вполне доступный для окружающих молекул. HVR1 помогает E2 защитить вирус от иммунной системы. Это предотвращает фиксацию CD81 на соответствующем рецепторе вируса. Кроме того, E2 может защитить E1 от иммунной системы. Хотя аминокислотная последовательность HVR1 весьма вариабельна, эта область имеет сходные химические, физические и конформационные характеристики для многих гликопротеинов E2.
 Структура IRES, расположенная в 5'-UTR HCV
Структура IRES, расположенная в 5'-UTR HCV Вирус гепатита С имеет положительный смысл однонитевой РНК геном. Геном состоит из единственной открытой рамки считывания, которая имеет длину 9600 нуклеотидов оснований. Эта единственная открытая рамка считывания транслируется с образованием единого белкового продукта, который затем обрабатывается для получения более мелких активных белков. Вот почему в общедоступных базах данных, таких как Европейский институт биоинформатики, вирусный протеом состоит только из 2 белков.
На 5'- и 3'-концах РНК находятся нетранслируемые области (UTR), которые не транслируются в белки, но важны для трансляции и репликации вирусной РНК. 5'-UTR имеет сайт связывания рибосомы или внутренний сайт входа в рибосому (IRES), который инициирует трансляцию очень длинного белка, содержащего около 3000 аминокислот. Основной домен HCV IRES содержит четырехстороннее спиральное соединение Холлидея, которое интегрировано в предсказанный псевдоузел. Конформация этого корового домена ограничивает ориентацию открытой рамки считывания для позиционирования на 40S рибосомной субъединице. Большой пре-белок позже расщепляется клеточными и вирусными протеазами на 10 более мелких белков, которые обеспечивают репликацию вируса внутри клетки-хозяина или собираются в зрелые вирусные частицы. Структурные белки, производимые вирусом гепатита С, включают белок Core, E1 и E2; неструктурные белки включают NS2, NS3, NS4A, NS4B, NS5A и NS5B.
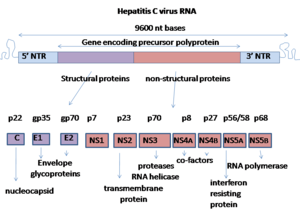 Геномная организация вируса гепатита С
Геномная организация вируса гепатита С 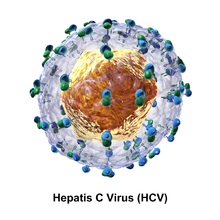 Схема структуры частицы вируса гепатита С
Схема структуры частицы вируса гепатита С Белки этого вируса расположены вдоль генома в следующем порядке: N-конец-ядро-оболочка ( E1) –E2 – p7-неструктурный белок 2 (NS2) –NS3 – NS4A – NS4B – NS5A – NS5B – C концевой. Генерация зрелых неструктурных белков (от NS2 до NS5B) зависит от активности вирусных протеиназ. Соединение NS2 / NS3 расщепляется металл-зависимой автокаталитической протеиназой, кодируемой в NS2 и на N-конце NS3. Остальные расщепления ниже этого сайта катализируются сериновой протеазой, также содержащейся в N-концевой области NS3.
Также был описан 11-й белок. Этот белок кодируется +1 сдвигом рамки в гене капсида. Он выглядит антигенным, но его функция неизвестна.
 Упрощенная диаграмма цикла репликации вируса гепатита C
Упрощенная диаграмма цикла репликации вируса гепатита C Репликация HCV включает несколько этапов. Вирус реплицируется в основном в гепатоцитах печени, где, по оценкам, ежедневно каждая инфицированная клетка производит приблизительно пятьдесят вирионов (вирусных частиц), при этом общее количество генерируемых вирионов составляет один триллион. Вирус также может реплицироваться в мононуклеарных клетках периферической крови, что может быть причиной высоких уровней иммунологических нарушений, обнаруживаемых у хронически инфицированных пациентов с HCV. В печени частицы HCV попадают в синусоиды печени с током крови. Эти синусоиды соседствуют с клетками гепатоцитов. ВГС способен проходить через эндотелий синусоидов и пробираться к базолатеральной поверхности клеток гепатоцитов.
ВГС имеет широкий спектр генотипов и быстро мутирует из-за высокого частота ошибок со стороны вирусной РНК-зависимой РНК-полимеразы. Частота мутаций приводит к появлению такого количества вариантов вируса, что он считается квазивидом, а не обычным видом вируса. Проникновение в клетки-хозяева происходит посредством сложных взаимодействий между вирионами, особенно через их гликопротеины, и молекулами клеточной поверхности CD81, рецептор ЛПНП, SR-BI, DC-SIGN, Claudin-1 и Occludin.
Оболочка HCV аналогична липопротеинам очень низкой плотности (VLDL) и липопротеины низкой плотности (ЛПНП). Из-за этого сходства считается, что вирус может связываться с аполипопротеинами. Он может окружать себя липопротеинами, частично прикрывая E1 и E2. Недавние исследования показывают, что эти аполипопротеины взаимодействуют с рецептором скавенджера B1 (SR-B1). SR-B1 способен удалять липиды из липопротеинов вокруг вируса, чтобы лучше обеспечить контакт с HVR1. Клаудин 1, который представляет собой белок с плотным соединением, и CD81 связываются, чтобы создать комплекс, прививая их для последующих процессов инфицирования HCV. Когда срабатывает иммунная система, макрофаги увеличивают количество TNF-α вокруг инфицированных гепатоцитов. Это запускает миграцию окклюдина, другого комплекса плотных контактов, к базолатеральной мембране. Частица HCV готова войти в клетку.
Эти взаимодействия приводят к эндоцитозу вирусной частицы. Этому процессу способствуют белки клатрина. Попав внутрь ранней эндосомы, эндосома и вирусная оболочка сливаются, и РНК попадает в цитоплазму.
HCV захватывает части внутриклеточного аппарата для репликации. Геном HCV транслируется с образованием одного белка, состоящего примерно из 3011 аминокислот. Затем полипротеин протеолитически процессируется вирусными и клеточными протеазами с образованием трех структурных (связанных с вирионом) и семи неструктурных (NS) белков. Альтернативно, сдвиг рамки считывания может происходить в области Core с образованием белка альтернативной рамки считывания (ARFP). HCV кодирует две протеазы: цистеиновую автопротеазу NS2 и сериновую протеазу NS3-4A. Затем белки NS рекрутируют вирусный геном в комплекс репликации РНК, который связан с перестроенными цитоплазматическими мембранами. Репликация РНК происходит через вирусную РНК-зависимую РНК-полимеразу NS5B, которая продуцирует промежуточное соединение РНК с отрицательной цепью. РНК с отрицательной цепью затем служит шаблоном для производства новых вирусных геномов с положительной цепью. Затем зарождающиеся геномы можно транслировать, реплицировать в дальнейшем или упаковывать в новые вирусные частицы.
Вирус реплицируется на внутриклеточных липидных мембранах. В частности, эндоплазматический ретикулум деформируется в мембранные структуры уникальной формы, называемые «мембранными тканями». Эти структуры могут быть индуцированы единственной экспрессией вирусного белка NS4B. Основной белок связывается с липидными каплями и использует микротрубочки и динеины для изменения их местоположения на перинуклеарное распределение. Высвобождение из гепатоцита может включать секреторный путь ЛПОНП. Другая гипотеза утверждает, что вирусная частица может секретироваться из эндоплазматического ретикулума посредством (ESCRT) пути. Этот путь обычно используется для вывода пузырьков из клетки. Единственное ограничение этой гипотезы состоит в том, что этот путь обычно используется для клеточного почкования, и неизвестно, каким образом HCV может занять путь ESCRT для использования с эндоплазматическим ретикулумом.
На основании генетических различий между изолятами ВГС виды вируса гепатита С классифицируются на шесть генотипов (1–6) с несколькими подтипами внутри каждого генотипа (представлены строчными буквами). Подтипы далее разбиваются на квазивиды в зависимости от их генетического разнообразия. Генотипы различаются на 30–35% нуклеотидных сайтов по всему геному. Различие в геномном составе подтипов генотипа обычно составляет 20-25%. Подтипы 1a и 1b встречаются во всем мире и вызывают 60% всех случаев.
Генотип клинически важен для определения потенциального ответа на терапию на основе интерферона и необходимой продолжительности такой терапии. Генотипы 1 и 4 менее чувствительны к лечению интерфероном, чем другие генотипы (2, 3, 5 и 6). Продолжительность стандартной терапии на основе интерферона для генотипов 1 и 4 составляет 48 недель, тогда как лечение генотипов 2 и 3 завершается через 24 недели. Устойчивый вирусологический ответ наблюдается в 70% случаев генотипа 1, ~ 90% генотипов 2 и 3, ~ 65% генотипа 4 и ~ 80% генотипа 6. Кроме того, люди африканского происхождения гораздо реже реагируют на лечение. при инфицировании генотипами 1 или 4. Предполагается, что значительная часть отсутствия ответа на лечение вызвана однонуклеотидным полиморфизмом (SNP) на 19 хромосоме генома человека, который является предиктором лечения. успех. Генотипы 1 и 4 вируса гепатита С были эндемически распространены в пересекающихся областях Западной и Центральной Африки, веками заражая человеческие популяции, несущие рассматриваемый генетический полиморфизм. Это побудило ученых предположить, что длительное сохранение генотипов 1 и 4 ВГС у людей африканского происхождения является эволюционной адаптацией ВГС на протяжении многих столетий к иммуногенетическим ответам этих популяций.
Инфекция. с одним генотипом не дает иммунитета против других, и возможно одновременное заражение двумя штаммами. В большинстве этих случаев один из штаммов за короткое время побеждает другой. Это открытие может быть полезно при лечении, при замене штаммов, не реагирующих на лекарства, другими, которые легче лечить.
Когда два вируса заражают одну и ту же клетку, генетическая рекомбинация Может произойти. Хотя нечасто, рекомбинация ВГС наблюдалась между разными генотипами, между подтипами одного и того же генотипа и даже между штаммами одного и того же подтипа.
Вирус гепатита С преимущественно представляет собой кровь передающийся вирусом, с очень низким риском половой передачи или вертикальной передачи. Из-за этого способа распространения ключевыми группами риска являются потребители инъекционных наркотиков (ПИН), получатели продуктов крови и иногда пациенты, находящиеся на гемодиализе. Обычной установкой для передачи ВГС также является внутрибольничная (внутрибольничная ) передача, когда в клинике неправильно соблюдаются правила гигиены и стерилизация. В качестве потенциального исторического способа распространения ВГС был предложен ряд культурных или ритуальных практик, включая обрезание, калечение половых органов, ритуальную скарификацию, традиционные татуировки и иглоукалывание. Также утверждалось, что, учитывая чрезвычайно длительные периоды персистенции ВГС у людей, даже очень низкие и неопределяемые уровни механической передачи через кусающие насекомые могут быть достаточными для поддержания эндемической инфекции в тропиках, где люди получают большое количество укусов насекомых.
Идентификация происхождения этого вируса была сложной, но генотипы 1 и 4, похоже, имеют общее происхождение. Байесовский анализ предполагает, что основные генотипы произошли примерно 300–400 лет назад от вируса общего предка . Минорные генотипы разошлись около 200 лет назад от своих основных генотипов. Все существующие генотипы, по-видимому, произошли от подтипа 1b генотипа 1.
Исследование штаммов генотипа 6 предполагает более раннюю дату эволюции: приблизительно от 1100 до 1350 лет до настоящего времени. Расчетная скорость мутации составляла 1,8 × 10. Экспериментальное исследование оценило скорость мутаций при заменах 2,5–2,9 × 10 оснований на сайт в год. Этот генотип может быть предком других генотипов.
Изучение изолятов в Европе, США и Японии показало, что дата происхождения генотипа 1b приблизительно равна 1925 году. Предполагаемые даты происхождения типов 2a 3а - 1917 и 1943 годы соответственно. Время расхождения типов 1a и 1b оценивается в 200–300 лет.
Исследование генотипов 1a и 1b оценило даты происхождения как 1914–1930 для типа 1a и 1911–1944 для типа 1b. Оба типа 1a и 1b подверглись значительному увеличению эффективной численности популяции между 1940 и 1960 годами. Распространение подтипа 1b вируса гепатита C предшествовало распространению подтипа 1a по крайней мере на 16 лет. Похоже, что оба типа распространились из развитого мира в развивающийся.
Штаммы генотипа 2 из Африки можно разделить на четыре группы, которые коррелируют с их страной происхождения: (1) Камерун и Центральноафриканская Республика (2) Бенин, Гана и Буркина-Фасо (3) Гамбия, Гвинея, Гвинея-Бисау и Сенегал (4) Мадагаскар. Также имеются убедительные доказательства распространения генотипа 2 ВГС из Западной Африки в Карибский бассейн в результате трансатлантической работорговли.
Считается, что генотип 3 возник в Юго-Восточной Азии.
Эти данные из разных стран позволяют предположить, что этот вирус, возможно, развился в Юго-Восточной Азии и был распространен в Западную Африку торговцами из Западной Европы. Позже он был введен в Японию, когда была снята самоизоляция страны. После завоза в страну на его распространение повлияли многие местные факторы, включая переливание крови, программы вакцинации, внутривенное употребление наркотиков и режимы лечения. Учитывая снижение скорости распространения после того, как в 1990-х годах был проведен скрининг на ВГС в продуктах крови, может показаться, что ранее переливание крови было важным методом распространения. Требуется дополнительная работа для определения дат эволюции различных генотипов и сроков их распространения по земному шару.
В отличие от гепатита А и В в настоящее время вакцина для предотвращения заражения гепатитом С.
Изучение ВГС затруднено из-за узкого круга хозяев ВГС. Использование репликонов было успешным, но они были обнаружены только недавно. ВГС, как и большинство РНК-вирусов, существует как вирусный квазивид, что очень затрудняет выделение одного штамма или типа рецептора для изучения.
Текущие исследования сосредоточены на низкомолекулярных ингибиторах вирусной протеазы, РНК-полимеразы и других неструктурных генов. Два агента - боцепревир от Merck и телапревир от Vertex Pharmaceuticals - оба ингибитора протеазы NS3 были одобрены для использования 13 мая 2011 г. и 23 мая 2011 г. соответственно.
Сообщалось о возможной связи между низким уровнем витамина D и плохой реакцией на лечение. Работа in vitro показала, что витамин D может снижать репликацию вируса. Хотя эта работа выглядит многообещающей, результаты клинических испытаний еще не получены. Тем не менее, было высказано предположение, что добавление витамина D важно в дополнение к стандартному лечению для усиления реакции на лечение.
Нарингенин, флавоноид, содержащийся в грейпфруте и других фруктах и травах, блокирует сборка внутриклеточных инфекционных вирусных частиц без влияния на внутриклеточные уровни вирусной РНК или белка.
Другие агенты, которые находятся в стадии исследования, включают нуклеозидные и нуклеотидные аналоги ингибиторы и ненуклеозидные ингибиторы РНК- зависимая РНК-полимераза, ингибиторы NSP5A и соединения, нацеленные на хозяина, такие как ингибиторы циклофилина и силибинин.
софосбувир для использования против хронической инфекции гепатита C, были одобрены FDA 6 декабря, 2013. Сообщается, что это первый препарат, который продемонстрировал безопасность и эффективность для лечения определенных типов инфекции ВГС без необходимости одновременного введения интерферона. 22 ноября FDA одобрило симепревир для использования в сочетании с пегинтерфероном-альфа и рибавирином. Симепревир был одобрен в Японии для лечения хронической инфекции гепатита С, генотип 1.
В настоящее время проводятся экспериментальные исследования методов лечения, не связанных с лекарствами. Оксиматрин, например, представляет собой экстракт корня, обнаруженный на азиатском континенте, который, как сообщалось, обладает противовирусной активностью против ВГС в культурах клеток и исследованиях на животных. Небольшие и многообещающие испытания на людях показали положительные результаты и отсутствие серьезных побочных эффектов, но они были слишком малы для обобщения выводов.
Недавно, 5 октября 2020 г., было объявлено, что Харви Дж. Альтер, Майкл Хоутон (вирусолог) и Чарльз М. Райс разделили Нобелевскую премию за изобретение лекарства от гепатита С. Первое лекарство был одобрен в 1991 г., но лишь немногие пациенты, получающие лечение, достигли стойкого вирусологического ответа.
| На Викискладе есть средства массовой информации, связанные с вирусом гепатита C. |
| Викивиды содержит информацию, относящуюся к вирусу гепатита C |