 Джордж Хаммонд разработал этот постулат во время своей должности профессора в Университете штата Айова.
Джордж Хаммонд разработал этот постулат во время своей должности профессора в Университете штата Айова. Постулат Хаммонда (или, альтернативно, постулат Хаммонда-Леффлера) - это гипотеза в физической органической химии, которая описывает геометрическую структуру переходного состояния в органической химической реакции. Постулат, впервые предложенный Джорджем Хаммондом в 1955 году, гласит:
Если два состояния, как, например, переходное состояние и нестабильное промежуточное соединение, возникают последовательно во время процесса реакции и имеют почти одинаковое энергосодержание, их взаимное преобразование будет включать лишь небольшую реорганизацию молекулярных структур.
Следовательно, геометрическую структуру состояния можно предсказать, сравнив его энергию с соседними по координате реакции частицами. Например, в экзотермической реакции переходное состояние ближе по энергии к реагентам, чем к продуктам. Следовательно, переходное состояние будет более геометрически похоже на реагенты, чем на продукты. Однако в отличие от эндотермической реакции переходное состояние ближе по энергии к продуктам, чем к реагентам. Итак, согласно постулату Хаммонда структура переходного состояния будет больше напоминать продукты, чем реагенты. Этот тип сравнения особенно полезен, поскольку большинство переходных состояний невозможно охарактеризовать экспериментально.
Постулат Хаммонда также помогает объяснить и рационализировать принцип Белла – Эванса – Поланьи. А именно, этот принцип описывает экспериментальное наблюдение, согласно которому скорость реакции и, следовательно, ее энергия активации зависят от энтальпии этой реакции. Постулат Хаммонда объясняет это наблюдение, описывая, как изменение энтальпии реакции также может изменить структуру переходного состояния. В свою очередь, это изменение геометрической структуры приведет к изменению энергии переходного состояния и, следовательно, энергии активации и скорости реакции.
Постулат также использовался для предсказания формы диаграмм координат реакции. Например, электрофильное ароматическое замещение включает отдельное промежуточное и два менее четко определенных состояния. Измеряя эффекты ароматических заместителей и применяя постулат Хаммонда, был сделан вывод, что этап определения скорости включает образование переходного состояния, которое должно напоминать промежуточный комплекс.
В 1940-х и 1950-х годах химики не могли объяснить, почему даже незначительные изменения в реагентах вызвали значительные различия в скорости и распределении продуктов реакции. В 1955 году Джордж Хаммонд, молодой профессор Университета штата Айова, предположил, что теория переходного состояния может быть использована для качественного объяснения наблюдаемых взаимосвязей структура-реактивность. Примечательно, что Джон Э. Леффлер из Университета штата Флорида предложил аналогичную идею в 1953 году. Однако версия Хаммонда привлекла больше внимания, поскольку ее качественная природа была легче для понимания и использования, чем сложные математические уравнения Леффлера. Постулат Хаммонда иногда называют постулатом Хаммонда-Леффлера, чтобы отдать должное обоим ученым.
По сути, постулат утверждает, что структура переходного состояния напоминает структуру ближайших к нему видов по свободной энергии. Это можно объяснить с помощью диаграмм потенциальной энергии:

В случае (а), который представляет собой экзотермическую реакцию, энергия переходного состояния ближе по энергии к энергии реагента, чем у промежуточного соединения или продукта. Следовательно, исходя из постулата, структура переходного состояния также больше напоминает структуру реагента. В случае (b) энергия переходного состояния не близка ни к реагенту, ни к продукту, что не делает ни один из них хорошей структурной моделью переходного состояния. Дополнительная информация потребуется для того, чтобы предсказать структуру или характеристики переходного состояния. Случай (c) изображает потенциальную диаграмму для эндотермической реакции, в которой, согласно постулату, переходное состояние должно больше напоминать промежуточное состояние или продукт.
Другое значение постулата Хаммонда состоит в том, что он позволяет нам обсуждать структуру переходного состояния с точки зрения реагентов, промежуточных соединений или продуктов. В случае, когда переходное состояние очень похоже на реагенты, переходное состояние называется «ранним», в то время как «позднее» переходное состояние - это то, которое очень похоже на промежуточное соединение или продукт.
Примером «раннего» переходного состояния является хлорирование. Хлорирование благоприятствует продуктам, потому что это экзотермическая реакция, а это означает, что продукты имеют более низкую энергию, чем реагенты. Глядя на соседнюю диаграмму (представление «раннего» переходного состояния), нужно сосредоточиться на переходном состоянии, которое невозможно наблюдать во время эксперимента. Чтобы понять, что подразумевается под «ранним» переходным состоянием, постулат Хаммонда представляет собой кривую, показывающую кинетику этой реакции. Поскольку реагенты имеют более высокую энергию, переходное состояние появляется сразу после начала реакции.
Примером «позднего» переходного состояния является бромирование. Бромирование благоприятствует реагентам, потому что это эндотермическая реакция, а это означает, что реагенты имеют более низкую энергию, чем продукты. Поскольку переходное состояние трудно наблюдать, постулат бромирования помогает представить себе «позднее» переходное состояние (см. Представление «позднего» переходного состояния). Поскольку продукты имеют более высокую энергию, переходное состояние, по-видимому, наступает прямо перед завершением реакции.
Еще одна полезная интерпретация постулата, часто встречающаяся в учебниках органической химии :
Эта интерпретация игнорирует чрезвычайно экзотермические и эндотермические реакции, которые относительно необычны, и связывает переходное состояние с промежуточными продуктами, которые обычно являются наиболее нестабильными.
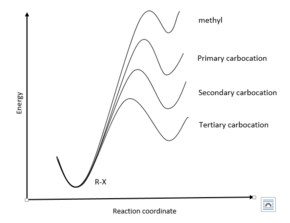 Энергетические диаграммы реакций S N 1
Энергетические диаграммы реакций S N 1 Постулат Хаммонда можно использовать для изучения структуры переходных состояний реакции SN1. В частности, диссоциация уходящей группы является первым переходным состоянием в реакции S N 1. Известно, что стабильность карбокатионов, образованных в результате этой диссоциации, соответствует тенденции: третичныйgt; вторичныйgt; первичныйgt; метил.
Следовательно, поскольку третичный карбокатион относительно стабилен и, следовательно, близок по энергии к RX-реагенту, тогда третичное переходное состояние будет иметь структуру, которая довольно похожа на RX-реагент. С точки зрения графика зависимости координаты реакции от энергии, это показано тем фактом, что третичное переходное состояние находится левее других переходных состояний. Напротив, энергия метилкарбокатиона очень высока, и поэтому структура переходного состояния больше похожа на промежуточный карбокатион, чем на реагент RX. Соответственно, состояние перехода метила очень правое.
Реакции бимолекулярного нуклеофильного замещения (SN2) представляют собой согласованные реакции, в которых как нуклеофил, так и субстрат участвуют в стадии ограничения скорости. Поскольку эта реакция согласована, реакция происходит в один этап, когда связи разрываются, а новые связи образуются. Следовательно, чтобы интерпретировать эту реакцию, важно взглянуть на переходное состояние, которое напоминает согласованный этап ограничения скорости. На рисунке «Изображение реакции S N 2» нуклеофил образует новую связь с углеродом, а галогенидная (L) связь разорвана.
 Механизм реакции мономолекулярного отщепления
Механизм реакции мономолекулярного отщепления Реакция E1 состоит из мономолекулярного отщепления, где определяющая скорость стадия механизма зависит от удаления одного молекулярного вида. Это двухступенчатый механизм. Чем более стабильным является промежуточный карбокатион, тем быстрее будет протекать реакция, благоприятная для продуктов. Стабилизация промежуточного карбокатиона снижает энергию активации. Порядок реактивности (CH3) 3C-gt; (CH3) 2CH-gt; CH3CH2-gt; CH3-.
 Координата реакции мономолекулярного отщепления
Координата реакции мономолекулярного отщепления Кроме того, исследования описывают типичный процесс кинетического разделения, который начинается с двух энергетически эквивалентных энантиомеров и, в конце концов, образует два неэквивалентных по энергии промежуточных продукта, называемых диастереомерами. Согласно постулату Хаммонда, более стабильный диастереомер образуется быстрее.
Бимолекулярные реакции элиминирования представляют собой одностадийные согласованные реакции, в которых и основание, и субстрат участвуют в стадии, ограничивающей скорость. В механизме E2 основание берет протон рядом с уходящей группой, заставляя электроны образовывать двойную связь и вытесняя уходящую группу - все за один согласованный шаг. Закон скорости зависит от концентрации двух реагентов первого порядка, что делает его реакцией элиминирования 2-го порядка (бимолекулярной). Факторы, которые влияют на шаг определения скорости, - это стереохимия, уходящие группы и прочность основания.
Теория для реакции E2, разработанная Джозефом Баннеттом, предполагает, что наименьший проход через энергетический барьер между реагентами и продуктами достигается регулированием между степенями разрыва C β -H и C α -X в переходном состоянии. Регулировка включает в себя значительный разрыв связи, который легче разорвать, и небольшой разрыв связи, который требует больше энергии. Этот вывод Баннета противоречит постулату Хаммонда. Постулат Хаммонда противоположен тому, что теоретизировал Баннетт. В переходном состоянии этапа разрыва связи происходит небольшое разрушение, когда связь легко разрывается, и большое разрушение, когда разрыв связи затруднен. Несмотря на эти различия, эти два постулата не противоречат друг другу, поскольку относятся к разным видам процессов. Хаммонд сосредотачивается на этапах реакции, когда одна связь создается или разрывается, или разрыв двух или более связей происходит без затраченного времени и происходит одновременно. Переходное состояние теории E2 касается процесса, когда образование или разрыв связи не одновременны.
Технически постулат Хаммонда описывает только геометрическую структуру химической реакции. Однако постулат Хаммонда косвенно дает информацию о скорости, кинетике и энергии активации реакций. Следовательно, это дает теоретическую основу для понимания принципа Белла – Эванса – Поланьи, который описывает экспериментальное наблюдение, что энтальпия и скорость подобных реакций обычно коррелировали.
 Энергетические диаграммы реакций S N 1
Энергетические диаграммы реакций S N 1 Связь между постулатом Хаммонда и принципом BEP можно понять, рассмотрев реакцию S N 1. Хотя во время реакции S N 1 возникают два переходных состояния (диссоциация уходящей группы и затем атака нуклеофила), диссоциация уходящей группы почти всегда является этапом, определяющим скорость. Следовательно, энергия активации и, следовательно, скорость реакции будут зависеть только от стадии диссоциации.
Сначала рассмотрим реакцию на вторичный и третичный углерод. Как отмечается в принципе BEP, экспериментально реакции S N 1 на третичных атомах углерода протекают быстрее, чем на вторичных атомах углерода. Следовательно, по определению, переходное состояние для третичных реакций будет иметь более низкую энергию, чем для вторичных реакций. Однако принцип BEP не может объяснить, почему энергия ниже.
Используя постулат Хаммонда, более низкая энергия третичного переходного состояния означает, что его структура относительно ближе к его реагентам R (третичный) -X, чем к продукту карбокатиона, по сравнению со вторичным случаем. Таким образом, третичное переходное состояние будет более геометрически схожим с реагентами R (третичного) -X, чем вторичное переходное состояние с его реагентами R (вторичными) -X. Следовательно, если третичное переходное состояние близко по структуре к (низкоэнергетическим) реагентам, то оно также будет иметь более низкую энергию, поскольку структура определяет энергию. Точно так же, если вторичное переходное состояние больше похоже на (высокоэнергетический) продукт карбокатиона, то оно будет более энергоемким.
Постулат Хаммонда полезен для понимания взаимосвязи между скоростью реакции и стабильностью продуктов. В то время как скорость реакции зависит только от энергии активации (часто представленной в органической химии как ΔG ‡ «двойной кинжал дельта G»), конечные соотношения продуктов в химическом равновесии зависят только от стандартного изменения свободной энергии ΔG («дельта ГРАММ"). Соотношение конечных продуктов в состоянии равновесия напрямую соответствует стабильности этих продуктов.
Постулат Хаммонда связывает скорость процесса реакции со структурными особенностями тех состояний, которые составляют его часть, говоря, что молекулярные реорганизации должны быть небольшими на тех этапах, которые включают два состояния, которые очень близки по энергии. Это привело к структурному сравнению исходных материалов, продуктов и возможных «стабильных промежуточных продуктов», которое привело к пониманию того, что наиболее стабильный продукт не всегда является предпочтительным в процессе реакции.
Постулат Хаммонда особенно важен при рассмотрении стадии реакции, ограничивающей скорость. Однако следует проявлять осторожность при изучении многоступенчатой реакции или реакции с возможностью перегруппировок на промежуточной стадии. В некоторых случаях конечные продукты проявляются в искаженных соотношениях в пользу более нестабильного продукта (называемого кинетическим продуктом ), чем более стабильного продукта ( термодинамического продукта ). В этом случае необходимо изучить стадию ограничения скорости и промежуточные продукты. Часто стадия, ограничивающая скорость, представляет собой начальное образование нестабильных частиц, таких как карбокатион. Затем, как только образуется карбокатион, могут происходить последующие перегруппировки. В реакциях такого типа, особенно при более низких температурах, реагенты просто вступают в реакцию до того, как успеют произойти перегруппировки, необходимые для образования более стабильного промежуточного продукта. При более высоких температурах, когда микроскопическое обращение легче, предпочтение отдается более стабильному термодинамическому продукту, поскольку эти промежуточные соединения успевают перегруппироваться. Независимо от того, работает ли она при высоких или низких температурах, смесь кинетических и термодинамических продуктов в конечном итоге достигает того же соотношения, одного в пользу более стабильного термодинамического продукта, когда дается время для уравновешивания из-за микрообращения.