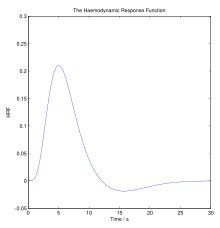
 Каноническая функция гемодинамического ответа (HRF). Спайк указывает на короткий интенсивный период стимуляции нейронов, который требует увеличения притока крови и питательных веществ. Когда потребности нейрональной активности удовлетворяются, кровоток возвращается к гомеостатическому уровню.
Каноническая функция гемодинамического ответа (HRF). Спайк указывает на короткий интенсивный период стимуляции нейронов, который требует увеличения притока крови и питательных веществ. Когда потребности нейрональной активности удовлетворяются, кровоток возвращается к гомеостатическому уровню. В гемодинамике организм должен реагировать на физическую активность, внешнюю температуру и другие факторы гомеостатически регулирование его кровотока для доставки питательных веществ, таких как кислород и глюкоза, в стрессовые ткани и обеспечение их функционирования. Гемодинамический ответ (HR) обеспечивает быструю доставку крови к активным нейрональным тканям. Мозг потребляет большое количество энергии, но не имеет запаса энергетических субстратов. Поскольку высшие процессы в головном мозге происходят почти постоянно, церебральный кровоток необходим для поддержания нейронов, астроцитов и других клеток. мозга. Эта связь между нейрональной активностью и кровотоком также называется.
Чтобы понять, как кровь доставляется в ткани черепа, важно понимать сосудистую анатомию самого пространства. Большие церебральные артерии в головном мозге разделяются на более мелкие артериолы, также известные как пиальные артерии. Они состоят из эндотелиальных клеток и гладкомышечных клеток, и по мере того, как эти пиальные артерии далее разветвляются и проникают глубже в мозг, они связываются с глиальными клетками, а именно с астроцитами. Внутримозговые артериолы и капилляры отличаются от системных артериол и капилляров тем, что они не позволяют веществам легко диффундировать через них; они соединены плотными контактами, чтобы сформировать гематоэнцефалический барьер (BBB). Эндотелиальные клетки, гладкие мышцы, нейроны, астроциты и перициты работают вместе в головном мозге, чтобы поддерживать ГЭБ, при этом доставляя питательные вещества к тканям и регулируя кровоток во внутричерепном пространстве для поддержания гомеостаза. Поскольку они работают как функциональная единица, изменения в их взаимодействиях на клеточном уровне могут нарушать ЧСС в головном мозге и приводить к отклонениям в нормальной нервной функции.
Различные типы клеток играют роль в HR, включая астроциты, гладкомышечные клетки, эндотелиальные клетки кровеносных сосудов и перициты. Эти клетки контролируют, сужены ли сосуды или расширены, что определяет количество кислорода и глюкозы, которое может достигать нервной ткани.
 Сосудистая сеть головного мозга как функция кровотока. Красные стрелки показывают сокращение сосудов, а белые стрелки указывают на расширение сосудов в ответ на усиление кровотока.
Сосудистая сеть головного мозга как функция кровотока. Красные стрелки показывают сокращение сосудов, а белые стрелки указывают на расширение сосудов в ответ на усиление кровотока. Астроциты уникальны тем, что они являются посредниками между кровеносными сосудами и нейронами. Они способны общаться с другими астроцитами через щелевые соединения и имеют процессы, которые взаимодействуют с нейронными синапсами. Эти конечности могут поглощать различные нейромедиаторы, такие как норэпинефрин (NE) и глутамат, а также выполнять различные другие функции для поддержания химических и электрических гомеостаз в нейрональной среде.
Было показано, что сужение происходит in vitro, когда NE помещается в синапс и поглощается рецепторами астроцитов. Поглощение NE приводит к увеличению внутриклеточного астроцита Ca. Когда эти волны ионов кальция распространяются по длине астроцита, активируется фосфолипаза A (PLA 2), которая, в свою очередь, мобилизует арахидоновую кислоту. Эти два соединения транспортируются в гладкие мышцы и там реагируют с цитохромом P450 с образованием 20-гидроксиэйкозатетраеновой кислоты (20-HETE), которая действует посредством еще не определенных механизмов, вызывая вазоконстрикцию. Также было показано, что агонисты метаботропных рецепторов глутамата (mGluR) также увеличивают внутриклеточный Ca, вызывая сокращение.
Происходит расширение когда оксид азота (NO) высвобождается из эндотелиальных клеток и диффундирует в близлежащие гладкие мышцы сосудов. Несколько предложенных путей NO-индуцированной вазодилатации были предложены в ходе гемодинамических исследований. Было показано, что NO ингибирует синтез 20-HETE, который может мешать путям сокращения астроцитов и приводить к расширению сосудов. Было также высказано предположение, что NO может усиливать приток Са в астроциты и активировать Са-зависимые калиевые каналы, высвобождая K в интерстициальное пространство и вызывая гиперполяризацию гладкомышечных клеток. В дополнение к этому, уже было показано, что NO стимулирует повышенные уровни циклического GMP (cGMP) в клетках гладких мышц, вызывая сигнальный каскад, который приводит к активации cGMP-зависимой протеинкиназы. (PKG) и окончательное снижение концентрации кальция в гладких мышцах. Это приводит к уменьшению мышечного сокращения и последующему расширению кровеносного сосуда. Суженные или расширенные сосуды определяют количество кислорода и глюкозы, которое может достичь нервной ткани.
Основная функция перицитов заключается во взаимодействии с астроцитами, гладкомышечными клетками и другими внутричерепными клетками с целью формирования гематоэнцефалического барьера и регулирования размера кровеносных сосудов для обеспечения правильной доставки и распределение кислорода и питательных веществ в нервных тканях. Перициты имеют как холинергический (α2), так и адренергический (β2) рецепторы. Стимуляция последних приводит к расслаблению сосудов, а стимуляция холинергических рецепторов - к сокращению.
Было показано, что паракринная активность и доступность кислорода также модулируют активность перицитов. Пептиды ангиотензин II и эндотелин-1 (ЕТ-1) связываются с перицитами и являются вазоактивными. Эндотелиальные клетки индуцируют экспрессию эндотелина-1, что приводит к продукции NO и расширению сосудов. Эксперименты показали, что уровень кислорода также влияет на сокращение перицитов и последующее сокращение кровеносных сосудов. In vitro высокие концентрации кислорода вызывают сокращение перицитов, тогда как высокие CO2 концентрации вызывают расслабление. Это говорит о том, что перициты могут иметь способность расширять кровеносные сосуды, когда требуется кислород, и сужать их при его избытке, изменяя скорость кровотока к тканям в зависимости от их метаболической активности.
Гемодинамический ответ - это быстрая доставка крови к активной нейрональной ткани. Осложнения этого ответа возникают при острых коронарных синдромах и легочной артериальной гипертензии. Эти осложнения приводят к изменению регуляции притока крови к мозгу и, в свою очередь, количества глюкозы и кислорода, которые поступают в нейроны, что может иметь серьезные последствия не только для функционирования нервной системы, но и для функционирования всех системы организма.
Острые инфекции, такие как внебольничная пневмония (ВП), выступают в качестве спускового механизма для острых коронарных синдромов (САУ). ACS лечит симптомы, возникающие в результате закупорки коронарных артерий. Из-за этой обструкции возникают тромботические осложнения на участках атеросклеротических бляшек. Наиболее частый симптом, который требует постановки диагноза, - это боль в груди, связанная с тошнотой и потоотделением. Лечение обычно включает аспирин, клопидогрель, нитроглицерин и, если боль в груди не проходит, морфин. Недавнее исследование показало, что острая респираторная инфекция может спровоцировать ОКС. Это, в свою очередь, имеет серьезные протромботические и гемодинамические эффекты.
Эти эффекты являются результатом коагуляции, которая обычно предотвращается в эндотелии сосудов за счет экспрессии антитромботических факторов на его поверхности. Сепсис, который вызывает нарушение, и апоптоз эндотелиальных клеток приводит к переключению эндотелия на прокоагулянтный фенотип. Это способствует адгезии и агрегации тромбоцитов. Более того, только после того, как произошло разрушение поверхности бляшки, эти протромботические эффекты, вероятно, будут значительными в патогенезе ОКС. Сепсис также во многом связан с гемодинамическими изменениями. Давление перфузии коронарной артерии снижается при периферической вазодилатации, что приводит к снижению артериального давления и снижению сократимости миокарда. Эндотелиальная дисфункция вызывает сужение коронарных сосудов. Это вызвано выбросом катехоламина и инфекциями. Тяжелые инфекции приводят к увеличению метаболических требований миокарда и гипоксии. Когда нейронная ткань лишена достаточного количества кислорода, гемодинамический ответ оказывает меньшее влияние на активную нейронную ткань. Все эти нарушения увеличивают вероятность ОКС из-за разрыва коронарной бляшки и тромбоза. В целом, ОКС возникает в результате поражения коронарных сосудов атеросклерозом, поэтому первичная профилактика ОКС заключается в предотвращении атеросклероза путем контроля факторов риска. Это включает в себя здоровое питание, регулярные упражнения и контроль уровня холестерина.
Легочная гипертензия (ЛАГ) - заболевание мелких легочных артерий, которое обычно вызывается несколькими механизмами. Сюда входят пневмония, паразитарные инфекции, уличные наркотики, такие как кокаин и метамфетамины, вызывающие сужение кровеносных сосудов, и многое другое. Вазоактивные медиаторы, такие как оксид азота и простациклин, наряду со сверхэкспрессией вазоконстрикторов, не только влияют на тонус сосудов, но и способствуют их ремоделированию. ЛАГ связана с повышением артериального давления в легочных артериях, которое приводит к одышке, головокружению, обмороку, редко кровохарканью и многим другим симптомам. ЛАГ может быть тяжелым заболеванием, которое может привести к снижению толерантности к физической нагрузке и, в конечном итоге, к сердечной недостаточности. Он включает в себя сужение кровеносных сосудов, соединенных с легкими и находящихся внутри них. В результате сердце с трудом перекачивает кровь через легкие, и в конечном итоге кровеносные сосуды подвергаются фиброзу. Повышенная нагрузка на сердце вызывает гипертрофию правого желудочка, что приводит к уменьшению прокачки крови через легкие и уменьшению кровотока в левой части сердца. В результате всего этого левому отделу сердца трудно перекачивать достаточный запас кислорода к остальному телу, что ухудшает эффект гемодинамической реакции. Нарушение гемодинамических реакций, в свою очередь, снижает способность к физической нагрузке у пациентов с ЛАГ. Тяжесть гемодинамической дисфункции во время прогрессирующей нагрузки при ЛАГ можно регистрировать с помощью сердечно-легочного теста с нагрузкой (CPET) и / или импедансной кардиографии (ICG). Кроме того, в настоящее время не существует способов лечения легочной артериальной гипертензии, но есть варианты лечения пациентов с этим заболеванием, которые помогают продлить их выживаемость и качество жизни. Некоторые из этих методов лечения включают базовую терапию, блокаторы кальциевых каналов и терапию простациклином. Базовая терапия может привести к значительным клиническим улучшениям у пациентов с правожелудочковой недостаточностью путем назначения диуретической терапии. Это снижает преднагрузку правого желудочка. Более того, высокие дозы блокаторов кальциевых каналов у пациентов, у которых есть ответ на это лечение, могут продлить выживаемость и улучшить легочную гемодинамику. Препараты, блокирующие кальциевые каналы, приводят к регрессу гипертрофии правого желудочка. С другой стороны, терапия простациклином продлевает выживаемость, вызывая расслабление гладких мышц сосудов. Это стимулирует выработку циклического АМФ (цАМФ), который подавляет рост гладкомышечных клеток.
В целом, легочное артериальное давление и острые коронарные синдромы - лишь немногие из многих заболеваний, которые приводят к к гипоксии нейрональной ткани, что, в свою очередь, ухудшает гемодинамический ответ и приводит к гибели нейронов. Продолжительная гипоксия вызывает гибель нейронов через апоптоз. При дисфункциональной гемодинамической реакции активной нейрональной ткани из-за деполяризации мембраны не хватает энергии, необходимой для передачи сигналов, в результате затруднения кровотока. Это влияет на многие функции организма и может привести к серьезным симптомам.
При этом заболевании в мозге происходит образование белка бета-амилоида. В конечном итоге это приводит к снижению гемодинамической реакции и уменьшению кровотока в головном мозге. Это снижение церебрального кровотока не только убивает нервные клетки из-за нехватки кислорода и глюкозы, но также снижает способность мозга удалять бета-амилоид. В здоровом мозге эти фрагменты белка расщепляются и удаляются. При болезни Альцгеймера фрагменты накапливаются, образуя твердые нерастворимые бляшки, которые уменьшают кровоток. В этом накоплении бета-амилоида участвуют два белка: фактор ответа сыворотки или SRF и миокардин. Вместе эти 2 белка определяют, сокращаются ли гладкие мышцы кровеносных сосудов. SRF и миокардин более активны в мозге людей с болезнью Альцгеймера. Когда эти белки активны, они включают SREBP2, который ингибирует LRP-1. LRP-1 помогает мозгу удалять бета-амилоид. Следовательно, когда SRF и миокардин активны, происходит накопление бета-амилоидного белка, что в конечном итоге приводит к снижению кровотока в головном мозге из-за сужения кровеносных сосудов.
Уменьшение кровообращения в сосудистой сети мозга в результате инсульта или травмы может привести к состоянию, известному как ишемия. Как правило, уменьшение кровотока в головном мозге может быть результатом тромбоза, вызывающего частичную или полную закупорку кровеносных сосудов, гипотонию в большом круге кровообращения (и, следовательно, головного мозга) или остановку сердца. Это снижение кровотока в сосудистой системе головного мозга может привести к накоплению метаболических отходов, производимых нейронами и глиальными клетками, и снижению доставки к ним кислорода и глюкозы. В результате может произойти сбой клеточной энергии, деполяризация нейрональных и глиальных мембран, отек и избыток нейромедиатора и высвобождение ионов кальция. В конечном итоге это заканчивается гибелью клеток, так как клетки уступают место недостатку питательных веществ, необходимых для их метаболизма, и токсичной среде мозга, полной свободных радикалов и избыточных ионов, которые нарушают нормальную функцию клеточных органелл.
Изменения активности мозга тесно связаны с изменениями кровотока в этих областях, и знание этого оказалось полезным при картировании функций мозга у людей. Измерение гемодинамического ответа в клинических условиях можно использовать для создания изображений головного мозга, в которых особенно активные и неактивные области показаны отдельно друг от друга. Это может быть полезным инструментом при диагностике невральных заболеваний или при предоперационном планировании. Функциональная МРТ и ПЭТ - наиболее распространенные методы, в которых используется гемодинамический ответ для картирования функции мозга. Врачи используют эти методы визуализации для изучения анатомии головного мозга, чтобы определить, какие именно части мозга выполняют определенные функции высокого порядка, для оценки последствий дегенеративных заболеваний и даже для планирования хирургического лечения головного мозга.
Функциональная магнитно-резонансная томография (фМРТ) - это метод медицинской визуализации, используемый для измерения гемодинамической реакции мозга на нервную активность. Это одно из наиболее часто используемых устройств для измерения функций мозга, и оно относительно недорогое для использования в клинических условиях. Начало нейронной активности приводит к систематическим сериям физиологических изменений в локальной сети кровеносных сосудов, которые включают изменения объема церебральной крови на единицу ткани мозга (CBV), изменения скорости церебрального кровотока и изменения концентрация оксигемоглобина и дезоксигемоглобина. Существуют различные методы фМРТ, которые могут улавливать функциональный сигнал, соответствующий изменениям в каждом из ранее упомянутых компонентов гемодинамического ответа. Наиболее распространенным сигналом функциональной визуализации является сигнал, зависящий от уровня кислорода в крови (жирный шрифт), который в первую очередь соответствует концентрации дезоксигемоглобина. Эффект BOLD основан на том факте, что, когда активность нейронов увеличивается в одной части мозга, также увеличивается объем церебрального кровотока в этой области, что является основой гемодинамического ответа. Это увеличение кровотока приводит к увеличению отношения оксигенированного гемоглобина по сравнению с дезоксигенированным гемоглобином в этой конкретной области. Разница в магнитных свойствах оксигенированного и деоксигенированного гемоглобина - это то, что позволяет с помощью фМРТ создавать эффективную карту того, какие нейроны активны, а какие нет. Короче говоря, дезоксигенированный гемоглобин является парамагнитным, тогда как оксигенированный гемоглобин диамагнитен. Диамагнитная кровь (оксигемоглобин ) меньше влияет на сигнал магнитного резонанса (MR), и это приводит к улучшенному MR-сигналу в области повышенной нейрональной активности. Однако парамагнитная кровь (дезоксигемоглобин) делает локальное магнитное поле неоднородным. Это имеет эффект расфазировки сигнала, излучаемого в этой области, вызывая деструктивные помехи в наблюдаемом МР-сигнале. Следовательно, большее количество дезоксигемоглобина приводит к меньшему сигналу. Активность нейронов в конечном итоге приводит к усилению локальной МР-передачи сигналов, соответствующей снижению концентрации дезоксигемоглобина.
 Этот образец фМРТ показывает, как существуют определенные области активации во время стимуляции
Этот образец фМРТ показывает, как существуют определенные области активации во время стимуляции Если фМРТ можно использовать для определения регулярного кровотока крови в здоровом мозге, его также можно использовать для выявления проблем с мозгом, который подвергся дегенеративным заболеваниям. Функциональная МРТ, использующая ответ гемодинамики, может помочь оценить влияние инсульта и других дегенеративных заболеваний, таких как болезнь Альцгеймера, на функцию мозга. Другой способ использования фМРТ - планирование операций на головном мозге. Хирурги могут использовать фМРТ для обнаружения кровотока в наиболее активных областях мозга и областях, участвующих в критических функциях, таких как мысль, речь, движение и т. Д. Таким образом, операции на мозге менее опасны, потому что есть картирование мозга, которое показывает, какие области жизненно важны для жизни человека. Гемодинамический ответ жизненно важен для фМРТ и клинического использования, потому что, изучая кровоток, мы можем исследовать анатомию мозга и эффективно планировать процедуры мозга и связывать воедино причины дегенеративного заболевания мозга.
ФМРТ в состоянии покоя. позволяет оценить взаимодействие областей мозга, когда не выполняется конкретная задача. Это также используется для отображения сетевого режима по умолчанию.
ПЭТ-сканирование или Позитронно-эмиссионное томографическое сканирование, которое также используется вместе с фМРТ для визуализации мозга. ПЭТ-сканирование может обнаружить активные области мозга гемодинамически или метаболически через потребление глюкозы. Они позволяют наблюдать кровоток или обмен веществ в любой части мозга. Области, которые активируются усилением кровотока и / или повышенным потреблением глюкозы, визуализируются в увеличенном сигнале на ПЭТ-изображении.
Перед началом ПЭТ-сканирования пациенту вводят небольшую дозу радиоактивного лекарства. с тегами изотопного индикатора, например, глюкозы или кислорода. Следовательно, если целью ПЭТ-сканирования является определение активности мозга, в качестве лекарства будет использоваться ФДГ или фтордезоксиглюкоза. ФДГ представляет собой комплекс радиоактивного фтора, меченного глюкозой. Если определенная часть мозга более активна, там потребуется больше глюкозы или энергии и будет поглощено больше ФДГ. Это увеличение потребления глюкозы будет обнаруживаться по усилению сигнала на ПЭТ-изображении. ПЭТ-сканеры обладают этой функцией, потому что они измеряют энергию, которая излучается, когда позитронов из радиоактивного индикатора сталкивается с электронами в мозге. По мере того, как радиоактивный индикатор разрушается, образуется больше позитронов и увеличивается сигнал при сканировании ПЭТ.