 Белок Spike (S), ответственный за связывание с рецепторами ACE2 при COVID-19. Гликаны выделены синим цветом. Структура взята из записи PDB 6VXX
Белок Spike (S), ответственный за связывание с рецепторами ACE2 при COVID-19. Гликаны выделены синим цветом. Структура взята из записи PDB 6VXX Гликан-белковые взаимодействия представляет собой класс биологических межмолекулярных взаимодействий, которые происходят между свободными или связанными с белками гликанами и их родственными партнерами по связыванию. Вместе с взаимодействиями белок-белок они образуют механистическую основу для многих основных процессов клетка, особенно для взаимодействий клетки-клетки и взаимодействий клетки-хозяина. Например, SARS-CoV-2, возбудитель COVID-19, использует свой сильно гликозилированный белок-шип (S) для связывания с Рецептор ACE2, позволяющий ему проникать в клетки-хозяева. Белок-шип представляет собой тримерную структуру, каждая субъединица содержит 22 сайта N-гликозилирования, что делает его привлекательной мишенью для поиска вакцины.
Гликаны, общее название моносахаридов и олигосахаридов, представляют собой одну из основных посттрансляционных модификаций белков, вносящих свой вклад в огромную биологическая сложность жизни. Действительно, три различных гексозы теоретически могут давать от 1056 до 27 648 уникальных трисахаридов, в отличие от только 6 пептидов или олигонуклеотидов, образованных из 3 аминокислот или 3 нуклеотидов соответственно. В отличие от управляемого шаблонами биосинтеза белка, «язык» гликозилирования до сих пор неизвестен, что делает гликобиологию горячей темой текущих исследований, учитывая их распространенность в живых
Изучение взаимодействий гликанов и белков дает представление о механизмах передачи сигналов клетками и позволяет создавать более совершенные инструменты диагностики многих заболеваний, включая рак. В самом деле, не существует известных типов рака, которые не связаны с беспорядочными паттернами гликозилирования белков .
Связывание гликан-связывающих белков (GBP) с гликанами можно смоделировать с помощью простого равновесие. Обозначение гликанов как 

Со связанной константой равновесия
Которая перегруппирована, чтобы получить константу диссоциации 
Учитывая, что многие GBP демонстрируют многовалентность, эту модель можно расширить для учета нескольких равновесий:
Обозначение кумулятивного равновесия связывания с лигандами 
С соответствующей константой равновесия:
И записать материальный баланс для белка (
Выражая условия через константу равновесия, получаем окончательный результат:
Концентрация свободного белка, таким образом:
Если 
С увеличением 

 Рис. 1. Схематическое изображение взаимодействий
Рис. 1. Схематическое изображение взаимодействий 
Химическая интуиция подсказывает, что сайты связывания гликана могут быть обогащены полярными аминокислотными остатками, которые образуют нековалентные взаимодействия, такие как водородные связи, с полярными углеводы. Действительно, статистический анализ карманов связывания углеводов показывает, что остатки аспарагиновой кислоты и аспарагина присутствуют в два раза чаще, чем можно было бы предположить случайно. Удивительно, но ароматические аминокислоты отдают предпочтение еще более сильному: триптофан имеет 9-кратное увеличение распространенности, тирозин - 3-кратное увеличение и гистидин в 2 раза больше. Было показано, что основная сила - это взаимодействие 







 Определение альфа- и бета-граней для глюкозы и галактозы. Стереохимическое различие для двух гексоз выделено красным.
Определение альфа- и бета-граней для глюкозы и галактозы. Стереохимическое различие для двух гексоз выделено красным. Это взаимодействие 






Сравнение электростатических поверхностных потенциалов (ESPs) ароматических колец в триптофане, тирозине, фенилаланине и гистидине предполагает, что электронные эффекты также играют важную роль. роль в связывании с гликанами (см. рисунок 2). После нормализации электронной плотности на площадь поверхности триптофан по-прежнему остается наиболее электронно-богатым акцептором взаимодействий 

 Рисунок 2. Электростатические поверхностные потенциалы (ESP) ароматических аминокислот. Области, богатые электронами, показаны красным цветом, а области, бедные электронами, - синим.
Рисунок 2. Электростатические поверхностные потенциалы (ESP) ароматических аминокислот. Области, богатые электронами, показаны красным цветом, а области, бедные электронами, - синим. Существует множество белков, способных связываться с гликанами, включая лектины, антитела, микробные адгезины, вирусные агглютинины и т. Д.
Лектины - это общее название белков с углевод-узнающими доменами (CRD). Хотя оно стало почти синонимом гликановых белков, оно не включает антитела, которые также принадлежат к этому классу.
Лектины, обнаруженные в растениях и клетки грибов широко использовались в исследованиях как инструмент для обнаружения, очистки и анализа гликанов. Однако полезные лектины обычно имеют субоптимальную специфичность. Например, Ulex europaeus агглютинин-1 (UEA-1), лектин, выделенный из растений, способный связываться с антигеном группы крови O человека, также может связываться к неродственным гликанам, таким как 2'-фукозиллактоза, GalNAcα1-4 (Fucα1-2) Galβ1-4GlcNAc и Lewis-Y антиген.
Хотя антитела проявляют наномолярное сродство к белковым антигенам, специфичность против гликанов очень ограничена. Фактически, доступные антитела могут связываться только <4% of the 7000 mammalian glycan antigens; moreover, most of those antibodies have low affinity and exhibit cross-reactivity.
В отличие от челюстных позвоночных, иммунитет которых основан на различных, разнообразных, и присоединение генных сегментов (VDJ) иммуноглобулинов, беспозвоночных беспозвоночных без челюстей, таких как минога и миксина, создают разнообразие рецепторов соматическими ДНК реаранжировка модулей лейцина -богатых повторов (LRR), которые включены в * vlr * гены (вариабельные рецепторы лейкоцитов). Эти LRR образуют трехмерные структуры, напоминающие изогнутые соленоиды, которые избирательно связывают определенные гликаны.
Исследование, проведенное в Университете штата Мэриленд, показало, что антитела миноги (лямбоди) могут избирательно связываться с опухолью -ассоциированные углеводные антигены (такие как Tn и TF 


При внимательном рассмотрении кристаллической структуры VLRB.aGPA.23 обнаруживается остаток триптофана в положении 187 прямо над углеводом. связывающий карман.
 Кристаллическая структура VLRB.aGPA.23, созданная из записи PDB 4K79
Кристаллическая структура VLRB.aGPA.23, созданная из записи PDB 4K79 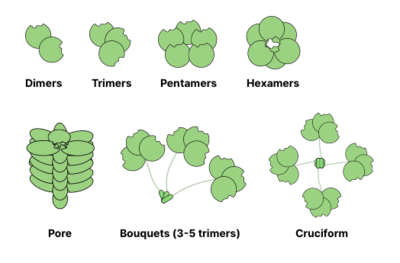 Мультяшное изображение общих олигомерных структур лектинов
Мультяшное изображение общих олигомерных структур лектинов Многие гликановые связывающие белки (GBP) являются олигомерные и обычно содержат несколько сайтов для связывания гликанов (также называемых доменами распознавания углеводов). Способность к взаимодействию поливалентного белка с лигандом значительно увеличивает силу связывания: в то время как значения 



Общие структуры олигомеризации лектины показаны ниже. Например, галектины обычно наблюдаются как димеры, тогда как интелектины образуют тримеры, а пентраксины собираются в пентамеры. Более крупные структуры, такие как гексамерные Reg-белки, могут собираться в поры, проникающие в мембрану. Коллектины могут образовывать еще более причудливые комплексы: букеты тримеров или даже крестообразные структуры (например, в SP-D ).
Учитывая важность гликанового белка взаимодействий, в настоящее время ведутся исследования, посвященные а) созданию новых инструментов для обнаружения взаимодействий гликанов и белков и б) использованию этих инструментов для расшифровки так называемого сахарного кода.
Одним из наиболее широко используемых инструментов для исследования взаимодействий гликанов с белками является массивы гликанов. Матрица гликанов обычно представляет собой стеклянные слайды, активированные NHS- или эпоксидной смолой, на которых были напечатаны различные гликаны с использованием роботизированной печати. Эти коммерчески доступные наборы могут содержать до 600 различных гликанов, специфичность которых была тщательно изучена.
Взаимодействия гликанов и белков могут быть обнаружены путем тестирования представляющих интерес белков (или библиотек из них) с флуоресцентными метками. Структура гликансвязывающего белка может быть расшифрована несколькими аналитическими методами на основе масс-спектрометрии, включая MALDI-MS, LC-MS, тандемный МС-МС и / или 2D ЯМР.
Вычислительные методы были применены для поиска параметров (например, склонности к остаткам, гидрофобности, планарности), которые могут различать гликановые связывающие белки с других участков поверхности. Например, модель, обученная на 19 негомологичных структурах связывания углеводов, смогла предсказать домены связывания углеводов (CRD) с точностью 65% для неферментативных структур и 87% для ферментативных. В дальнейших исследованиях использовались расчеты энергии Ван-дер-Ваальса белок-зондовых взаимодействий и предрасположенности аминокислот для идентификации CRD с 98% специфичностью при 73% чувствительности. Более современные методы позволяют прогнозировать CRD даже на основе белковых последовательностей, сравнивая последовательности с теми, для которых уже известны структуры.
В отличие от исследований белков, где структура первичного белка однозначно определяется последовательностью нуклеотидов (генетический код ), гликобиология до сих пор не может объяснить, как закодировано определенное «сообщение» с использованием углеводов или как это "читается" и "переводится" другими биологическими объектами.
Междисциплинарные усилия, объединяющие химию, биологию и биохимию, изучают взаимодействия гликанов с белками, чтобы увидеть, как разные последовательности углеводов вызывают разные клеточные реакции.