| GSR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | GSR, HEL-75, HEL-S-122m, глутатионредуктаза, глутатион -дисульфидредуктаза, GR, GSRD | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | OMIM: 138300 MGI: 95804 HomoloGene: 531 GeneCards : GSR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Orthol ogs | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Виды | Человек | Мышь | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entrez | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ensembl | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UniProt |
Глутатионредуктаза (GR), также известная как глутатион-дисульфидредуктаза (GSR ), представляет собой фермент, который у людей кодируется геном GSR . Глутатионредуктаза (EC 1.8.1.7) катализирует восстановление дисульфида глутатиона (GSSG ) до сульфгидрильной формы глутатиона (GSH ), которая является критической молекулой в сопротивление окислительному стрессу и поддержание восстановительной среды клетки. Глутатионредуктаза действует как димерная дисульфид оксидоредуктаза и использует FAD простетическую группу и НАДФН для восстановления одного молярного эквивалента GSSG до двух молярных эквивалентов GSH:  Общая реакция, катализируемая глутатионредуктазой Общая реакция, катализируемая глутатионредуктазой Глутатионредуктаза сохраняется между всеми царствами. У бактерий, дрожжей и животных обнаружен один ген глутатионредуктазы; однако в геномах растений кодируются два гена GR. Дрозофила и трипаносомы вообще не имеют ГР. У этих организмов восстановление глутатиона осуществляется либо системой тиоредоксина, либо системой трипанотиона соответственно. Содержание
Функция
Глутатион играет ключевую роль в поддержании надлежащей функции и предотвращении окислительного стресса в клетках человека. Он может действовать как поглотитель гидроксильных радикалов, синглетного кислорода и различных электрофилов. Восстановленный глутатион восстанавливает окисленную форму фермента глутатионпероксидазы, что, в свою очередь, восстанавливает перекись водорода (H2O2), опасно реактивную форму внутри клетки. Кроме того, он играет ключевую роль в метаболизме и клиренсе ксенобиотиков, действует как кофактор некоторых детоксифицирующих ферментов, участвует в транспорте и регенерирует антиоксиданты, такие как витамины E и C, до их реактивных форм. Соотношение GSSG / GSH, присутствующих в клетке, является ключевым фактором в правильном поддержании окислительного баланса клетки, то есть критически важно, чтобы клетка поддерживала высокий уровень восстановленного глутатиона и низкий уровень окисленного дисульфида глутатиона. Этот узкий баланс поддерживается глутатионредуктазой, которая катализирует восстановление GSSG до GSH.  Восстановленная глутатионредуктаза, глутатионпероксидаза и глутатион взаимодействуют, восстанавливая перекись водорода до воды, чтобы защитить клетку от окислительного повреждения. Восстановленная глутатионредуктаза, глутатионпероксидаза и глутатион взаимодействуют, восстанавливая перекись водорода до воды, чтобы защитить клетку от окислительного повреждения. СтруктураГлутатионредуктаза из эритроцитов человека представляет собой гомодимер, состоящий из мономеров 52Kd, каждый из которых содержит 3 домена. GR имеет однослойную двухслойную топологию, в которой антипараллельный бета-лист в значительной степени подвергается воздействию растворителя с одной стороны, а с другой стороны покрывается случайными витками. Сюда входят: NADPH -связывающий домен, FAD -связывающий домен (ы) и домен димеризации. Каждый мономер содержит 478 остатков и одну молекулу FAD. GR представляет собой термостабильный белок, сохраняющий функцию до 65 ° C. Механизм реакции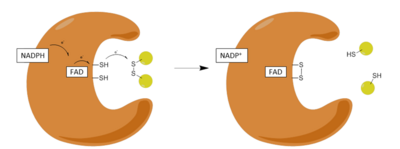 Графическое представление общей реакции, катализируемой GR Графическое представление общей реакции, катализируемой GR  каталитическим циклом GR каталитическим циклом GR Этапы:
Восстановительная половинаДействие GR протекает через две отдельные полураакции: восстановительный полумеханизм, за которым следует окислительная половина. В первой половине НАДФН снижает уровень FAD, присутствующий в GSR, с образованием переходного аниона FADH. Затем этот анион быстро разрывает дисульфидную связь Cys 58 - Cys 63, образуя короткоживущую ковалентную связь - стабильный комплекс с переносом заряда между флавином и Cys 63. Окисленный теперь НАДФ + высвобождается и впоследствии заменяется новой молекулой НАДФН. Это конец так называемой редуктивной половины механизма. Окислительная половинаВ окислительной половине механизма Cys 63 нуклеофильно атакует ближайшее сульфидное звено в молекуле GSSG (чему способствует His 467), которая создает смешанную дисульфидную связь (GS-Cys 58) и анион GS. Его 467 GSR затем протонирует GS-анион с высвобождением первой молекулы GSH. Затем Cys 63 нуклеофильно атакует сульфид Cys 58, высвобождая анион GS, который, в свою очередь, захватывает протон растворителя и высвобождается из фермент, тем самым создавая второй GSH. Таким образом, для каждого GSSG и NADPH получают две восстановленные молекулы GSH , которые снова могут действовать как антиоксиданты, улавливающие активные формы кислорода в ячейке. ИнгибированиеIn vitro глутатионредуктаза ингибируется низкими концентрациями арсенита натрия и метилированных метаболитов арсената, но in vivo значительное ингибирование глутатионредуктазы арсенатом натрия было только при 10 мг. / кг / сут. Глутатионредуктаза также ингибируется некоторыми флаваноидами, классом пигментов, продуцируемых растениями. Клиническое значениеGSH является ключевым клеточным антиоксидантом и играет важную роль в 2 фаза метаболического клиренса электрофильных ксенобиотиков. Важность пути GSH и ферментов, влияющих на этот тонкий баланс, в последние годы привлекает повышенное внимание. Хотя глутатионредуктаза является привлекательной мишенью для многих фармацевтических препаратов, до настоящего времени не было создано эффективных терапевтических соединений, связанных с глутатионредуктазой. В частности, глутатионредуктаза, по-видимому, является хорошей мишенью для противомалярийных препаратов, поскольку глутатионредуктаза малярийного паразита Plasmodium falciparum имеет существенно отличающуюся белковую укладку, чем у глутатионредуктазы млекопитающих.. Создавая препараты, специфичные для p. falciparum, можно избирательно вызывать окислительный стресс у паразита, не затрагивая при этом хозяина. Существует два основных класса соединений, нацеленных на GR:
Клинические испытания, проведенные в Буркина-Фасо, показали смешанные результаты при лечении малярии с помощью нафтохинонов В клетках, подверженных высоким уровням окислительного стресса, таких как эритроциты, до 10% потребления глюкозы может быть направлено на пентозофосфатный путь (PPP) для производства НАДФН, необходимого для этой реакции. В случае эритроцитов, если PPP нефункционален, окислительный стресс в клетке приведет к лизису и анемии. Волчанка является аутоиммунным заболеванием, при котором пациенты производят повышенное количество антител, которые атакуют ДНК и другие компоненты клетки. В недавнем исследовании было обнаружено, что однонуклеотидный полиморфизм (SNP) в гене глутатионредуктазы тесно связан с волчанкой у афроамериканцев, участвовавших в исследовании. У афроамериканцев с волчанкой также было показано, что их Т-клетки меньше экспрессируют глутатион. Авторы исследования считают, что пониженная активность глутатионредуктазы может способствовать увеличению производства реактивного кислорода у афроамериканцев с волчанкой. У мышей глутатионредуктаза участвует в окислительном взрыве, компоненте иммунного ответа. Окислительный взрыв - это защитный механизм, при котором нейтрофилы производят и высвобождают реактивные окислительные формы в непосредственной близости от бактерий или грибов для уничтожения чужеродных клеток. Было показано, что нейтрофилы с дефицитом глутатионредуктазы вызывают более кратковременный окислительный всплеск в ответ на бактерии, чем нейтрофилы, которые экспрессируют GR на обычных уровнях. Механизм действия глутатионредуктазы в поддержании окислительного всплеска до сих пор неизвестен. ДефицитДефицит глутатионредуктазы - редкое заболевание, при котором эритроцитов отсутствует активность глутатионредуктазы., лейкоциты или оба. В одном исследовании это нарушение наблюдалось только в двух случаях из 15 000 тестов на дефицит глутатионредуктазы, проведенных в течение 30 лет. В том же исследовании дефицит глутатионредуктазы был связан с катарактой и фавизмом у одного пациента и его семьи и с тяжелой неконъюгированной гипербилирубинемией у другого пациента. Было высказано предположение, что окислительно-восстановительная система глутатиона (частью которой является глутатионредуктаза) почти исключительно отвечает за защиту клеток хрусталика глаза от перекиси водорода, поскольку эти клетки испытывают дефицит каталазы, фермент, который катализирует расщепление перекиси водорода, и высокую частоту возникновения катаракты у лиц с дефицитом глутатионредуктазы. У некоторых пациентов наблюдается недостаточный уровень активности глутатиона в результате отсутствия потребляя достаточное количество рибофлавина в своем рационе. Рибофлавин представляет собой предшественник FAD, восстановленная форма которого отдает два электрона дисульфидной связи, которая присутствует в окисленной форме глутатионредуктазы, чтобы начать каталитический цикл фермента. В 1999 году исследование показало, что 17,8% мужчин и 22,4% женщин, обследованных в Саудовской Аравии, страдали низкой активностью глутатионредуктазы из-за дефицита рибофлавина. Связь с фавизмомВ фавизме у пациентов отсутствует глюкозо-6-фосфатдегидрогеназа, фермент в их пентозофосфатном пути, который восстанавливает НАДФ до НАДФН, катализируя превращение глюкозы-6- фосфат в 6-фосфоглюконо-δ-лактон. У лиц с дефицитом глюкозо-6-фосфатдегидрогеназы меньше НАДФН, доступного для восстановления окисленного глутатиона с помощью глутатионредуктазы. Таким образом, их базальное соотношение окисленного и восстановленного глутатиона значительно выше, чем у пациентов, которые обычно экспрессируют глюкозо-6-фосфатдегидрогеназу, что делает их неспособными эффективно реагировать на высокие уровни активных форм кислорода, которые вызывают клеточную активность. лизис. Мониторинг активности глутатионредуктазыАктивность глутатионредуктазы используется в качестве индикатора окислительного стресса. Активность можно контролировать по потреблению NADPH с поглощением при 340 нм, или образованный GSH можно визуализировать с помощью реагента Эллмана. В качестве альтернативы активность может быть измерена с использованием roGFP (редокс-чувствительный зеленый флуоресцентный белок). В растенияхКак и в клетках человека, глутатионредуктаза помогает защитить растения клетки из активных форм кислорода. У растений восстановленный глутатион участвует в цикле глутатион-аскорбат, в котором восстановленный глутатион восстанавливает дегидроаскорбат, реактивный побочный продукт восстановления перекиси водорода. В частности, глутатионредуктаза способствует реакции растений на абиотический стресс. Было показано, что активность фермента модулируется в ответ на металлы, металлоиды, засоление, засуху, УФ-излучение и тепловой стресс. ИсторияГлутатионредуктаза была впервые очищена в 1955 г. при Йельский университет Э. Ракера. Ракер также идентифицировал НАДФН в качестве первичного донора электронов для фермента. Более поздние группы подтвердили присутствие FAD и тиоловой группы, и первоначальный механизм был предложен для этого механизма в 1965 году. Первоначальная (с низким разрешением) структура глутатионредуктазы была решена в 1977 году. За этим быстро последовала структура 3Å Шульце и др. al. в 1978 году. Глутатионредуктаза была исчерпывающе изучена с тех пор, как эти первые эксперименты были, и впоследствии является одним из наиболее хорошо изученных ферментов на сегодняшний день. Интерактивная карта путейИнтерактивная карта путей можно найти здесь: карта путей СсылкиДополнительная литератураПоследняя правка сделана 2021-05-21 11:22:46
Содержание доступно по лицензии CC BY-SA 3.0 (если не указано иное). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||