 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC (2 E ) -Бут-2-ендиовая кислота | |
| Другие имена | |
| Идентификаторы | |
| Количество CAS | |
| 3D модель ( JSmol ) | |
| Ссылка на Beilstein | 605763 |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.003.404 |
| Номер ЕС | |
| Номер E | E297 (консерванты) |
| Ссылка на Гмелин | 49855 |
| КЕГГ | |
| PubChem CID | |
| Номер RTECS | |
| UNII | |
| Номер ООН | 9126 |
| Панель управления CompTox ( EPA) | |
ИнЧИ
| |
Улыбки
| |
| Характеристики | |
| Химическая формула | С 4 Н 4 О 4 |
| Молярная масса | 116,072 г моль -1 |
| Внешность | Белое твердое вещество |
| Плотность | 1,635 г / см 3 |
| Температура плавления | 287 ° С (549 ° F, 560 К) (разлагается) |
| Растворимость в воде | 4,9 г / л при 20 ° C |
| Кислотность (p K a ) | p k a1 = 3,03, p k a2 = 4,44 (15 ° C, цис-изомер) |
| Магнитная восприимчивость (χ) | -49,11 10 -6 см 3 / моль |
| Дипольный момент | ненулевой |
| Фармакология | |
| Код УВД | D05AX01 ( ВОЗ ) |
| Опасности | |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| Положения об опасности GHS | H319 |
| Меры предосторожности GHS | P264, P280, P305 + 351 + 338, P313 |
| NFPA 704 (огненный алмаз) |  2 1 0 2 1 0 |
| самовоспламенения температуру | 375 ° С (707 ° F, 648 К) |
| Родственные соединения | |
| Родственные карбоновые кислоты | |
| Родственные соединения | |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| | |
| Ссылки на инфобоксы | |
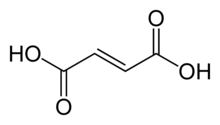
Фумаровая кислота представляет собой органическое соединение с формулой HO 2 CCH = CHCO 2 H. Белое твердое вещество, фумаровая кислота широко встречается в природе. Он имеет фруктовый -like вкус и используется в качестве пищевой добавки. Его номер E - E297. Эти соли и сложные эфиры известны как фумараты. Фумарат также может относиться к C 4 ЧАС 2 О 2- 4 ион (в растворе). Фумаровая кислота является транс-изомером бутендиовой кислоты, а малеиновая кислота - цис-изомером.
Он вырабатывается в эукариотических организмах из сукцината в комплексе 2 цепи переноса электронов с помощью фермента сукцинатдегидрогеназы. Это одна из двух изомерных ненасыщенных дикарбоновых кислот, другая - малеиновая кислота. В фумаровой кислоте группы карбоновых кислот являются транс ( E ), а в малеиновой кислоте - цис ( Z ).
Фумаровая кислота содержится в фумитории ( Fumaria officinalis ), грибах подберезовика (особенно Boletus fomentarius var. Pseudo-igniarius), лишайниках и исландском мхе.
Фумарат - это промежуточный продукт в цикле лимонной кислоты, используемый клетками для производства энергии в форме аденозинтрифосфата (АТФ) из пищи. Она образована окислением из сукцината с помощью фермента сукцинатдегидрогеназы. Затем фумарат превращается ферментом фумаразой в малат.
Кожа человека естественным образом вырабатывает фумаровую кислоту при воздействии солнечного света.
Фумарат также является продуктом цикла мочевины.
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.
[[Файл: [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]]
[[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]] [[ ]]  | {{{bSize}}} px | alt = TCACycle_WP78 edit ]] TCACycle_WP78 править
| {{{bSize}}} px | alt = TCACycle_WP78 edit ]] TCACycle_WP78 править Фумаровая кислота используется в качестве подкислителя пищевых продуктов с 1946 года. Она одобрена для использования в качестве пищевой добавки в ЕС, США, Австралии и Новой Зеландии. В качестве пищевой добавки он используется в качестве регулятора кислотности и может обозначаться E-номером E297. Обычно он используется в напитках и разрыхлителях, к которым предъявляются требования к чистоте. Фумаровая кислота используется при приготовлении пшеничных лепешек в качестве пищевого консерванта и в качестве кислоты при заквашивании. Это, как правило, используется в качестве замены для винной кислоты, а иногда и вместо лимонной кислоты, со скоростью 1 г фумаровой кислоты к каждому ~ 1,5 г лимонной кислоты, для того, чтобы добавить кислотность, аналогично тому, как яблочная кислота используется. Помимо того, что он входит в состав некоторых ароматизаторов искусственного уксуса, таких как ароматизированные картофельные чипсы «Соль и уксус», он также используется в качестве коагулянта в смесях для приготовления пудингов.
Научный комитет Европейской комиссии по питанию животных, входящий в состав DG Health, в 2014 году обнаружил, что фумаровая кислота «практически нетоксична», но высокие дозы, вероятно, нефротоксичны после длительного использования.
Фумаровая кислота была разработана как лекарство для лечения аутоиммунного псориаза в 1950-х годах в Германии в виде таблетки, содержащей 3 сложных эфира, в первую очередь диметилфумарат, и продавалась как фумадерм компанией Biogen Idec в Европе. Позже компания Biogen разработала основной сложный эфир, диметилфумарат, для лечения рассеянного склероза.
У пациентов с ремиттирующим рассеянным склерозом сложный эфир диметилфумарат (BG-12, Biogen) значительно уменьшал рецидивы и прогрессирование инвалидности в исследовании фазы 3. Он активирует путь антиоксидантного ответа Nrf2, первичную клеточную защиту от цитотоксических эффектов окислительного стресса.
Фумаровая кислота используется при производстве полиэфирных смол и многоатомных спиртов, а также в качестве протравы для красителей.
Когда фумаровая кислота добавляется в корм, ягнята производят до 70% меньше метана во время пищеварения.
Он «практически не токсичен», но высокие дозы, вероятно, нефротоксичны после длительного использования.
Фумаровую кислоту сначала получали из янтарной кислоты. Традиционный синтез включает окисление фурфурола (полученного при переработке кукурузы ) с использованием хлората в присутствии катализатора на основе ванадия. В настоящее время промышленный синтез фумаровой кислоты, в основном, на основе каталитической изомеризации из малеиновой кислоты в водных растворах при низких р Н. Малеиновая кислота доступна в больших объемах как продукт гидролиза малеинового ангидрида, полученный каталитическим окислением бензола или бутана.
О химических свойствах фумаровой кислоты можно судить по составляющим ее функциональным группам. Эта слабая кислота образует сложный диэфир, она присоединяется по двойной связи и является отличным диенофилом.
Фумаровая кислота не сгорает в калориметре бомбы в условиях, когда малеиновая кислота плавно сгорает. Для обучающих экспериментов, предназначенных для измерения разницы в энергии между цис- и транс-изомерами, измеренное количество углерода может быть измельчено с исследуемым соединением, а энтальпия сгорания рассчитана по разнице.
| |||
|---|---|---|---|
| |      | ||
| | | НАДН + Н + + СО 2 | |
| CoA | НАД + | ||
 ЧАС 2 О ЧАС 2 О  цис- Аконитат ЧАС 2 О НАД (P) + НАД (Ф) Н + Н + НАД (P) + НАД (Ф) Н + Н +  CO 2 CO 2  | |||
| |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||