 Проточная цитометрия с трубочкой для всасывания Проточная цитометрия с трубочкой для всасывания | |
| Классификация | Цитометрия |
|---|---|
| Аналиты | Клетки или частицы |
| Другие методы | |
| Связанные | Счетчик Культера |
Проточная цитометрия (FC) - используемый метод для обнаружения и измерения физических и химических характеристик популяции клеток или частиц.
В этом процессе образец, содержащий клетки или частицы, суспендируется в жидкости и вводится в проточный цитометр.. Образец фокусируется таким образом, чтобы в идеале пропускать одну ячейку за раз через лазерный луч, при этом рассеянный свет характерен для ячеек и их компонентов. Клетки часто маркируются флуоресцентными маркерами, поэтому свет поглощается, а затем излучается в диапазоне длин волн. Десятки тысяч ячеек могут быть быстро исследованы, а собранные данные обрабатываются компьютером.
Проточная цитометрия обычно используется в фундаментальных исследованиях, клинической практике и клинических испытаниях. Использование проточной цитометрии включает:
Анализатор проточной цитометрии - это прибор, который предоставляет количественные данные по образцу. Другие инструменты, использующие проточную цитометрию, включают сортировщики клеток, которые физически разделяют и таким образом очищают представляющие интерес клетки на основе их оптических свойств.
Первое устройство проточной цитометрии на основе импеданса, использующее принцип Коултера, было раскрыто в патенте США 2656508, выданном в 1953 г. на имя Wal кружево Х. Колтер. Мак Фулвайлер был изобретателем предшественников современных проточных цитометров, в частности, сортировщика клеток. Фулвайлер разработал это в 1965 году в своей публикации в Science. Первое устройство проточной цитометрии на основе флуоресценции (ICP 11) было разработано в 1968 году Вольфгангом Гёде из Университета Мюнстера, подано на патент 18 декабря 1968 года и впервые введено в продажу в 1968/69 немецким разработчиком и производителем. Partec через Phywe AG в Геттингене. В то время другие ученые все еще отдавали предпочтение методам абсорбции по сравнению с методами флуоресценции. Вскоре после этого были разработаны инструменты проточной цитометрии, в том числе Cytofluorograph (1971) от Bio / Physics Systems Inc. (позже: Ortho Diagnostics), PAS 8000 (1973) от Partec, первый инструмент FACS (сортировка клеток с активацией флуоресценции) от Бектон Дикинсон (1974), ICP 22 (1975) из Partec / Phywe и эпики из Коултера (1977/78). Первый безметочный высокочастотный проточный цитометр с импедансом, основанный на запатентованной микрожидкостной «лаборатории на чипе», Ampha Z30, был представлен Amphasys (2012).
Первоначальное название технологии проточной цитометрии на основе флуоресценции было «импульсная цитофотометрия» (немецкий : Impulszytophotometrie), основанное на первой заявке на патент на проточной цитометрии на основе флуоресценции. На 5-й конференции Американского инженерного фонда по автоматизированной цитологии в Пенсаколе (Флорида) в 1976 году - через восемь лет после появления первого проточного цитометра на основе флуоресценции (1968) - было решено использовать название «проточная цитометрия», термин которые быстро стали популярными.
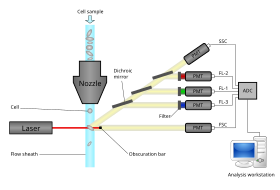 Схематическая диаграмма проточного цитометра, от фокусировки оболочки до сбора данных.
Схематическая диаграмма проточного цитометра, от фокусировки оболочки до сбора данных. Современные проточные цитометры способны анализировать многие тысячи частиц в секунду в "реальном времени" время »и, если он настроен как сортировщик ячеек, может активно разделять и изолировать частицы с заданными оптическими свойствами с аналогичными скоростями. Проточный цитометр похож на микроскоп, за исключением того, что вместо получения изображения клетки проточная цитометрия предлагает высокопроизводительную автоматизированную количественную количественную оценку определенных оптических параметров на клетке: поклеточная основа. Для анализа твердых тканей сначала необходимо приготовить одноклеточную суспензию.
Проточный цитометр состоит из пяти основных компонентов: проточной ячейки, измерительной системы, детектора, системы амплификации и компьютера для анализа сигналов. Проточная ячейка имеет поток жидкости (жидкость оболочки), которая переносит и выравнивает ячейки так, что они проходят через световой луч одним файлом для измерения. В измерительной системе обычно используются измерения импеданса (или проводимости) и оптические системы - лампы (ртутные, ксеноновые ); мощные лазеры с водяным охлаждением (аргон, криптон, лазер на красителях); маломощные лазеры с воздушным охлаждением (аргон (488 нм), красный-HeNe (633 нм), зеленый-HeNe, HeCd (УФ)); диодные лазеры (синий, зеленый, красный, фиолетовый), дающие световые сигналы. Детектор и система аналого-цифрового преобразования (ADC) преобразует аналоговые измерения прямого рассеянного света (FSC) и бокового рассеянного света (SSC), а также сигналов флуоресценции, специфичных для красителя, в цифровые сигналы, которые могут обрабатываться компьютером.. Система амплификации может быть линейной или логарифмической.
. Процесс сбора данных из образцов с использованием проточного цитометра называется «сбором». Сбор данных опосредуется компьютером, физически подключенным к проточному цитометру, и программным обеспечением, которое обеспечивает цифровой интерфейс с цитометром. Программное обеспечение способно регулировать параметры (например, напряжение, компенсацию) для испытуемого образца, а также помогает отображать исходную информацию об образце при сборе данных об образце, чтобы гарантировать правильность установки параметров. Ранние проточные цитометры были, как правило, экспериментальными устройствами, но технический прогресс позволил широко использовать их в различных клинических и исследовательских целях. Благодаря этим разработкам был разработан значительный рынок оборудования, программного обеспечения для анализа, а также реагентов, используемых для сбора данных, таких как флуоресцентно меченные антитела.
Современные инструменты обычно имеют несколько лазеров и детекторов флуоресценции. Текущий рекорд для коммерческого прибора - десять лазеров и 30 флуоресцентных детекторов. Увеличение количества лазеров и детекторов позволяет метить множественные антитела и может более точно идентифицировать целевую популяцию по их фенотипическим маркерам. Некоторые инструменты могут даже делать цифровые изображения отдельных клеток, что позволяет анализировать расположение флуоресцентного сигнала внутри или на поверхности клеток.
Клетки должны равномерно проходить через центр сфокусированных лазерных лучей для точного измерения оптических свойств клеток в любом проточном цитометре. Целью жидкостной системы является перемещение ячеек одна за другой через луч лазера и через инструмент. Гидродинамика в проточном цитометре с возможностью сортировки клеток также использует поток для переноса отсортированных клеток в пробирки или лунки для сбора.
Для точного позиционирования клеток в струе жидкости используется гидродинамическая фокусировка. используется в большинстве цитометров. Клетки в суспензии попадают в инструмент, окруженный жидкостью внешней оболочки. Образец керна поддерживается в центре жидкости оболочки. Скорость ввода пробы или скорость прохождения ячеек через лазерный запрос можно контролировать с помощью давления жидкости оболочки на керне пробы. В оптимальных условиях центральный поток жидкости и жидкость оболочки не смешиваются.
Технология акустической фокусировки используется в некоторых проточных цитометрах для поддержки гидродинамической фокусировки. Акустические волны (>2 МГц) предварительно фокусируют образец перед введением в оболочку жидкости. Затем предварительно сфокусированный образец вводится в гидродинамическое ядро и проходит через инструмент. Это может помочь повысить точность данных при высокой частоте дискретизации.
Свет, излучаемый флуорофором, находится в спектре длин волн, поэтому объединение нескольких флуорофоров может вызвать перекрытие. Чтобы добавить специфичности, оптические фильтры и дихроичные зеркала используются для фильтрации и перемещения света к детекторам, таким как фотоумножители (ФЭУ) или лавинные фотодиоды. (APD). Оптические фильтры представляют собой полосовые (BP), длинные (LP) или короткие (SP) фильтры. В большинстве проточных цитометров используются дихроичные зеркала и полосовые фильтры для выбора определенных полос оптического спектра.
В спектральной проточной цитометрии используются призмы или дифракционные решетки для рассеивания излучаемого света маркера по детекторная матрица. Это позволяет измерять полный спектр каждой частицы. Затем измеренные спектры отдельных клеток не смешиваются с использованием эталонных спектров всех использованных красителей и спектра автофлуоресценции. Это может позволить расширить дизайн панели и применить новые биологические маркеры.
Проточная цитометрия с визуализацией (IFC) позволяет получать многоканальные изображения клеток. Детекторы, используемые в платформах визуализации, могут быть оборудованы устройством с зарядовой связью (CCD) или дополнительным металлооксидным полупроводником (CMOS) для захвата изображений отдельных клеток.
Каждый флуорохром имеет широкий спектр флуоресценции. Когда используется более одного флуорохрома, может происходить перекрытие между флуорохромами. Эта ситуация называется перекрытием спектра. Эту ситуацию необходимо преодолеть. Например, спектр излучения для FITC и PE таков, что свет, излучаемый флуоресцеином, перекрывает ту же длину волны, что и проходит через фильтр, используемый для PE. Это спектральное перекрытие корректируется путем удаления части сигнала FITC из сигналов PE или наоборот. Этот процесс называется компенсацией цвета, при которой флуорохром вычисляется в процентах для измерения самого себя.
Компенсация - это математический процесс, с помощью которого корректируется спектральное перекрытие данных многопараметрической проточной цитометрии. Поскольку флуорохромы могут иметь широкий диапазон спектра, они могут перекрываться, вызывая нежелательный результат путаницы при анализе данных. Это перекрытие, известное как вторичный эффект и количественно выражаемое в коэффициенте перелива, обычно вызывается детекторами определенного флуорохрома, измеряющими значительный пик длины волны другого флуорохрома. Для внесения этой коррекции чаще всего используется линейная алгебра.
В общем, когда отображаются графики одного или нескольких параметров, это означает, что другие параметры не влияют на показанное распределение. Эта проблема более серьезна, особенно при использовании параметров, превышающих удвоение. В настоящее время не обнаружено никаких инструментов для эффективного отображения многомерных параметров. Компенсация очень важна, чтобы видеть разницу между клетками.
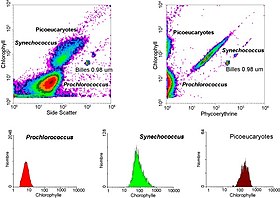 Анализ морского образца фотосинтетического пикопланктона с помощью проточной цитометрии, показывающий три разные популяции (Prochlorococcus, Synechococcus и пикоэукариоты )
Анализ морского образца фотосинтетического пикопланктона с помощью проточной цитометрии, показывающий три разные популяции (Prochlorococcus, Synechococcus и пикоэукариоты )Данные, генерируемые проточными цитометрами, могут быть нанесены на график в одном измерении для получения гистограммы или в виде двухмерных точек. графики или даже в трех измерениях. Области на этих графиках могут быть последовательно разделены на основе флуоресценции интенсивности путем создания серии выделений подмножеств, называемых «гейтами». Специфические протоколы стробирования существуют для диагностических и клинических целей, особенно в отношении гематологии. Отдельные отдельные клетки часто отличаются от дублетов клеток или более высоких агрегатов по их «времени пролета» (также обозначаемому как «ширина импульса ") через узко сфокусированный лазерный луч
Графики часто строятся в логарифмических масштабах. Поскольку спектры излучения разных флуоресцентных красителей перекрываются, знак Все, что есть в детекторах, необходимо компенсировать как электронно, так и вычислительно. Данные, накопленные с помощью проточного цитометра, можно анализировать с помощью программного обеспечения. После сбора данных нет необходимости оставаться подключенным к проточному цитометру, и анализ чаще всего выполняется на отдельном компьютере. Это особенно необходимо на основных объектах, где использование этих машин является большим спросом.
Недавний прогресс в области автоматической идентификации населения с использованием вычислительных методов предложил альтернативу традиционным стратегиям стробирования. Автоматизированные системы идентификации потенциально могут помочь в обнаружении редких и скрытых популяций. Типичные автоматизированные методы включают FLOCK в базе данных иммунологии и портале анализа (ImmPort), SamSPECTRAL и flowClust в Bioconductor и FLAME в GenePattern. T-распределенное стохастическое соседнее встраивание (tSNE) - это алгоритм, предназначенный для уменьшения размерности, чтобы обеспечить визуализацию сложных многомерных данных на двухмерной «карте». Совместные усилия привели к открытому проекту под названием FlowCAP (Flow Cytometry: Critical Assessment of Population Identification Methods,), чтобы предоставить объективный способ сравнения и оценки методов кластеризации данных проточной цитометрии, а также разработать руководство по их надлежащему использованию и применению. методы.
Контроли флуоресценции минус один (FMO) важны для интерпретации данных при построении многоцветных панелей, на которых клетка окрашивается несколькими флуорохромами одновременно. Элементы управления FMO обеспечивают измерение перелива флуоресценции в данном канале и позволяют производить компенсацию. Для создания контроля FMO образец окрашивается всеми флуорохромами, кроме того, который исследуется - это означает, что если вы используете 4 разных флуорохромы, ваш контроль FMO должен содержать только 3 из них (например: флуорохромы - A, B, C, D; FMOs - ABC_, AB_D, A_CD, _BCD).
Сортировка клеток - это метод очистки популяций клеток на основе наличия или отсутствия определенных физических характеристик. В проточных цитометрах с возможностью сортировки прибор обнаруживает клетки, используя параметры, включая размер клеток, морфологию и экспрессию белка, а затем капельную технологию для сортировки клеток и извлечения подмножеств для последующего использования.
Первый прототип сортировщика был построен в Национальной лаборатории Лос-Аламоса (LANL) в 1965 году физиком Маком Дж. Фулвайлером путем соединения датчика объема Коултера с недавно изобретенным струйным принтером. Сортировщик живых клеток или сортировщик клеток с активацией флуоресценции (FACS) был создан Леном Герценбергом, который впоследствии получил приз Киото в 2006 году за свою основополагающую работу.
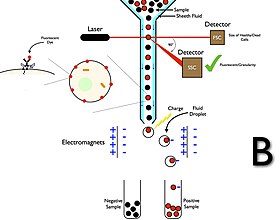 Сортировка клеток с использованием Проточная цитометрия и капельная технология
Сортировка клеток с использованием Проточная цитометрия и капельная технология Сортировщики клеток для проточной цитометрии имеют систему сбора, в отличие от анализаторов проточной цитометрии. Процесс сбора начинается, когда образец вводится в поток жидкости оболочки, который проходит через проточную кювету и перекрывается лазером. Затем поток переносит ячейку через вибрирующее сопло, которое генерирует капли, большинство из которых содержат либо одну ячейку, либо не содержат ячеек. Электрическое зарядное кольцо помещается как раз в том месте, где поток разбивается на капли, и заряд помещается на кольцо непосредственно перед измерением интенсивности флуоресценции; противоположный заряд задерживается на капле, когда она отрывается от потока, и поэтому капли заряжаются. Заряженные капли затем падают через систему электростатического отклонения, которая направляет капли в контейнеры в зависимости от их заряда. В некоторых системах заряд прикладывается непосредственно к потоку, и при отрыве капли сохраняется заряд того же знака, что и у потока. Затем поток возвращается в нейтральное состояние после отрыва капли. После сбора эти клетки можно далее культивировать, обрабатывать и изучать.
 Использование проточной цитометрии для измерения вариации количества копий конкретной последовательности ДНК (Flow-FISH )
Использование проточной цитометрии для измерения вариации количества копий конкретной последовательности ДНК (Flow-FISH )Проточная цитометрия использует световые свойства, рассеянные от клеток или частиц для идентификации или количественного измерения физических свойств. Этикетки, красители и красители можно использовать для многопараметрического анализа (чтобы узнать больше о свойствах клетки). Иммунофенотипирование - это анализ гетерогенных популяций клеток с использованием меченых антител и другие реагенты, содержащие флуорофор, такие как красители и красители.
В качестве меток в проточной цитометрии можно использовать широкий спектр флуорофоров. Обычно флуорофоры или просто «флюоры» прикреплены к антителу, распознающему объект-мишень на клетке или в ней; они также могут быть прикреплены к химическому объекту со сродством к клеточной мембране или другой клеточной структуре. Каждый флуорофор имеет характерный пик возбуждение и излучение волна ength, а спектры излучения часто перекрываются. Следовательно, комбинация меток, которую можно использовать, зависит от длины волны лампы (ламп) или лазера (ов), используемых для возбуждения флуорохромов, и от доступных детекторов. Предполагается, что максимальное количество различимых флуоресцентных меток составляет 17 или 18, и этот уровень сложности требует трудоемкой оптимизации для ограничения артефактов, а также сложных алгоритмов деконволюции для разделения перекрывающихся спектров. Проточная цитометрия использует флуоресценцию как количественный инструмент; максимальная чувствительность проточной цитометрии не имеет себе равных среди других платформ флуоресцентного обнаружения, таких как конфокальная микроскопия. Абсолютная чувствительность к флуоресценции обычно ниже в конфокальной микроскопии, потому что несфокусированные сигналы отклоняются конфокальной оптической системой и потому что изображение создается последовательно из отдельных измерений в каждом месте клетки, что снижает количество времени, доступного для сбора сигнала.
Квантовые точки иногда используются вместо традиционных флуорофоров из-за их более узких пиков излучения.
Массовая цитометрия преодолевает предел флуоресцентного мечения за счет использования изотопов лантанидов, прикрепленных к антителам. Теоретически этот метод может позволить использовать от 40 до 60 различимых этикеток и был продемонстрирован для 30 этикеток. Масс-цитометрия принципиально отличается от проточной цитометрии: клетки вводятся в плазму, ионизируются, а связанные изотопы количественно определяются с помощью времяпролетной масс-спектрометрии. Хотя этот метод позволяет использовать большое количество меток, в настоящее время он имеет меньшую пропускную способность, чем проточная цитометрия. Он также разрушает проанализированные клетки, препятствуя их восстановлению путем сортировки.
В дополнение к способности маркировать и идентифицировать отдельные клетки с помощью флуоресцентных антител, клеточные продукты, такие как цитокины, белки, и другие факторы также могут быть измерены. Подобно сэндвич-анализам ELISA, в цитометрических анализах с матрицей шариков (CBA ) обычно используются несколько популяций шариков. различаются по размеру и разным уровням интенсивности флуоресценции, чтобы различать несколько аналитов в одном анализе. Количество захваченного аналита определяется с помощью биотинилированного антитела против вторичного эпитопа белка с последующей обработкой стрептавидин-R-фикоэритрином. Интенсивность флуоресценции R-фикоэритрина на гранулах количественно определяют на проточном цитометре, оборудованном источником возбуждения 488 нм. Концентрации представляющего интерес белка в образцах могут быть получены путем сравнения флуоресцентных сигналов с сигналами стандартной кривой, полученными при серийном разведении известной концентрации аналита. Обычно также называют набором гранул цитокинов (CBA).
Системы анализа отдельных клеток на основе импеданса обычно известны как счетчики Коултера. Они представляют собой хорошо зарекомендовавший себя метод подсчета и определения размеров практически любых клеток и частиц. Технология без этикеток была недавно усовершенствована подходом, основанным на «лаборатории на кристалле » и применением высокочастотного переменного тока (AC) в радиочастотном диапазоне ( от 100 кГц до 30 МГц) вместо статического постоянного тока (DC) или низкочастотного переменного поля. Эта запатентованная технология позволяет проводить высокоточный анализ клеток и предоставляет дополнительную информацию, такую как емкость мембраны и жизнеспособность. Относительно небольшой размер и надежность позволяют использовать аккумуляторную батарею на объекте в полевых условиях.
Технология имеет приложения в ряде областей, в том числе молекулярная биология, патология, иммунология, вирусология, биология растений и морская биология. Он имеет широкое применение в медицине, особенно в трансплантации, гематологии, иммунологии опухолей и химиотерапии, пренатальной диагностике, генетике и сортировке сперматозоидов для предварительного выбора пола. Проточная цитометрия широко применяется для обнаружения аномалий сперматозоидов, связанных с фрагментацией ДНК в анализах мужской фертильности. Кроме того, он широко используется в исследованиях для обнаружения повреждений ДНК, расщепления каспаз и апоптоза. Фотоакустическая проточная цитометрия используется при изучении бактерий с множественной лекарственной устойчивостью (чаще всего MRSA) для обнаружения, дифференциации и количественного определения бактерий в крови, отмеченных окрашенными бактериофагами. В неврологии также может быть проанализирована совместная экспрессия поверхностных и внутриклеточных антигенов. В морской биологии автофлуоресцентные свойства фотосинтетического планктона могут быть использованы с помощью проточной цитометрии для характеристики численности и структуры сообщества. В микробиологии его можно использовать для скрининга и сортировки мутантных библиотек транспозонов, созданных с использованием транспозонов, кодирующих GFP (TnMHA), или для оценки жизнеспособности. В белковой инженерии проточная цитометрия используется в сочетании с дрожжевым дисплеем и бактериальным дисплеем для идентификации отображаемых на клеточной поверхности вариантов белка с желаемыми свойствами. Основное преимущество проточной цитометрии перед гистологией и ИГХ - это возможность точно измерить количество антигенов и возможность окрашивать каждую клетку множеством антител-флуорофоров, в современных лабораториях с каждой клеткой может быть связано около 10 антител. Это намного меньше, чем массовый цитометр, где в настоящее время можно измерить до 40, но по более высокой цене и медленнее.
Протоколы проточной цитометрии, используемые для исследований, часто нуждаются в валидации из-за риска связывания антител с рецепторами Fc.
Пролиферация клеток является основной функцией иммунной системы. Часто требуется проанализировать пролиферативную природу клеток, чтобы сделать какие-то выводы. Одним из таких тестов для определения пролиферации клеток является отслеживающий краситель карбоксифлуоресцеиндиацетат сукцинимидиловый эфир (CFSE). Это помогает контролировать пролиферативные клетки. Этот анализ дает количественные, а также качественные данные во время экспериментов с временными рядами. Этот краситель ковалентно связывается с долгоживущими молекулами, находящимися внутри клетки. Когда клетки делятся, делятся и молекулы, и дочерние клетки обладают половиной красителя, чем родительская популяция. Это снижение интенсивности можно визуализировать с помощью проточной цитометрии. В литературе этот мощный метод проточной цитометрии и CFSE использовался для определения эффективности Т-клеток в уничтожении клеток-мишеней при раке, таком как лейкемия. Чтобы визуализировать гибель клеток-мишеней, как быструю, так и медленную, ученые использовали маркировку CFSE с окрашиванием антителами определенных типов клеток и флуоресцентно меченных микрогранул. Это также дало информацию о пролиферации клеток-мишеней при обработке определенных цитокинов.