| Люцифераза светлячка | |||||||
|---|---|---|---|---|---|---|---|
 Структура Photinus pyralis светлячок люцифераза. Структура Photinus pyralis светлячок люцифераза. | |||||||
| Идентификаторы | |||||||
| Организм | Photinus pyralis | ||||||
| Символ | Н / Д | ||||||
| PDB | 1LCI | ||||||
| UniProt | P08659 | ||||||
| |||||||
| люцифераза светлячка | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер EC | 1.13.12.7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Представление IntEnz | ||||||||
| BRENDA | Запись BRENDA | ||||||||
| ExPASy | Представление NiceZyme | ||||||||
| KEGG | Запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
Firefly lucifera se представляет собой светоизлучающий фермент, ответственный за биолюминесценцию светлячков и жуков-щелкунов. Фермент катализирует окисление люциферина светлячка, требуя кислорода и АТФ. Из-за потребности в АТФ люциферазы светлячков широко используются в биотехнологии.
Химическая реакция, катализируемая люциферазой светлячков, протекает в два этапа:
Свет образуется, потому что в результате реакции образуется оксилюциферин в электронно возбужденном состоянии. В результате реакции высвобождается фотон света, когда оксилюциферин возвращается в основное состояние ..
Люцифериладенилат может дополнительно участвовать в побочной реакции с O 2 с образованием пероксида водорода и дегидролюциферил-АМФ. Около 20% промежуточного люцифериладенилата окисляется в этом пути.
Люцифераза светлячка генерирует свет из люциферина в многоступенчатом процессе. Во-первых, D-люциферин аденилируется с помощью MgATP с образованием люцифериладенилата и пирофосфата. После активации АТФ люцифериладенилат окисляется молекулярным кислородом с образованием диоксетанонового кольца. Реакция декарбоксилирования формирует возбужденное состояние оксилюциферина, который таутомеризуется между кето-енольной формой. В результате реакция излучает свет, когда оксилюциферин возвращается в основное состояние.
 Механизм действия люциферазы.
Механизм действия люциферазы. 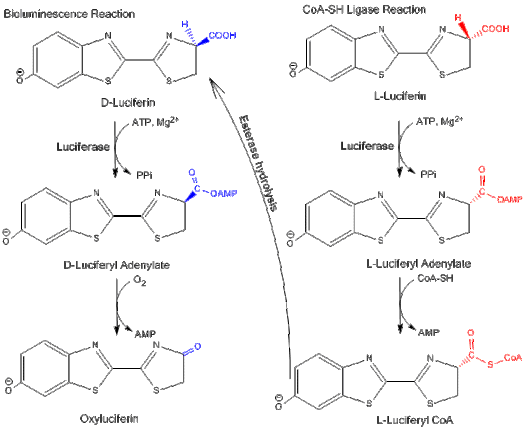 Люцифераза имеет два режима активности фермента: биолюминесцентная активность и активность CoA-синтетазы.
Люцифераза имеет два режима активности фермента: биолюминесцентная активность и активность CoA-синтетазы. Люцифераза может функционируют двумя разными путями: путь биолюминесценции и путь CoA -лигазы. В обоих путях люцифераза первоначально катализирует реакцию аденилирования с помощью MgATP. Однако в пути CoA-лигазы CoA может замещать AMP с образованием.
Жирная ацил-КоА синтетаза аналогичным образом активирует жирные кислоты АТФ с последующим замещением АМФ КоА. Благодаря схожей активности люцифераза способна заменять жирную ацил-КоА синтетазу и превращать длинноцепочечные жирные кислоты в жирно-ацил-КоА для бета-окисления.
Белковая структура люциферазы светлячков состоит из двух компактных доменов : N-концевого домена и С-концевого домена. N-концевой домен состоит из двух β-листов в структуре αβαβα и β-ствола. Два β-листа укладываются друг на друга, причем β-цилиндр покрывает конец листов.
С-концевой домен соединен с N-концевым доменом посредством гибкого шарнира, который может разделите два домена. аминокислотные последовательности на поверхности двух обращенных друг к другу доменов являются консервативными в бактериальной люциферазе и люциферазе светлячка, тем самым убедительно предполагая, что активный сайт расположен в щель между доменами.
Во время реакции люцифераза претерпевает конформационное изменение и переходит в «закрытую» форму, когда два домена объединяются, чтобы заключить субстрат. Это гарантирует, что вода исключена из реакции и не гидролизует АТФ или электронно-возбужденный продукт.
 Схема вторичной структуры люциферазы светлячков. Стрелки представляют β-нити, а кружки представляют α-спирали. Расположение каждого из субдоменов в последовательности люциферазы показано на нижней диаграмме.
Схема вторичной структуры люциферазы светлячков. Стрелки представляют β-нити, а кружки представляют α-спирали. Расположение каждого из субдоменов в последовательности люциферазы показано на нижней диаграмме. Цвет биолюминесценции люциферазы светлячков может варьироваться от желто-зеленого (λ max = 550 нм) до красного (λ max = 620). В настоящее время существует несколько различных механизмов, описывающих, как структура люциферазы влияет на спектр излучения фотона и эффективно на цвет излучаемого света.
Один механизм предполагает, что цвет излучаемого света зависит от того, находится ли продукт в форме кето или енола. Механизм предполагает, что красный свет излучается кето-формой оксилюциферина, а зеленый свет излучается енольной формой оксилюциферина. Однако он излучает зеленый свет, даже если он сужен до кето-формы, потому что не может таутомеризоваться.
Другой механизм предполагает изменение угла между кольцами бензотиазола и тиазола в оксилюциферин определяет цвет биолюминесценции. Это объяснение предполагает, что плоская форма с углом 0 ° между двумя кольцами соответствует более высокому энергетическому состоянию и излучает зеленый свет с более высокой энергией, тогда как угол 90 ° переводит структуру в более низкое энергетическое состояние и излучает более низкую энергию. -энергетический красный свет.
Самое последнее объяснение цвета биолюминесценции исследует микросреду возбужденного оксилюциферина. Исследования показывают, что взаимодействия между продуктом возбужденного состояния и близлежащими остатками могут заставить оксилюциферин перейти в еще более высокую энергетическую форму, что приводит к излучению зеленого света. Например, Arg 218 имеет электростатические взаимодействия с другими соседними остатками, ограничивая таутомеризацию оксилюциферина до енольной формы. Аналогичным образом, другие результаты показали, что микросреда люциферазы может заставить оксилюциферин превращаться в более жесткую высокоэнергетическую структуру, заставляя ее излучать зеленый свет высокой энергии.
D- Люциферин является субстратом для реакции биолюминесценции люциферазы светлячков, а L-люциферин является субстратом для активности люциферил-КоА синтетазы. Обе реакции ингибируются энантиомером субстрата: L-люциферин и D-люциферин ингибируют путь биолюминесценции и путь CoA-лигазы, соответственно. Это показывает, что люцифераза может различать изомеры структуры люциферина.
L-люциферин способен излучать слабый свет, даже если он является конкурентным ингибитором D-люциферина и пути биолюминесценции. Свет излучается, потому что путь синтеза КоА может быть преобразован в реакцию биолюминесценции путем гидролиза конечного продукта через эстеразу обратно до D-люциферина.
Активность люциферазы дополнительно ингибируется оксилюциферином и аллостерически активировано АТФ. Когда АТФ связывается с двумя аллостерическими сайтами фермента, сродство люциферазы к связыванию АТФ в его активном сайте увеличивается.