Fas-лиганд (FasL или CD95 L или CD178) относится к типу II трансмембранный белок, который принадлежит к семейству фактора некроза опухоли (TNF). Его связывание с его рецептором вызывает апоптоз. Взаимодействия Fas-лиганд / рецептор играют важную роль в регуляции иммунной системы и прогрессировании рака.
Fas-лиганд или FasL представляет собой гомотримерный трансмембранный белок типа II, экспрессируемый на цитотоксических Т-лимфоцитах. Он передает сигнал посредством тримеризации FasR, который охватывает мембрану «целевой» клетки. Эта тримеризация обычно приводит к апоптозу или гибели клеток.
Растворимый лиганд Fas образуется путем расщепления связанного с мембраной FasL в консервативном сайте расщепления внешней матричной металлопротеиназой MMP-7.
Fas образует индуцирующий смерть сигнальный комплекс (DISC) при связывании лиганда. Заякоренный в мембране тример лиганда Fas на поверхности соседней клетки вызывает тримеризацию рецептора Fas. Это событие также имитируется связыванием агонистического Fas антитела, хотя некоторые данные свидетельствуют о том, что апоптотический сигнал, индуцированный антителом, ненадежен при изучении передачи сигналов Fas. С этой целью было использовано несколько умных способов тримеризации антитела для исследования in vitro.
После последующей агрегации домена смерти (DD) рецепторный комплекс интернализуется через клеточный эндосомный аппарат. Это позволяет адаптивной молекуле Fas-ассоциированному домену смерти (FADD) связывать домен смерти Fas через свой собственный домен смерти. FADD также содержит эффекторный домен смерти (DED) рядом с его амино-концом, который способствует связыванию с DED FADD -подобного ICE (FLICE ), чаще всего обозначается как каспаза-8. Затем FLICE может самоактивироваться посредством протеолитического расщепления на субъединицы p10 и p18, две из которых образуют активный фермент гетеротетрамер. Затем активная каспаза-8 высвобождается из DISC в цитозоль, где она расщепляет другие эффекторные каспазы, что в конечном итоге приводит к деградации ДНК, образованию пузырей на мембранах и другим признакам апоптоза.
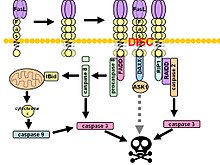 Сигнальные пути Фас. Пунктирные серые линии представляют несколько этапов передачи сигналов JNK
Сигнальные пути Фас. Пунктирные серые линии представляют несколько этапов передачи сигналов JNK В некоторых сообщениях предполагается, что внешнего пути Fas достаточно для индукции полного апоптоза в определенных типах клеток посредством сборки DISC и последующей активации каспазы-8. Эти клетки называются клетками типа 1 и характеризуются неспособностью антиапоптотических членов семейства Bcl-2 (а именно Bcl-2 и Bcl-xL ) защищать от Fas. -опосредованный апоптоз. Характерные клетки типа 1 включают H9, CH1, SKW6.4 и SW480, все из которых являются линиями лимфоцитов, за исключением последней, которая относится к линии аденокарциномы толстой кишки.
Доказательства перекрестных помех между внешним и внутренним путями существуют в сигнальном каскаде Fas. В большинстве типов клеток каспаза-8 катализирует расщепление проапоптотического BH3 -only белка Bid в его усеченную форму, tBid. Только BH-3 члены семейства Bcl-2 взаимодействуют исключительно с антиапоптотическими членами семейства (Bcl-2, Bcl-xL), позволяя Bak и Bax перемещаться в наружная митохондриальная мембрана, таким образом проникая в нее и облегчая высвобождение проапоптотических белков, таких как цитохром c и Smac / DIABLO, антагонист ингибиторов белков апоптоза (IAP ).
Растворимый FasL менее активен, чем его мембраносвязанный аналог, и не индуцирует тримеризацию рецептора и образование DISC.
 Обзор путей передачи сигнала, участвующих в апоптозе
Обзор путей передачи сигнала, участвующих в апоптозе Апоптоз, запускаемый связыванием лиганда Fas-Fas, играет фундаментальную роль в регуляции иммунной системы. Его функции включают:
Опосредованный дефектным Fas апоптоз может приводить к онкогенезу, а также к лекарственной устойчивости существующих опухолей. Мутация Fas в зародышевой линии связана с аутоиммунным лимфопролиферативным синдромом (ALPS), детским заболеванием апоптоза.
Повышение Fas-опосредованной передачи сигналов было вовлечено в патологию миелодиспластических синдромов низкого риска (MDS) и глиобластомы.
Совсем недавно, FasL-опосредованный апоптоз T клетки также были предложены в качестве иммунного ускользающего механизма, с помощью которого опухоли могут подавлять инфильтрацию Т-лимфоцитов, аналогично ингибирующим иммунным контрольным точкам, таким как PD-1 и CTLA-4.
Терапевтическое обоснование подавления передачи сигналов Fas в контексте глиобластомы и миелодиспластических синдромов (MDS) привело к развитию слитого белка Fas какунерцепта (APG101 ), который в настоящее время находится в стадии клинической разработки по этим показаниям.
Было показано, что лиганд Fas взаимодействует с: