 Уровни энергии для электрона в атоме : основное состояние и возбужденные состояния. После поглощения энергии электрон может "перепрыгнуть" из основного состояния в возбужденное состояние с более высокой энергией.
Уровни энергии для электрона в атоме : основное состояние и возбужденные состояния. После поглощения энергии электрон может "перепрыгнуть" из основного состояния в возбужденное состояние с более высокой энергией. A квантовая система или частица, которая связана - то есть ограниченный пространственно - может принимать только определенные дискретные значения энергии, называемые уровнями энергии . Это контрастирует с классическими частицами, которые могут иметь любое количество энергии. Этот термин обычно используется для уровней энергии электронов в атомах, ионах или молекулах, которые связаны электрическими поле ядра, но может также относиться к энергетическим уровням ядер или колебательным или вращательным уровням энергии в молекулах. Энергетический спектр системы с такими дискретными уровнями энергии называется квантованным. (И уровни энергии не обязательно должны быть равными)
В химии и атомная физика, электронная оболочка или главный энергетический уровень, может рассматриваться как орбита одного или нескольких электронов вокруг атома ядро . Ближайшая к ядру оболочка называется «оболочкой 1» (также называемой «оболочкой K»), за ней следует «оболочка 2» (или «оболочка L»), затем «оболочка 3» (или «оболочка M»)., и так далее, все дальше и дальше от ядра. Оболочки соответствуют основным квантовым числам (n = 1, 2, 3, 4...) или обозначены в алфавитном порядке буквами, используемыми в рентгеновской нотации (K, L, M, N…).
Каждая оболочка может содержать только фиксированное количество электронов: первая оболочка может содержать до двух электронов, вторая оболочка может содержать до восьми (2 + 6) электронов, третья оболочка может содержать до 18 (2 + 6 + 10) и так далее. Общая формула такова, что n-я оболочка в принципе может удерживать до 2 (n ) электронов. Поскольку электроны электрически притягиваются к ядру, электроны атома обычно занимают внешние оболочки только в том случае, если более внутренние оболочки уже полностью заполнены другими электронами. Однако это не строгое требование: атомы могут иметь две или даже три неполные внешние оболочки. (Подробнее см. правило Маделунга.) Для объяснения того, почему электроны существуют в этих оболочках, см. электронная конфигурация.
Если потенциальная энергия установлена на ноль в бесконечное расстояние от атомного ядра или молекулы, обычное соглашение, тогда связанные электронные состояния имеют отрицательную потенциальную энергию.
Если атом, ион или молекула находятся на минимально возможном уровне энергии, говорят, что они и их электроны находятся в основном состоянии. Если он находится на более высоком уровне энергии, говорят, что он возбужден, или возбуждены любые электроны, которые имеют более высокую энергию, чем основное состояние. Если более одного квантово-механического состояния имеют одинаковую энергию, уровни энергии являются «вырожденными». Затем они называются вырожденными уровнями энергии.
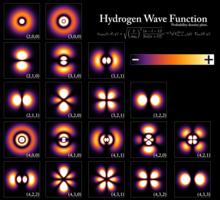 Волновые функции атома водорода, показывающие вероятность нахождения электрона в пространстве вокруг ядра. Каждое стационарное состояние определяет определенный уровень энергии атома.
Волновые функции атома водорода, показывающие вероятность нахождения электрона в пространстве вокруг ядра. Каждое стационарное состояние определяет определенный уровень энергии атома. Квантованные уровни энергии являются результатом соотношения между энергией частицы и ее длиной волны. Для ограниченной частицы, такой как электрон в атоме, волновая функция имеет форму стоячих волн. Могут существовать только стационарные состояния с энергиями, соответствующими целым числам длин волн; для других состояний волны интерферируют деструктивно, в результате чего плотность вероятности равна нулю. Элементарные примеры, которые математически показывают, как возникают уровни энергии, - это частица в ящике и квантовый гармонический осциллятор.
Первым свидетельством квантования в атомах было наблюдение спектральных линий в солнечном свете в начале 1800-х годов Йозефом фон Фраунгофер и Уильямом Хайдом Волластоном. Понятие энергетических уровней было предложено в 1913 году датским физиком Нильсом Бором в теории Бора атома. Современная квантово-механическая теория, объясняющая эти уровни энергии в терминах уравнения Шредингера, была выдвинута Эрвином Шредингером и Вернером Гейзенбергом в 1926 году.
В формулах для энергии электронов на различных уровнях, приведенных ниже в атоме, нулевая точка для энергии устанавливается, когда рассматриваемый электрон полностью покинул атом, т.е. когда главное квантовое число электрона n = ∞. Когда электрон связан с атомом в любом более близком значении n, энергия электрона ниже и считается отрицательной.
Предположим, что есть один электрон на данной атомной орбитали в водородоподобном атоме (ион). Энергия его состояния в основном определяется электростатическим взаимодействием (отрицательного) электрона с (положительным) ядром. Уровни энергии электрона вокруг ядра определяются выражением:

(обычно между 1 эВ и 10 эВ), где R ∞ - константа Ридберга, Z - атомный номер , n - главное квантовое число, h - постоянная Планка, c - скорость света. Только для водородоподобных атомов (ионов) ридберговские уровни зависят только от главного квантового числа n.
Это уравнение получено путем объединения формулы Ридберга для любого водородоподобного элемента (показанного ниже) с E = h ν = hc / λ, предполагая, что главное квантовое число n выше = n 1 в формуле Ридберга и n 2 = ∞ (главное квантовое число энергетического уровня, с которого спускается электрон при испускании фотона ). Формула Ридберга была получена из эмпирических данных спектроскопической эмиссии.

Эквивалентная формула может быть получена квантово-механически из не зависящего от времени Уравнение Шредингера с кинетической энергией гамильтоновым оператором с использованием волновой функции в качестве собственной функции для получения уровней энергии как собственных значений, но постоянная Ридберга будет заменена другими константами фундаментальной физики.
Если вокруг атома находится более одного электрона, электрон-электронные взаимодействия повышают уровень энергии. Этими взаимодействиями часто пренебрегают, если пространственное перекрытие электронных волновых функций невелико.
Для многоэлектронных атомов взаимодействия между электронами приводят к тому, что предыдущее уравнение больше не является точным, как указано просто с Z как атомный номер. Простой (хотя и не полный) способ понять это как эффект экранирования, когда внешние электроны видят эффективное ядро с пониженным зарядом, поскольку внутренние электроны прочно связаны с ядром и частично нейтрализуют его заряд.. Это приводит к приблизительной коррекции, где Z заменяется на эффективный заряд ядра, обозначенный как Z eff, который сильно зависит от главного квантового числа.

В таких случаях орбитальные типы (определяемые азимутальным квантовым числом ℓ), а также их уровни в молекуле влияют на Z eff и, следовательно, также влияет на различные энергетические уровни атомных электронов. Принцип Ауфбау заполнения атома электронами для электронной конфигурации принимает во внимание эти различные уровни энергии. Для заполнения атома электронами в основном состоянии сначала заполняются самые низкие энергетические уровни, что соответствует принципу исключения Паули, принципу Ауфбау и Правило Хунда.
Тонкая структура возникает из-за поправок к релятивистской кинетической энергии, спин-орбитальной связи (электродинамического взаимодействия между спином электрона и движение и электрическое поле ядра) и дарвиновский член (контактный член взаимодействия электронов s-оболочки внутри ядра). Они влияют на уровни на типичный порядок величины 10 эВ.
Эта еще более тонкая структура обусловлена электрон-ядерным спин-спиновым взаимодействием, что приводит к типичному изменению уровней энергии на типичный порядок величины 10 эВ.
Существует энергия взаимодействия, связанная с магнитным дипольным моментом, μL, возникающая из электронного орбитального углового момента, L, заданный как

с
 .
.Кроме того, учитывая магнитный момент, возникающий из-за спина электрона.
Из-за релятивистских эффектов (уравнение Дирака ) возникает магнитный момент μS, возникающий из-за спина электрона
 ,
,с g S спин электрона g-фактор (около 2), что дает общий магнитный момент, μ,
 .
.Таким образом, энергия взаимодействия становится
 .
.Химические связи между атомами в форме молекулы, потому что они делают ситуацию более стабильной для задействованных атомов, что обычно означает, что суммарный уровень энергии для задействованных атомов в молекуле ниже, чем если бы атомы были не так связаны. Когда отдельные атомы приближаются друг к другу для ковалентной связи, их орбитали влияют на энергетические уровни друг друга, образуя связывающие и разрыхляющие молекулярные орбитали. Уровень энергии связывающих орбиталей ниже, а уровень энергии разрыхляющих орбиталей выше. Чтобы связь в молекуле была стабильной, ковалентные связывающие электроны занимают связывающую орбиталь с более низкой энергией, что может обозначаться такими символами, как σ или π, в зависимости от ситуации. Соответствующие антисвязывающие орбитали могут быть обозначены добавлением звездочки для получения орбиталей σ * или π *. несвязывающая орбиталь в молекуле - это орбиталь с электронами во внешних оболочках, которые не участвуют в связывании, и ее энергетический уровень такой же, как и у составляющего атома. Такие орбитали можно обозначить как n орбитали. Электроны на n-орбитали обычно представляют собой неподеленные пары. В многоатомных молекулах также задействованы различные колебательные и вращательные уровни энергии.
Грубо говоря, энергетическое состояние молекулы, т.е. собственное состояние молекулярного гамильтониана, представляет собой сумму электронных, колебательных, вращательных, ядерных и поступательных компонентов., такое, что:

где E электронный - собственное значение числа электронный молекулярный гамильтониан (значение поверхности потенциальной энергии ) при равновесной геометрии молекулы.
Уровни молекулярной энергии помечены символами молекулярных терминов. Удельная энергия этих компонентов зависит от конкретного энергетического состояния и вещества.
Существуют различные типы диаграмм уровней энергии для связей между атомами в молекуле.
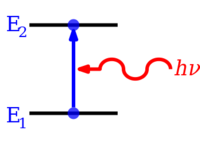 Увеличение уровня энергии от E 1 до E 2 в результате поглощения фотона, представленного красной волнистой стрелкой, и чья энергия составляет h ν
Увеличение уровня энергии от E 1 до E 2 в результате поглощения фотона, представленного красной волнистой стрелкой, и чья энергия составляет h ν  Снижение уровня энергии с E 2 до E 1, что приводит к испусканию фотона, представленного красной волнистой стрелкой, с энергией h ν
Снижение уровня энергии с E 2 до E 1, что приводит к испусканию фотона, представленного красной волнистой стрелкой, с энергией h ν Электроны в атомах и молекулах могут изменять (совершать переходы в) уровни энергии путем испускания или поглощения фотона (электромагнитного излучения ), энергия которого должна быть точно равна разнице энергий между двумя уровнями. Электроны также могут быть полностью удалены из химического вещества, такого как атом, молекула или ион. Полное удаление электрона из атома может быть формой ионизации, которая эффективно перемещает электрон на орбиталь с бесконечным главным квантовым числом, фактически так далеко, что практически не оказывает никакого влияния на оставшийся атом (ион). Для различных типов атомов существуют 1-й, 2-й, 3-й и т. Д. энергии ионизации для удаления из атома 1-го, затем 2-го, затем 3-го и т.д. электронов с наивысшей энергией соответственно. первоначально в основном состоянии. Также может высвобождаться энергия в соответствующих противоположных количествах, иногда в форме энергии фотона, когда электроны добавляются к положительно заряженным ионам или иногда атомам. Молекулы также могут претерпевать переходы на своих колебательных или вращательных уровнях энергии. Переходы уровней энергии также могут быть безызлучательными, что означает, что испускание или поглощение фотона не происходит.
Если атом, ион или молекула находятся на минимально возможном уровне энергии, говорят, что они и их электроны находятся в основном состоянии. Если он находится на более высоком уровне энергии, говорят, что он возбужден, или возбуждены любые электроны, которые имеют более высокую энергию, чем основное состояние. Такие частицы могут быть возбуждены до более высокого уровня энергии посредством поглощения фотона, энергия которого равна разности энергий между уровнями. И наоборот, возбужденные частицы могут перейти на более низкий уровень энергии, спонтанно испуская фотон, равный разности энергий. Энергия фотона равна постоянной Планка (h), умноженной на его частоту (f), и, таким образом, пропорциональна его частоте или обратно его длине волны (λ
, поскольку c, скорость света, равна f λ
. Соответственно, многие виды спектроскопии основаны на обнаружении частота или длина волны испускаемых или поглощенных фотонов для предоставления информации об анализируемом материале, включая информацию об уровнях энергии и электронной структуре материалов, полученных путем анализа спектра.
Звездочка обычно обозначается используется для обозначения возбужденного состояния. Электронный переход в связи молекулы из основного состояния в возбужденное состояние может иметь обозначение, такое как σ → σ *, π → π * или n → π *, означающее возбуждение электрона от σ-связи до σ разрыхляющая орбиталь, от π-связи к π-антисвязывающей орбитали или от n-несвязывающей орбитали до π-антисвязывающей орбитали. Обратные электронные переходы для всех этих типов возбужденных молекул также возможны, чтобы вернуться в их основные состояния, которые можно обозначить как σ * → σ, π * → π или π * → n.
Переход на уровне энергии электрона в молекуле может быть объединен с колебательным переходом и назван вибронным переходом. Колебательный и вращательный переход может быть объединен с помощью вибрационной связи. В ровибронной связи электронные переходы одновременно сочетаются как с колебательными, так и с вращательными переходами. Фотоны, участвующие в переходах, могут иметь энергию в различных диапазонах электромагнитного спектра, например, рентгеновское, ультрафиолетовое, видимое, инфракрасное <185.>или микроволновое излучение, в зависимости от типа перехода. В самом общем виде различия уровней энергии между электронными состояниями больше, различия между колебательными уровнями являются промежуточными, а различия между вращательными уровнями меньше, хотя могут быть перекрытия. Поступательные уровни энергии практически непрерывны и могут быть рассчитаны как кинетическая энергия с использованием классической механики.
Более высокая температура заставляет атомы и молекулы жидкости двигаться быстрее, увеличивая их поступательную энергию, и термически возбуждает молекулы до более высоких средних амплитуд колебательных и вращательных мод (возбуждает молекулы до более высоких уровней внутренней энергии). Это означает, что при повышении температуры поступательный, колебательный и вращательный вклады в молекулярную теплоемкость позволяют молекулам поглощать тепло и удерживать больше внутренней энергии. Теплопроводность обычно происходит при столкновении молекул или атомов , передавая тепло друг другу. При еще более высоких температурах электроны могут быть термически возбуждены на более высокие энергетические орбитали в атомах или молекулах. Последующее падение электрона на более низкий энергетический уровень может высвободить фотон, вызывая, возможно, цветное свечение.
Электрон, расположенный дальше от ядра, имеет более высокую потенциальную энергию, чем электрон, расположенный ближе к ядру, поэтому он становится менее связанным с ядром, поскольку его потенциальная энергия отрицательна и обратно пропорциональна его расстоянию от ядра.
Кристаллические твердые вещества, как было обнаружено, имеют энергетические зоны вместо или в дополнение к энергетическим уровням. Электроны могут принимать любую энергию в незаполненной зоне. Поначалу это кажется исключением из требований к уровням энергии. Однако, как показано в теории зон, энергетические зоны фактически состоят из множества дискретных энергетических уровней, которые расположены слишком близко друг к другу, чтобы их можно было разрешить. Внутри полосы количество уровней порядка количества атомов в кристалле, поэтому, хотя электроны на самом деле ограничены этими энергиями, они, по-видимому, могут принимать континуум значений. Важными энергетическими уровнями в кристалле являются верхняя часть валентной зоны , нижняя часть зоны проводимости , уровень Ферми, уровень вакуума., и уровни энергии любого в кристалле.