 Ион масс-спектрометр-ловушка с диссоциацией с переносом электрона
Ион масс-спектрометр-ловушка с диссоциацией с переносом электрона  Обозначение фрагментации пептида
Обозначение фрагментации пептида Диссоциация с переносом электрона (ETD ) - метод фрагментации многозарядных газообразных макромолекулы в масс-спектрометре между этапами тандемной масс-спектрометрии (МС / МС). Подобно диссоциации с захватом электронов, ETD вызывает фрагментацию больших многозарядных катионов путем передачи им электронов. ETD широко используется с полимерами и биологическими молекулами, такими как белки и пептиды для анализа последовательности. Перенос электрона вызывает расщепление основной цепи пептида на c- и z-ионы, оставляя нетронутыми лабильные посттрансляционные модификации (PTM). Этот метод хорошо работает только для ионов пептида или полимера с более высоким зарядом (z>2). Однако по сравнению с диссоциацией, вызванной столкновением (CID), ETD является преимуществом для фрагментации более длинных пептидов или даже целых белков. Это делает этот метод важным для нисходящей протеомики. Метод был разработан Хантом и сотрудниками из Университета Вирджинии.
Диссоциация с захватом электронов (ECD) была разработана в 1998 году для фрагментации больших белков для масс-спектрометрического анализа. Поскольку для ECD требуется большое количество электронов, близких к тепловым (<0.2eV), originally it was used exclusively with масс-спектрометрия с ионным циклотронным резонансом с преобразованием Фурье (FTICR), наиболее дорогостоящая форма приборов МС. Менее дорогостоящие варианты, такие как квадрупольное время-время- Полет (Q-TOF), квадрупольная ионная ловушка (QIT) и линейная квадрупольная ионная ловушка (QLT) использовали более энергоемкую диссоциацию, вызванную столкновениями метод (CID), приводящий к случайной фрагментации пептидов и белков. В 2004 году Syka et al. Объявили о создании ETD, метода диссоциации, аналогичного ECD, но с использованием недорогого, широко доступного коммерческого спектрометра. Первый Эксперименты ETD проводились на масс-спектрометре QLT с источником ионизации электрораспылением (ESI).
Диссоциация с переносом электрона включает несколько этапов. Обычно белковая смесь сначала разделяется с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Затем многократно-протонированная pr Молекулы эксурсора генерируются ионизацией электрораспылением и вводятся в масс-спектрометр. (В ETD можно использовать только молекулы с зарядом 2+ или больше.) Для того, чтобы электрон был передан положительным молекулам-предшественникам, генерируются анионы-радикалы и помещаются вместе с ними в ионную ловушку. Во время ионно-ионной реакции электрон передается положительно заряженному белку или пептиду, вызывая фрагментацию по основной цепи пептида. Наконец, полученные фрагменты подвергаются массовому анализу.
В первоначальных экспериментах с ETD антрацен (C14H10) использовали для образования реактивных анион-радикалов посредством отрицательной химической ионизации. Несколько молекул полициклических ароматических углеводородов были использованы в последующих экспериментах, при этом флуорантен в настоящее время является предпочтительным реагентом. Однако флуорантен имеет лишь около 40% эффективности в переносе электронов, поэтому ведется поиск других молекул с низким сродством к электрону.
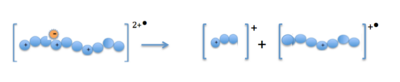
 Многозарядный ион-предшественник реагирует с анион-радикалом
Многозарядный ион-предшественник реагирует с анион-радикалом Когда катионы-предшественники (белки или пептиды) и анион-радикалы объединяются в ионной ловушке; электрон передается многозарядному катиону. Это образует нестабильный положительный катион-радикал с одним положительным зарядом меньше и с нечетным электроном. Фрагментация происходит вдоль основной цепи пептида по связи N- Cα, в результате чего образуются ионы фрагментов c- и z-типа.
 Фрагменты катион-радикалов белка или пептида на c-ион и z-ион
Фрагменты катион-радикалов белка или пептида на c-ион и z-ион Фрагментация, вызванная ETD, позволяет получить более полную информацию о последовательности белка из спектров ETD, чем из тандемной масс-спектрометрии CID. Поскольку многие ионы c- и z-типа обнаруживаются в основной цепи пептидов, по спектрам фрагментации ETD можно различить почти полное покрытие последовательности многих пептидов. Последовательности из 15-40 аминокислот как на N-конце, так и на C-конце белка могут быть считаны с использованием значений массы к заряду для одно- и двухзарядных ионов. Эти последовательности вместе с измеренной массой интактного белка можно сравнить с записями в базе данных для известных белков и выявить посттрансляционные модификации.
 Схематическая диаграмма LTQ с ETD
Схематическая диаграмма LTQ с ETD  Bruker ионная ловушка большой емкости с ETD (схематическая диаграмма)
Bruker ионная ловушка большой емкости с ETD (схематическая диаграмма) Диссоциация с переносом электрона происходит в масс-спектрометре с ионной ловушкой с источником ионизации электрораспылением. В первых экспериментах по ETD в Университете Вирджинии использовалась радиочастотная квадрупольная линейная ионная ловушка (LQT), модифицированная источником химической ионизации (CI) на задней стороне прибора (см. Диаграмму справа). Поскольку спектр может быть получен примерно за 300 миллисекунд, жидкостная хроматография часто сочетается с ETD MS / MS. Недостатком использования LQT является то, что разрешающая способность по массе меньше, чем у других масс-спектрометров.
В последующих исследованиях были опробованы другие приборы для улучшения разрешения по массе. Наличие отрицательного источника ХИ на задней панели прибора мешает работе анализатора высокого разрешения в LQT-Orbitrap и квадрупольном времяпролетном (QTOF), поэтому были введены альтернативные методы ионизации анион-радикалов.
В 2006 году группа в Университете Пердью под руководством Скотта МакЛаки использовала тандемный масс-спектрометр квадруполь / время пролета (QqTOF) с импульсным источником двойной ионизации нано-ESI / химической ионизацией при атмосферном давлении (APCI) с использованием анион-радикалы 1,3-динитробензола в качестве донора электронов. Позже лаборатория Университета Висконсина адаптировала гибридный квадрупольный масс-спектрометр с линейной ионной ловушкой и орбитальной ловушкой для использования ETD. В этом методе также использовался метод предварительной ионизации анион-радикалов 9-антраценкарбоновой кислоты с помощью двойных импульсных источников ESI.
Поскольку ETD становится все более популярным для анализа структуры белков и пептидов, его реализация на легко доступных ионных ловушках масс-спектрометры в сочетании с масс-анализаторами с высоким разрешением продолжают развиваться.
ETD широко используется при анализе белков и больших пептидов. Важные посттрансляционные модификации, включая фосфорилирование, гликозилирование и дисульфидные связи, все анализируются с использованием ETD.
Хотя анализы полимеров на основе МС в основном проводились с использованием одного -стадийная МС, тандемная МС также использовалась для характеристики полимерных компонентов. CID - наиболее распространенный используемый метод диссоциации, но ETD использовался как дополнительный метод. Уникальные разрывы связи, возникающие в результате ETD, предоставляют ценную диагностическую информацию.