| Просмотр / редактирование человека | Просмотр / Edit Mouse |
Дофамин-бета-гидроксилаза (DBH ), также известная как дофамин-бета-монооксигеназа, является ферментом (EC 1.14.17.1 ), который у человека кодируется геном DBH . Дофамин-бета-гидроксилаза катализирует превращение дофамина в норэпинефрин.

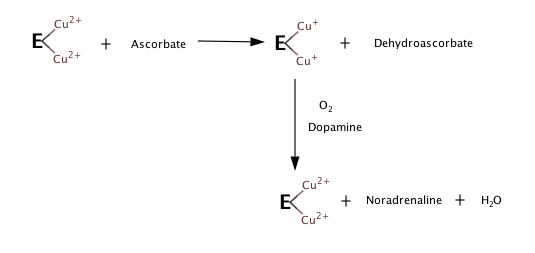
Три субстрата фермента - это дофамин, витамин C (аскорбат) и O2. продуктами являются норэпинефрин, дегидроаскорбат, а H2O.
DBH представляет собой медьсодержащую оксигеназу массой 290 кДа, состоящую из четырех идентичных субъединиц, и его активность требует аскорбата в качестве кофактора.
. Это единственный фермент, участвующий в синтезе низкомолекулярных нейромедиаторов, связанных с мембраной, что делает норэпинефрин единственным известным медиатором, синтезируемым внутри везикул. Он экспрессируется в норадренергических нейронах центральной нервной системы (т. Е. locus coeruleus ) и периферических нервных систем (т. Е. Симпатических ганглиев), а также в хромаффинных клетках надпочечников. medulla.
| дофамин-бета-монооксигеназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 1.14.17.1 | ||||||||
| Номер CAS | 9013-38-1 | ||||||||
| Базы данных | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | запись BRENDA | ||||||||
| ExPASy | представление NiceZyme | ||||||||
| KEGG | запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Онтология гена | AmiGO / QuickGO | ||||||||
| |||||||||
На основе наблюдений за тем, что происходит, когда нет субстрата или кислорода, следующие стадии, по-видимому, составляют реакцию гидроксилирования.
Хотя детали механизма DBH еще не подтверждены, DBH гомологичен другому ферменту, пептидилглицин-α-гидроксилирующей монооксигеназе (PHM). Поскольку DBH и PHM имеют схожие структуры, можно смоделировать механизм DBH на основе того, что известно о механизме PHM.
Биосинтетические пути для катехоламинов и следовых аминов в головном мозге человека  L-фенилаланин L-тирозин L-ДОПА эпинефрин фенэтиламин р-тирамин допамин норэпинефрин N- Метилфенэтиламин N-метилтирамин п-октопамин синефрин 3-метокситирамин AADC AADC AADC первичный. путь PNMT PNMT PNMT PNMT AAAH AAAH мозг. CYP2D6 второстепенный. путь COMT DBH DBH L-фенилаланин L-тирозин L-ДОПА эпинефрин фенэтиламин р-тирамин допамин норэпинефрин N- Метилфенэтиламин N-метилтирамин п-октопамин синефрин 3-метокситирамин AADC AADC AADC первичный. путь PNMT PNMT PNMT PNMT AAAH AAAH мозг. CYP2D6 второстепенный. путь COMT DBH DBH |
, катализируемой допамин-бета-гидроксилазой. гидроксилирование не только дофамина, но и других производных фенилэтиламина, если таковые имеются. Минимальным требованием, по-видимому, является скелет фенилэтиламина : бензольное кольцо с двухуглеродной боковой цепью, заканчивающейся аминогруппой.
Активность DBH в сыворотке крови человека может быть оценена спектрофотометрическим методом или с помощью сверхвысокой производительности жидкостной хроматографии с детектором на фотодиодной матрице (UHPLC-PDA). Чувствительный анализ для определения активности DBH в спинномозговой жидкости с использованием высокоэффективной жидкостной хроматографии с электрохимическим детектором (HPLC-ECD) также был описан ранее.
Было обнаружено, что генетические варианты, такие как однонуклеотидные полиморфизмы (SNP) в локусах DBH, связаны с активностью DBH и хорошо известны выражение количественного признака локусов. Было показано, что варианты аллеля двух регуляторных SNP, а именно rs1611115 и rs1989787, влияют на транскрипцию этого гена. Было обнаружено, что мутации, выявленные в дефиците дофамин-бета-гидроксилазы и несинонимичных SNP, таких как rs6271 в этом гене, вызывают нарушение секреции белка из эндоплазматического ретикулума.
DBH в первую очередь способствует биосинтезу катехоламинов и следовых аминов. Он также участвует в метаболизме ксенобиотиков, связанных с этими веществами; например, человеческий фермент DBH катализирует бета-гидроксилирование амфетамина и пара-гидроксиамфетамина с образованием норэфедрина и пара-гидроксиноэфедрина соответственно.
DBH считается коррелирующим фактором состояний, связанных с принятием решений и наркотиками, например алкоголизмом и курением, синдромом дефицита внимания с гиперактивностью, шизофрения и болезнь Альцгеймера. Неадекватный DBH называется дефицитом дофамин-бета-гидроксилазы.
Было обнаружено, что проксимальные SNP rs1989787 и rs1611115 связаны с когнитивными функциями у пациентов с шизофренией. Кроме того, эти SNP и вариант дистального промотора 19bp Ins / Del (rs141116007) были важны для показателей поздней дискинезии и шкалы позитивных и негативных синдромов (PANSS) у пациентов с шизофренией.
Было трудно получить стабильный кристалл дофамин-бета-гидроксилазы. Следовательно, доступна модель гомологии, основанная на первичной последовательности и сравнении с PHM.
 Экспериментальная структурная модель DBH, основанная на предсказании in silico и физико-химической валидации
Экспериментальная структурная модель DBH, основанная на предсказании in silico и физико-химической валидации Однако кристаллическая структура также была предложена в 2016.
Этот белок может использовать морфееин модель аллостерической регуляции.
| HYD | HP | QCA | IQCA | BI | IAA | |
|---|---|---|---|---|---|---|
| Конкурентоспособный | Аскорбат | Аскорбат | Аскорбат | Аскорбат | Аскорбат | Аскорбат |
| Неконкурентоспособный | Тирамин | Тирамин | ||||
| Смешанный | Тирамин | Тирамин | Тирамин | Тирамин | ||
| Аскорбат - кофактор; тирамин заменяет дофамин, субстрат тезки DBH | ||||||
DBH ингибируется дисульфирамом, трополоном и, наиболее избирательно, непикастатом.
DBH обратимо ингибируется 1-2H-фталазин гидразон (гидралазин; HYD), 2-1H-пиридинон гидразон (2-гидразинопиридин; HP), 2-хинолинкарбоновая кислота (QCA), l-изохинолинкарбоновая кислота (IQCA), 2,2'-би -lH-имидазол (2,2'-биимидазол; BI) и IH-имидазол-4-уксусная кислота (имидазол-4-уксусная кислота; IAA). HYD, QCA и IAA являются аллостерическими конкурентными.
систематическое название этого класса ферментов - 3,4-дигидроксифенэтиламин, аскорбат: оксидоредуктаза кислорода (бета-гидроксилирование).
Другие широко используемые названия включают: