| Глоссарий стыковки |
|---|
|
В области молекулярного моделирования, стыковка - это метод, который предсказывает предпочтительный ориентация одной молекулы по отношению ко второй, когда связывается друг с другом с образованием стабильного комплекса. Знание предпочтительной ориентации, в свою очередь, может быть использовано для прогнозирования силы ассоциации или сродства связывания между двумя молекулами с использованием, например, оценочных функций.
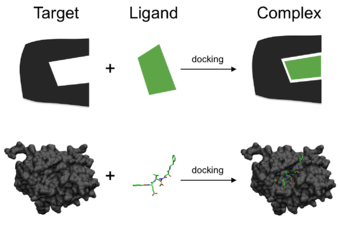 Схематическая иллюстрация стыковки низкомолекулярного лиганда ( зеленый) к белковой мишени (черный), продуцирующей стабильный комплекс.
Схематическая иллюстрация стыковки низкомолекулярного лиганда ( зеленый) к белковой мишени (черный), продуцирующей стабильный комплекс.  Воспроизвести медиа Закрепление небольшой молекулы (зеленый) в кристаллической структуре бета-2-адренорецептора рецептор, связанный с G-белком (PDB : 3SN6 )
Воспроизвести медиа Закрепление небольшой молекулы (зеленый) в кристаллической структуре бета-2-адренорецептора рецептор, связанный с G-белком (PDB : 3SN6 )Ассоциации между биологически релевантными молекулами, такими как белки, пептиды, нуклеиновые кислоты, углеводы и липиды играют центральную роль в передаче сигнала. Кроме того, относительная ориентация двух взаимодействующие партнеры могут влиять на тип производимого сигнала (например, агонизм против антагонизм ). Следовательно, стыковка полезна для прогнозирования как силы, так и типа производимого сигнала.
Молекулярный документ King - один из наиболее часто используемых методов в разработке лекарств на основе структуры, благодаря его способности предсказывать конформацию связывания низкомолекулярных лигандов с соответствующей мишенью связывание сайт. Характеристика поведения связывания играет важную роль в рациональном дизайне лекарств, а также для выяснения фундаментальных биохимических процессов.
Можно думать о молекулярном стыковке как о проблеме «замок и ключ», в которой нужно найти правильную относительную ориентацию «ключа», который откроет «замок» (где на поверхности Замка - отверстие для ключа, в какую сторону поворачивать ключ после того, как он вставлен и т. д.) Здесь белок можно рассматривать как «замок», а лиганд - как «ключ». Молекулярный докинг можно определить как проблему оптимизации, которая описывает «наилучшую» ориентацию лиганда, который связывается с конкретным представляющим интерес белком. Однако, поскольку и лиганд, и белок являются гибкими, аналогия «рука в перчатке» более уместна, чем «замок и ключ». В ходе процесса стыковки лиганд и белок корректируют свою конформацию для достижения общего «наилучшего соответствия», и такой вид конформационного регулирования, приводящий к общему связыванию, называется «индуцированное соответствие» .
Исследования молекулярного докинга сосредоточены на компьютерном моделировании процесса молекулярного распознавания. Он направлен на достижение оптимизированной конформации как для белка, так и для лиганда и относительной ориентации между белком и лигандом, чтобы свести к минимуму свободную энергию всей системы.
Два подхода особенно популярны в сообществе молекулярных стыковок. Один из подходов использует метод сопоставления, который описывает белок и лиганд как комплементарные поверхности. Второй подход моделирует фактический процесс стыковки, в котором рассчитываются энергии парного взаимодействия лиганд-белок. Оба подхода имеют как значительные преимущества, так и некоторые ограничения. Они описаны ниже.
Методы геометрического соответствия / комплементарности формы описывают белок и лиганд как набор свойств, которые делают их стыковочными. Эти особенности могут включать в себя молекулярные поверхности / дескрипторы. В этом случае молекулярная поверхность рецептора описывается в терминах его доступной для растворителя площади поверхности, а молекулярная поверхность лиганда описывается в терминах соответствующего описания поверхности. Комплементарность двух поверхностей составляет описание соответствия формы, которое может помочь найти комплементарную позу стыковки мишени и молекул лиганда. Другой подход состоит в описании гидрофобных свойств белка с использованием поворотов в атомах основной цепи. Еще один подход - использовать технику дескриптора формы Фурье. В то время как подходы, основанные на комплементарности формы, обычно бывают быстрыми и надежными, они обычно не могут точно моделировать движения или динамические изменения конформаций лиганд / белок, хотя недавние разработки позволяют этим методам исследовать гибкость лиганда. Методы комплементарности формы могут быстро сканировать несколько тысяч лигандов за считанные секунды и фактически определять, могут ли они связываться с активным сайтом белка, и обычно масштабируются даже для белок-белковых взаимодействий. Они также намного лучше подходят для подходов, основанных на фармакофоре, поскольку они используют геометрические описания лигандов для поиска оптимального связывания.
Моделирование процесса стыковки намного сложнее. В этом подходе белок и лиганд разделены некоторым физическим расстоянием, и лиганд находит свое положение в активном центре белка после определенного количества «перемещений» в его конформационном пространстве. Движения включают в себя преобразования твердого тела, такие как перемещения и вращения, а также внутренние изменения в структуре лиганда, включая поворот угла кручения. Каждое из этих перемещений в конформационном пространстве лиганда вызывает общую энергетическую стоимость системы. Следовательно, полная энергия системы вычисляется после каждого движения.
Очевидное преимущество моделирования стыковки состоит в том, что гибкость лиганда легко вводится, тогда как методы комплементарности формы должны использовать оригинальные методы для включения гибкости лигандов. Кроме того, он более точно моделирует реальность, в то время как дополнительные методы форм являются скорее абстракцией.
Очевидно, что моделирование требует больших вычислительных ресурсов и требует изучения большого энергетического ландшафта. Сеточные методы, методы оптимизации и увеличенная скорость компьютера сделали моделирование стыковки более реалистичным.
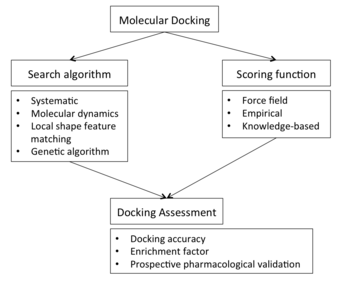 Обзор блок-схемы стыковки
Обзор блок-схемы стыковки Для выполнения экрана стыковки первым требованием является структура интересующего белка. Обычно структура определяется с использованием биофизических методов, таких как рентгеновская кристаллография, ЯМР-спектроскопия или криоэлектронная микроскопия (крио-ЭМ), но также может получены из моделирования построения гомологии. Эта структура белка и база данных потенциальных лигандов служат входными данными для программы стыковки. Успех программы стыковки зависит от двух компонентов: алгоритма поиска и функции оценки .
Теоретически пространство поиска состоит всех возможных ориентаций и конформаций белка, спаренного с лигандом. Однако на практике с текущими вычислительными ресурсами невозможно исчерпывающе исследовать пространство поиска - это потребует перечисления всех возможных искажений каждой молекулы (молекулы динамичны и существуют в ансамбле конформационных состояний) и всех возможных вращательных и трансляционные ориентации лиганда относительно белка на заданном уровне гранулярности. Большинство используемых программ стыковки учитывают все конформационное пространство лиганда (гибкий лиганд), а некоторые пытаются смоделировать гибкий рецептор белка. Каждый «снимок» пары упоминается как поза .
К лиганду и рецептору были применены различные стратегии конформационного поиска. К ним относятся:
Конформации лиганда могут быть сгенерированы в отсутствие рецептора и впоследствии состыкованы или конформации могут быть созданы на лету в присутствии полости связывания рецептора или с полной гибкостью вращения каждого двугранного угла с использованием стыковки на основе фрагментов. Силовое поле оценка энергии чаще всего используется для выбора энергетически разумного конформации, но также использовались методы, основанные на знаниях.
Пептиды являются одновременно очень гибкими и относительно большими молекулами, что делает моделирование их гибкости сложной задачей. Был разработан ряд методов, позволяющих эффективно моделировать гибкость пептидов во время стыковки белок-пептид.
Вычислительная мощность резко возросла за последнее десятилетие, что сделало возможным использование большего количества сложные и требующие больших вычислительных ресурсов методы компьютерной разработки лекарственных препаратов. Тем не менее, проблема гибкости рецепторов в методологиях стыковки все еще остается сложной. Основная причина этой трудности - большое количество степеней свободы, которые необходимо учитывать при такого рода расчетах. Однако пренебрежение им в некоторых случаях может привести к плохим результатам стыковки с точки зрения предсказания позы связывания.
Множественные статические структуры, экспериментально определенные для одного и того же белка в разных конформациях, часто используются для имитации гибкости рецептора. В качестве альтернативы библиотеки ротамеров боковых цепей аминокислот, которые окружают полость связывания, могут быть исследованы для создания альтернативных, но энергетически разумных конформаций белков.
Док-программы генерируют большие число потенциальных поз лиганда, некоторые из которых могут быть немедленно отклонены из-за конфликтов с белком. Остальные оцениваются с использованием некоторой функции подсчета очков, которая принимает позу в качестве входных данных и возвращает число, указывающее вероятность того, что поза представляет собой благоприятное связывающее взаимодействие, и ранжирует один лиганд относительно другого.
Большинство оценочных функций основаны на физике молекулярной механике силовых полях, которые оценивают энергию позы в месте связывания. Различные вклады в связывание можно записать в виде аддитивного уравнения:
Компоненты состоят из эффектов растворителя, конформационных изменений в белке и лиганде, свободной энергии из-за взаимодействий белок-лиганд, внутреннего вращения, энергии ассоциации лиганда и рецептора для образования единого комплекса и свободной энергии из-за изменений в колебательных режимах. Низкая (отрицательная) энергия указывает на стабильную систему и, следовательно, на вероятное связывающее взаимодействие.
Альтернативный подход состоит в том, чтобы получить основанный на знаниях статистический потенциал для взаимодействий из большой базы данных комплексов белок-лиганд, такой как Protein Data Bank, и оценить соответствие позы согласно этому предполагаемому потенциалу.
Существует большое количество структур из рентгеновской кристаллографии для комплексов между белками и лигандами с высокой аффинностью, но сравнительно меньше для лигандов с низким сродством, поскольку более поздние комплексы имеют тенденцию быть менее стабильными и поэтому кристаллизовать труднее. Функции подсчета, обученные с этими данными, могут правильно стыковать лиганды с высоким сродством, но они также дадут правдоподобные стыкованные конформации для лигандов, которые не связываются. Это дает большое количество ложноположительных совпадений, т. Е. Лиганды, согласно прогнозам, связываются с белком, которые на самом деле не связываются при помещении вместе в пробирку.
Один из способов уменьшить количество ложных срабатываний - это пересчитать энергию самых высоко оцениваемых поз с использованием (потенциально) более точных, но более требовательных в вычислительном отношении методов, таких как Generalized Born или Методы Пуассона-Больцмана.
Взаимозависимость между выборкой и функцией подсчета очков влияет на способность стыковки при прогнозировании правдоподобных поз или сродства связывания для новых соединений. Таким образом, обычно требуется оценка протокола стыковки (при наличии экспериментальных данных) для определения его прогностической способности. Оценка стыковки может выполняться с использованием различных стратегий, таких как:
Точность стыковки представляет собой один показатель для количественной оценки пригодности программы стыковки путем рационализации способности предсказывать правильную позу лиганда по отношению к экспериментально наблюдаемой.
стыковочные экраны также могут быть оценены путем обогащения аннотированных лигандов известных связывающих веществ из большой базы данных предполагаемых несвязывающих молекул «приманки ». Таким образом, успешность стыковочного экрана оценивается по его способности обогащать небольшое количество известных активных соединений в верхних рядах экрана среди гораздо большего числа молекул-ловушек в базе данных. Площадь под кривой рабочей характеристики приемника (ROC) широко используется для оценки его характеристик.
Полученные попадания из стыковочных экранов подвергаются фармакологической валидации (например, измерения IC50,аффинности или активности ). Только проспективные исследования представляют собой убедительное доказательство пригодности метода для конкретной цели.
Потенциал стыковочных программ для воспроизведения режимов связывания, определяемый рентгеновской кристаллографией можно оценить с помощью ряда наборов тестов для стыковки.
Для малых молекул существует несколько наборов контрольных данных для стыковки и виртуального скрининга, например Набор Astex Diverse, состоящий из высококачественных рентгеновских кристаллических структур белок-лиганд или Справочника полезных ловушек (DUD) для оценки эффективности виртуального скрининга.
Оценка док-программ на предмет их способности воспроизводить режимы связывания пептидов можно оценить с помощью уроков по оценке эффективности стыковки и подсчета баллов (LEADS-PEP).
Связывающее взаимодействие между небольшой молекулой лигандом и белок фермента может привести к активации или ингибированию фермента. Если белок является рецептором, связывание лиганда может привести к агонизму или антагонизму. Докинг чаще всего используется в области дизайна лекарств - большинство лекарств представляют собой небольшие органические молекулы, и стыковка может применяться для:
Интернет-сервис, рассчитывающий местоположение, геометрию и энергию малых молекул, взаимодействующих с белками