 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК бис (пентакарбонилмарганец) (Mn — Mn) | |
| Другие названия Карбонил марганца. декакарбонилдиманганец | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.030.392 |
| PubChem CID | |
| UNII | |
| CompTox Dashb oard (EPA ) | |
InChI
| |
УЛЫБКА
| |
| Свойства | |
| Химическая формула | Mn2(CO) 10 |
| Молярная масса | 389,98 г / моль |
| Внешний вид | Желтые кристаллы |
| Плотность | 1,750 г / см |
| Плавление точка | 154 ° C (309 ° F; 427 K) |
| Температура кипения | сублимируется при 60 ° C (140 ° F; 333 K) при 0,5 мм рт. Ст. |
| Растворимость в воде | Нерастворим |
| Структура | |
| Кристаллическая структура | моноклинная |
| Постоянная решетки | a = 14,68 Å, b = 14,16 Å, c = 7,16 Å α = 90 °, β = 75 °, γ = 90 ° |
| Формульные единицы (Z) | 4 |
| Дипольный момент | 0 D |
| Опасности | |
| Основные опасности | Источник CO |
| R-фразы (устаревшие) | 23/24/25 |
| S- фразы (устаревшие) | 22-26-36 / 37 / 39-45 |
| Родственные соединения | |
| Родственные соединения | Re2(CO) 10. Co2(CO) 8. Fe3(CO) 12. Fe2(CO) 9 |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
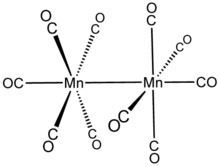
Диманганец декакарбонил - это химическое соединение с формулой Mn2(CO) 10. Этот карбонил металла является важным реагентом в металлоорганической химии марганца.
Сначала соединение было получено с низким выходом путем восстановления йодида марганца с помощью магния в атмосфере CO.. Более эффективное получение влечет за собой восстановление безводного MnCl 2 с помощью бензофенона кетила натрия при давлении CO 200 атмосфер. Доступность недорогого метилциклопентадиенилтрикарбонила марганца («ММТ») имеет привело к пути низкого давления к Mn 2 (CO) 10.
Mn2(CO) 10 не имеет мостиковых лигандов CO: это можно описать (CO) 5 Mn-Mn (CO) 5. Есть два типа лигандов CO; один CO на каждом Mn коаксиален со связью Mn-Mn (293 pm ) и четыре на каждом марганце, которые перпендикулярны ей (экваториально). В стабильном ротамере две субъединицы Mn (CO) 5 расположены в шахматном порядке. Таким образом, вся молекула принадлежит к точечной группе D4d, которая имеет необычную симметрию, общую для S2F10.
Mn2(CO) 10 стабильна на воздухе как кристаллическое твердое тело, но растворы требуются методы Шленка. Он находит ограниченное применение в органическом синтезе. Характерные реакции:
Анион является универсальным нуклеофилом. Протонирование дает гидрид [HMn (CO) 5 ], а метилирование дает [(CH 3) Mn (CO) 5 ].
Mn2(CO) 10 - летучий источник металла и источник CO.