 Новые гены возникли из изначально негенных участков понятные механизмы. (A) Негенная область сначала получает транскрипцию и открытую рамку считывания (ORF) в любом порядке, способствуя рождению гена de novo. ORF только для иллюстративных целей, поскольку гены de novo также могут быть мульти- экзонными или не иметь ORF, как в случае генов РНК. (B) Надпечатка. Создается новая ORF, которая перекрывается с существующей ORF, но в другом фрейме. (C) Экзонизация. Ранее интронная становится альтернативным сплайсингом в виде экзона, например, когда повторяющиеся приобретаются посредством ретропозиции и новые сайты сплайсинга посредством процессов мутаций. Наложение отпечатка и экзонизация рассматриваться как частные случаи рождения гена de novo.
Новые гены возникли из изначально негенных участков понятные механизмы. (A) Негенная область сначала получает транскрипцию и открытую рамку считывания (ORF) в любом порядке, способствуя рождению гена de novo. ORF только для иллюстративных целей, поскольку гены de novo также могут быть мульти- экзонными или не иметь ORF, как в случае генов РНК. (B) Надпечатка. Создается новая ORF, которая перекрывается с существующей ORF, но в другом фрейме. (C) Экзонизация. Ранее интронная становится альтернативным сплайсингом в виде экзона, например, когда повторяющиеся приобретаются посредством ретропозиции и новые сайты сплайсинга посредством процессов мутаций. Наложение отпечатка и экзонизация рассматриваться как частные случаи рождения гена de novo. 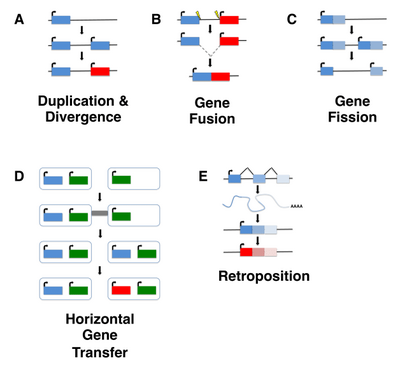 Новые гены могут образовываться из наследственных генов с помощью различных механизмов. (A) Дупликация и дивергенция. После дублирования одна копия подвергается ослабленному отбору и постепенно приобретает новую функцию (и). (B) Слияние генов. Гибридный ген, образованный из некоторых или всех ранее отдельных генов. Влияние генов может происходить по разным механизмам; здесь показано межстраничное удаление. (C) Деление гена. Один ген разделяется, образуя два разных гена, например, в результате дупликации и дифференциальной дегенерации двух копий. (D) Горизонтальный перенос гена. Гены, полученные от других видов горизонтального переноса, подвергаются дивергенции и неофункционализации. (E) Ретропозиция. Транскрипты могут быть подвергнуты обратной транскрипции и интегрированы как ген без интронов в другом месте генома. Этот новый ген может затем претерпеть дивергенцию.
Новые гены могут образовываться из наследственных генов с помощью различных механизмов. (A) Дупликация и дивергенция. После дублирования одна копия подвергается ослабленному отбору и постепенно приобретает новую функцию (и). (B) Слияние генов. Гибридный ген, образованный из некоторых или всех ранее отдельных генов. Влияние генов может происходить по разным механизмам; здесь показано межстраничное удаление. (C) Деление гена. Один ген разделяется, образуя два разных гена, например, в результате дупликации и дифференциальной дегенерации двух копий. (D) Горизонтальный перенос гена. Гены, полученные от других видов горизонтального переноса, подвергаются дивергенции и неофункционализации. (E) Ретропозиция. Транскрипты могут быть подвергнуты обратной транскрипции и интегрированы как ген без интронов в другом месте генома. Этот новый ген может затем претерпеть дивергенцию. Рождение гена de novo - это процесс, посредством которого новые гены эволюционируют из последовательностей ДНК, которые были негенными предками. De novo гены представить собой подмножество новых генов и могут кодировать белок или вместо этого действовать как гены РНК. Процессы, управляющие рождением гена de novo, недостаточно изучены, хотя существует несколько моделей, описывающих возможные механизмы, с помощью которых может происходить рождение гена de novo.
Хотя рождение гена de novo произойти в любой момент эволюционной истории организма, события рождения гена de novo в древности конструкции трудно. Таким образом, большинство исследований генов de novo на сегодняшний день установлено на молодых генах, как правило, таксономически ограниченных генах (TRG), которые присутствуют в одном виде или линии, включая так называемые сиротские гены, определяемые как гены, не имеющий любой идентируемый гомолог. Однако важно отметить, что не все гены-сироты возникают de novo, а вместо этого могут возникнуть посредством достаточно хорошо изученных механизмов, таких как дупликация гена (включая ретропозицию) или горизонтальный перенос генов с последующим расхождением последовательностей или делением / слиянием гена.
Хотя рождение гена de novo когда-то считалось крайне маловероятным, теперь было описано несколько однозначных примеров, и некоторые исследователи предполагают, что рождение гена de novo могло сыграть роль играет важную роль в эволюционных инноваций.
Еще в 1930-х годах J. Б. С. Холдейн и другие предположили, что попытки использования генов могут приводить к новым генам с новыми функциями. В 1970 году Сусуму Оно опубликовал основополагающий текст «Эволюция посредством дупликации генов. Некоторое время спустя единодушное мнение заключено в том, что практически все гены произошли от предковых генов, причем Франсуа Джейкоб в своем эссе 1977 года знаменито отметила, что «вероятность того, что функциональный белок появится de novo в результате случайной ассоциации аминокислот практически равен нулю ».
Однако в том же году Пьер-Поль Грассе ввел термин «наложение» для описания генов посредством экспрессии альтернативных открытых рамокывания (ORF), которые перекрывают уже гены. Эти новые рамки считывания могут быть вне рамки или антисмысловы по отношению к уже существующему гену. Они также могут находиться в рамке существующей ORF, создавая усеченную версию исходного гена, или представить 3 ’расширения существующей ORF в соседней ORF. Первые два типа наложения можно рассматривать как особый подтип рождения гена de novo; Хотя первичная аминокислотная последовательность нового белка перекрывается ранее кодирующей областью генома, она ранее не содержала генома. Первые примеры этого явления у бактериофагов были зарегистрированы в серии исследований с 1976 по 1978 год, и с тех пор было обнаружено множество других примеров у вирусов, бактерий и нескольких видов эукариот.
Феномен экзонизации также представляет собой особый случай рождения гена de novo, при котором, например, часто повторяющиеся интронные наблюдают сайты сплайсинга посредством мутации, что приводит к появлению экзонов de novo. Впервые это было описано в 1994 году в контексте последовательностей Alu, обнаруженных в кодовых областях мРНК приматов. Интересно, что такие de novo экзоны часто появляются в минорных вариантах сплайсинга, что может предложить эволюционное «тестирование» новых последовательностей, сохраняя при этом функциональность основного варианта (ов) сплайсинга.
. Большинство или все эукариотические белки сконструированы из ограниченного пула экзонов «стартового типа». Используя данные о системе, доступный в то время, обзор 1991 года оценил уникальных предковых эукариот, которые были выделены < 60,000, while in 1992 a piece was published estimating that the vast majority of proteins belonged to no more than 1,000 families. Around the same time, however, the sequence of chromosome III of the budding yeast Saccharomyces cerevisiae, что представляет собой первый раз, когда было секвенирована хромосома любого эукариотического организма. Секвенирование всего ядерного генома дрожжей было завершено к началу 1996 года в результате масштабных совместных международных усилий. В своеморе проекта генома дрожжей Бернар Дуйон отметил, что неожиданное обилие генов, лишенных каких-либо известных гомологов, было, пожалуй, самым поразительным открытием всего проекта.
В 2006 и 2007 годах серия исследований предоставила, возможно, первые задокументированные примеры рождения гена de novo без наложения на отпечатков. Анализ транскриптомов добавочных желез Drosophila yakuba и Drosophila erecta впервые выявил 20 предполагаемых генов, ограниченных по клону, которые, по-видимому, вероятно, возникли в результате дупликации генов. Затем Левин и его коллеги подтвердили происхождение de novo пяти генов-кандидатов, специфичных для Drosophila melanogaster и / или близкородственных Drosophila simulans, с помощью тщательного анализа, сочетающего биоинформатические и экспериментальные методы. Эти гены были идентифицированы путем комбинирования подходов, основанных на поиске BLAST и на основе синтении (см. Ниже), что не было отсутствия генов у близкородственных видов.
Несмотря на недавнюю эволюцию, все пять генов кажутся фиксированными D. melanogaster, наличие паралогичных некодирующих последовательностей, которые отсутствуют у близких родственников, предполагает, что из пяти генов могли произойти недавние события внутрихромосомной дупликации. Интересно, что все пять предпочтительно экспрессируются в семенниках самцов мух (см. Ниже). Три гена, для которых существуют полные ORF как у D. melanogaster, так и у D. simulans, используются испытания быстрой эволюции и положительного отбора. Это согласуется с недавним появлением этих генов, поскольку для молодых, новых генов типично адаптивную эволюцию, но это также затрудняет полную уверенность в том, что кандидаты кодируют действительно функциональные продукты. Последующее использование методов аналогичных Levine et al. и библиотека тегов экспрессированной уникальной, полученная из семенников D. yakuba, идентифицировала семь генов, полученные из шести событий рождения гена de novo у D. yakuba и / или близкородственного D. erecta.
Ген BSC4 в S. cerevisiae, выявленный в 2008 г., выявленный в 2008 г., выявленный в 2008 г., выявленный в 2008 г., Три из этих геновских исследований коротких замыканий. свидетельствует о наличии очищающего отбора экспрессируется как на уровне МРНК, так и на уровне белка, а при удалении является синтетически летальным для двух других дрожжевых генов, каждый из которых указывает на функциональную роль продукта гена BSC4, исторически это один аргумент против широко распространенного гена de novo. Интересно, что позже было показано, что Bsc4 принимает частично сложное состояние, которое сочетает в себе свойства сворачивания нативного и неместного белка. функционально охарактеризованным геном de novo был QQS, ген Arabidopsis th aliana идентифицированный в 2009 году, который регулирует метаболизм углерода и азота. Первый функционально охарактеризованный ген de novo, идентифицированный у мышей, некодирующий ген РНК, также был описан в 2009 году. У приматов информационный анализ 2008 года показано, что 15/270 сиротских генов приматов были сформированы de novo. В отчете за 2009 год идентифицированы первые три гена человека de novo, один из которых является терапевтической мишенью хронического лимфолейкозе. С этого набора исследований на уровне генома выявило большое количество орфанных генов у многих организмов, хотя степень их возникновения de novo и степень, в которой они считались функциональными, остаются дискуссионными.
Существует два основных подхода к систематической идентификации новых генов: геномная филостратиграфия и методы на основе синтении. Оба подхода широко используются по отдельности или в качестве взаимодополняемости.
Геномная филостратиграфия включает в себя исследование каждого гена у фокального вида и наличия или отсутствия предковых гомологов с помощью алгоритмов выравнивания последовательностей BLAST или связанных инструментов. Каждому гену целевого вида может быть «возраст» (он же «уровень сохранения»), основанный на заранее определенном филогении, причем возраст соответствует наиболее отдаленным родственным видам, у которых обнаружен гомолог. Когда ген не имеет какого-либо детектируемого гомолога за пределами его собственного генома или близких родственников, он считается новым, таксономически ограниченным или сиротским геном, хотя такое обозначение, конечно, зависит от группы видов, по используемому поиску.
Филогенетические деревья ограничены набором имеющихся совместных геномов, а результаты зависят от критериев поиска BLAST. Он основан на основе сходства последовательностей, для филостратиграфии часто бывает сложно определить, возник ли новый ген de novo или отошел от предкового гена до неузнаваемости, например, после события дублирования. На это указывало исследование, моделировавшее эволюцию генов одного возраста и обнаружившее, что далекие ортологи могут быть не обнаружены для наиболее быстро подходящих генов. При учете изменений в скорости эволюции тех частей молодых генов, которые приобретают выбранные функции, филостратиграфический подход был намного точнее при назначении генов в смоделированных данных. Последующая пара исследований с использованием моделированной эволюции показала, что филогенетическая не смогла структура ортолога у наиболее отдаленно родственных видов для 13,9% генов D. melanogaster и 11,4% генов S. cerevisiae. Точно так же в смоделированных данных обнаруживалась ложная связь между возрастом гена и его вероятностью вовлечения в процесс заболевания. Повторный анализ исследований, в которых использовался филостратиграфия на дрожжах, плодовых мушках и людях, показал, что при учете таких ошибок и исключении анализа трудно стратифицируемых генов качественные выводы не повлияли на все три исследования. Влияние филостратиграфической ошибки на исследования, изучающие различные особенности генов de novo (см. Ниже), остается дискуссионным.
Чтобы повысить обнаруживаемость предковых гомологов, чувствительный поиск на основе сходства на основе последовательностей, таких как CS-BLAST и поиск на основе скрытой марковской модели (HMM), может также может ссылаться, отдельно или в сочетании с анализом филостратиграфии на основе BLAST, идентификации генов de novo. Метод PSI-BLAST особенно полезен для обнаружения древних гомологов. Сравнительное исследование показало, что некоторые из этих «профильных» анализов были более точными, чем обычные парные инструменты. Влияние ложных срабатываний, когда гены ошибочно предполагают наличие гомолога предков, хотя в действительности они являются новыми, на наше понимание рождения гена de novo еще не было специально оценено.
Важно отделить технические трудности, связанные с установлением самого старого предка гена и оценками возраста гена (конечная цель филостратиграфии), от проблем, связанных с установлением механизмов, с помощью которых ген эволюционировал. Молодые гены и гены предков могли развиваться de novo или с помощью других механизмов. Текущий предпочтительный подход для определения, возник ли ген de novo, является синтенией и обычно может использоваться к молодым генам.
Подходы, основанные на анализе синтении Последовательности во внешних группах - блоки, сохраняющие порядок и относительное расположение признаков - идентифицировать негенных предков генов-кандидатов de novo. Синтенические выравнивания закрепляются короткими консервативными «маркерами». Гены наиболее распространенным маркером для определения синтенических блоков, хотя также используются k-меры и экзоны. Предполагаемая, что может быть получено высококачественное синтеническое выравнивание, подтверждение того, что синтеническая область лишена кодирующего у вне группы, позволяет с большей уверенностью утверждать происхождение de novo. Самым убедительным доказательством возникновения de novo является вывод о схеме мутации (-ях), которая создает кодирующий потенциал, обычно посредством анализа микросинтенических регионов близкородственных видов.
Одной из проблем при применении методов, основанных на синтении, является тот факт, что синтению бывает трудно в более длительных временных масштабах. Чтобы решить эту проблему, были опробованы различные методы, такие как использование экзонов, сгруппированных от их порядка определения синтенных блоков или алгоритмов, которые используют хорошо законсервированные геномные области для расширения микросинтетических блоков. Существуют также трудности, связанные с применением подходов, основанных на синтении, к сборкам генома, которые фрагментированы или находятся в клонах с высокой скоростью хромосомных перестроек, как это часто бывает у насекомых. Подходы, основанные на синтении, традиционно имеют меньшую пропускную способность по своей природе, в настоящее время они применяются для полногеномных исследований генов de novo и выделяют многообещающую область алгоритмического развития для определения даты рождения генов. Некоторые использовали подходы, основанные на синтении, в сочетании с поисками методов анализа стандартизованные конвейеры, которые можно применить к любой группе геномов в различных попытках расхождения в списках новых генов, которые были созданы (см. Ниже).
Даже если эволюционное происхождение конкретной последовательности было строго установлено с помощью вычислений, важно отметить отсутствие единого мнения о том, что представляет собой настоящий ген de novo. событие рождения. Одна из причин этого - отсутствие согласия относительно того, должна ли вся новая генная последовательность быть негенной по происхождению. Что касается генов de novo, кодирующих белок, было предложено разделить гены de novo на подтипы, соответствующие доле рассматриваемой ORF, которая была получена из ранее некодирующей последовательности. Более того, чтобы произошло рождение гена de novo, рассматриваемая последовательность должна не просто появиться de novo, но фактически должна быть геном. Соответственно, открытие рождения гена de novo также привело к сомнению в том, что составляет ген: одни модели устанавливают строгую дихотомию между генными и негенными последовательностями, а другие предлагают более гибкий континуум (см. Ниже). Все определения генов связаны с понятием функции, так как обычно считается, что настоящий ген должен кодировать функциональный продукт, будь то РНК или белок. Однако существуют разные взгляды на то, что составляет функцию, отчасти в зависимости от того, оценивается ли данная последовательность с использованием генетических, биохимических или эволюционных подходов.
Принято считать, что настоящий ген de novo экспрессируется в по крайней мере, некоторый контекст, позволяющий действовать отбору, и многие исследования используют свидетельства экспрессии в качестве критерия включения при определении генов de novo. Экспрессия последовательностей на уровне мРНК может быть подтверждена индивидуально с помощью традиционных методов, таких как количественная ПЦР, или глобально с помощью более современных методов, таких как секвенирование РНК (RNA-seq). Аналогичным образом, экспрессия на уровне белка может быть определена с высокой достоверностью для отдельных белков с использованием таких методов, как масс-спектрометрия или вестерн-блоттинг, в то время как профилирование рибосом (Ribo-seq) предоставляет глобальный обзор переводов в данной выборке. В идеале, для подтверждения того, что рассматриваемый ген возник de novo, также должно быть продемонстрировано отсутствие экспрессии синтенической области у видов вне группы.
Подтверждение экспрессии гена - это только один из подходов к выводу о функции. Некоторые считают золотым стандартом генетические подходы, в которых стремятся обнаружить определенный фенотип или изменение приспособленности при нарушении определенной последовательности; однако для крупномасштабного анализа полных геномов получение таких доказательств часто невозможно. Другие экспериментальные подходы, включая скрининг на белок-белковые и / или генетические взаимодействия, также могут быть использованы для подтверждения биологического эффекта для конкретной ORF de novo. По мере того, как больше узнается о конкретном локусе, стандартные методы молекулярной биологии могут применяться для анализа его специфической клеточной роли.
В качестве альтернативы можно использовать эволюционные подходы для вывода о существовании молекулярной функции из полученных с помощью вычислений признаков выбора. В случае TRG одним из общих признаков отбора является отношение несинонимичных замен к синонимичным (отношение dN / dS ), рассчитанное для разных видов одного и того же таксона. Нейтральное ожидание для этого отношения - 1; большинство генов, кодирующих белок, имеют отношение ниже 1, что указывает на селективное ограничение, хотя ген при сильном направленном отборе может иметьотношение выше 1. Соотношение ниже 1, таким, считается доказательством отношения против потерь функции. Аналогичным образом, в случае видоспецифичных генов, данные полиморфизма одна из программ расчета отношений pN / pS для различных штаммов или популяций основных видов. Учитывая, что молодые, видоспецифичные гены de novo по определению не обладают глубокой консервацией, обнаружение статистически значимых отклонений от 1 может затруднено без нереально большого количества секвенированных штаммов / популяций. Пример этого можно увидеть у Mus musculus, где три очень молодых de novo гена лишены признаков отбора, несмотря на хорошо указанные физиологические роли. По этой причине pN / pS часто применяются к группам генов-кандидатов, что позволяет исследователям сделать вывод, что по крайней мере некоторые из них являются эволюционно консервативными, не имея возможности указать какие именно. Вместо этого использовались признаки отбора, такие как степень дивергенции нуклеотидов в синтенных областях, сохранение границ ORF или для генов, кодирующих факторов оценки, кодирования на основе частот нуклеотидных гексамеров.
Несмотря на это, и другие проблемы в системе идентификации событий рождения гена de novo, данное явление не только возможно, но имеет место в каждой линии, систематически изученной до сих пор.
Оценки частоты рождения гена de novo и количества генов de novo в различных линиях широко варьируются и сильно зависят от методологии. Исследования могут идентифицировать гены de novo только методы филостратиграфии / BLAST или могут использовать комбинацию вычислительных методов (см. Выше), а также могут оценивать или не оценивать экспериментальные доказательства экспрессии и / или биологической роли. Кроме того, анализ в масштабе генома может учитывать все другие ORF в геноме вместо этого может ограничивать свой анализ ранее аннотированными генами.
Линия Д. melanogaster показывает эти различные подходы. Раннее исследование с использованием комбинации поисков BLAST, выполненных на последовательностях кДНК, наряду с ручным поиском и информацией о синтении, 72 гена, специфичных для D. melanogaster, и 59 новых генов, специфичных для трех из четырех видов в комплексе видов D. melanogaster. В этом отчете было обнаружено, что только 2/72 (~ 2,8%) новых генов, специфичных для D. melanogaster, и 7/59 (~ 11,9%) новых генов, специфичных для комплекса видов, были получены de novo., ашая остався часть возникла в результате дупликации / ретропозиция. Аналогичным образом, анализ 195 молодых популяций (<35 million years old) D. melanogaster genes identified from syntenic alignments found that only 16 had arisen de novo. In contrast, an analysis focused on transcriptomic data from the testes of six D. melanogaster strains identified 106 fixed and 142 segregating de novo genes. For many of these, ancestral ORFs were identified but were not expressed. Highlighting the differences between inter- and intra-species comparisons, a study in natural Saccharomyces paradoxus показал, что количество полипептидов de novo, идентифицированных с учетом внутривидового разнообразия, увеличилось более чем вдвое, у приматов одно раннее исследование выявило 270 орфанных генов (уникальных для человека)., шимпанзе и макаки), 15 из которых предполагалось, произошли de novo, в то время как в более позднем отчете было идентифицировано 60 de novo генов только у людей, которые подтверждаются транскрипционными и протеомными данными. Исследования на других линиях / организмах также пришли к другим выводам относительно количества новых генов, присутствующих в каждом организме, а также конкретных наборов идентифицированных генов. Образец этих крупномасштабных исследований, описан в таблице ниже.
Повторный анализ трех таких исследований на мышах, которые выявили от 69 до 773 генов-кандидатов de novo, показали, что различные оценки включали многие гены, которые на самом деле являлись генами de novo. Многие кандидаты были исключены на основании того, что не аннотируется в основных базах данных. Ключи генам был применен консервативный подход, который исключал кандидатов с паралогами, которые отдаленно родственными гомологами или консервативными доменами, или которые не имеют информации о синтенической системе у негрызунов. Этот подход подтвердил ~ 40% новых генов-кандидатов, что привело к верхней оценке только 11,6 генов, сформированных (и сохраненных) за миллион лет, что примерно в 5-10 раз медленнее, чем оценка новых генов, образованных в результате дупликации.. Примечательно, что даже после применения этого строгого конвейера 152 подтвержденных de novo гена, которые остались, все еще значительная часть генома мыши, вероятно, возникшего de novo. В целом, однако, остается спорным вопрос о том, выделяется ли дупликация и дивергенция или рождение гена de novo доминирующий механизм возникновения новых генов, отчасти из-за того, что гены de novo как возникло, так и могут теряться чаще, чем другие молодые гены (см. ниже).
Важно различать частоту рождения гена de novo и количество генов de novo в данной линии. Если рождение гена de novo происходит часто, можно ожидать, что содержание генов в геномах со временем будет увеличиваться; однако содержание генов в геномах обычно относительно стабильно. Это означает, что частый процесс гибели гена должен уравновешивать рождение гена de novo, и действительно, гены de novo отличаются быстрым оборотом по сравнению с установленными генами. В подтверждении этого предположения, недавно появившиеся дрозофилы с гораздо большей вероятностью будут потери, в первую очередь из-за псевдогенизации, причем самые молодые сироты теряются с наибольшей скоростью; Это несмотря на то, что было показано, что некоторые гены-сироты Drosophila быстро становятся важными. Аналогичная тенденция частой потери среди молодых семейств генов наблюдалась у нематод рода Pristionchus. Точно так же анализ пяти транскриптомов показал, что большинство ORF у мышей были либо очень старыми, либо видоспецифичными, что подразумевает частое рождение и смерть транскриптов de novo. В популяциях диких S. paradoxus открытые рамки считывания de novo появляются и исчезают совой скоростью. Тем не менее, остается положительная корреляция между эволюционным видоспецифичными геновами в геноме и его последним расстоянием от его последнего предка. Помимо и смерти генов de novo на уровне ORF, мутационные и другие процессы также подвергают геномы постоянному транскрипционному обороту ». Одно исследование на мышах показало, что хотя все области предкового генома были транскрибированы по крайней мере у одного потомка, часть генома при активной транскрипции в данном штамме или подвиде подвержена быстрым изменениям. Транскрипционный оборот генов некодирующей РНК особенно быстрых по сравнению с оборотом кодирующих генов.
Недавно появившиеся гены de novo отличаются от генов по ряду признаков. У широкого круга видов деятельности и / или таксономически ограниченные гены или открытые рамки считываются, как установленные гены, эволюционируют быстрее и менее экспрессируются. Показывает, что эти тенденции возникают в результате систематической ошибки определения гомологии (см. Раздел «Геномная филостратиграфия» выше), повторный анализ нескольких исследований, которые представили эту систематическую ошибку за счет удаления генов, возраст является более сложным для определения. что качественные выводы, сделанные в этих исследованиях. исследования не пострадали. Кроме того, тенденция к генетической изменчивости не имеет большего количества гидрофобных генов и имеет большее количество кластеров рядом с другом вдоль первичной статистики.
Также было обнаружено, что экспрессия молодых генов более специфична для ткани или состояния, чем экспрессия генов. В частности, относительно высокая экспрессия генов de novo наблюдалась в мужских репродуктивных тканях у дрозофилы, мышей и людей (см. Ниже), а у людей - в коре головного мозга или головном мозге в целом. У животных с адаптивной иммунной системой более высокая экспрессия в головном мозге и семенниках может, по крайней мере частично, быть функцией иммунной природы этих тканей. Анализ на мышах определяет специфическую экспрессию межгенных транскриптов в тимусе и селезенке (в дополнение к головному мозгу и семенникам), и было высказано предположение, что у позвоночных транскриптов de novo сначала экспрессироваться в этих тканях, прежде чем они могут быть экспрессированы в тканях. подлежат наблюдению со стороны иммунных клеток. Старые гены обладают большей регуляцией транскрипционных факторов, что свидетельствует об их интеграции в более молекулярные сети. Точно так же вероятность физических веществ, а также вероятность и сила генетических взаимодействий коррелируют с возрастом ORF, определяемым филостратиграфией.
Особенности генов de novo могут зависеть от исследуемого вида или происхождения. Это, по-видимому, частично является результатом того факта, что геномы различаются по содержанию GC, и молодые гены имеют больше сходства с негенными последовательностями из генома, в котором они возникли, чем установленные гены. Такие характеристики, как процент трансмембранных остатков и относительная частота предсказанных вторичных структурных признаков, демонстрируют сильную зависимость от GC в генах-сиротах, тогда как в более древних генах эти особенности слабо зависят от содержания GC.
Взаимосвязь между возрастом гена и степенью предсказанного внутреннего структурного нарушения (ISD) в кодируемых белках является предметом значительных дискуссий. Утверждается, что ISD также является зависимым от клонов признаком, что подтверждено тем фактом, что у организмов с относительно высоким уровнем содержания GC, от D. melanogaster до паразита Leishmania major, молодые гены имеют высокий ISD, в то время как Такие как почкующиеся дрожжи в геноме с низким уровнем GC показывают, что эти гены имеют низкий ISD. Однако исследование, в котором были обнаружены новые гены с сомнительными доказательствами функциональности, обнаруженными в процессе отбора для удержания генов, обнаружено, что оставшиеся предыдущие гены дрожжей имеют высокий ISD, предполагая, что дрожжевой результат может быть связан с проверением набора. молодые генов с ORF, которые не соответствуют этому определению, и, следовательно, с большей вероятностью будут иметь свойства, отражающие содержание GC и другие негенные особенности генома. Помимо самых молодых сирот, это исследование показало, что ISD имеет тенденцию к уменьшению с возрастом, и это в первую очередь связано с аминокислотным составом, а не с содержанием GC как таковым. В более коротких временных масштабах акцент на новых, которые имеют наибольшую валидацию, предполагает, что более старые гены более неупорядочены в Lachancea, менее порядочные у Saccharomyces.
Исследование генов de novo у A. thaliana появилось, что они оба гиперметилированы и обычно лишены модификаций гистона. Уровни метилирования новых генов были промежуточными между установленными генами и межгенными регионами, либо с моделью протогена, либо с загрязнением негенами (см. Ниже). Паттерны метилирования этих генов de novo стабильно наследуются, уровни метилирования были самыми высокими и наиболее сходными с установленными генами в генах de novo с подтвержденной способностью кодирования белков. У патогенного гриба Magnaporthe oryzae менее консервативные гены тенденций иметь паттерны метилирования, связанные с низкими уровнями транскрипции. Исследование на дрожжах также показало, что гены de novo обогащаются в горячих точках рекомбинации, которые, как правило, представляют собой участки, свободные от нуклеосом.
В Pristionchus pacificus орфанные гены с подтвержденной экспрессией демонстрируют состояния хроматина, которые отличаются от таковых аналогичным образом экспрессируемых установленных генов. Сайты старта орфанных генов имеют эпигенетические сигнатуры, характерные для энхансеров, в отличие от консервативных генов, которые демонстрируют классические промоторы. Многие невыраженные орфанные гены украшены репрессивными модификациями гистонов, в то время как отсутствие таких модификаций способствует транскрипции экспрессируемой подгруппы сирот, подтверждая идею о том, что открытый хроматин способствует образованию новых генов.
Описано несколько теоретических моделей и возможных механизмов рождения гена de novo. Эти модели, как правило, не исключают друг друга, и возможно, что множественные механизмы могут дать начало генам de novo.
Чтобы произошло рождение гена, кодирующего белок de novo, негенная последовательность должна быть как транскрибирована, так и приобретать ORF перед тем, как транслироваться. Теоретически эти события могут происходить в любом порядке, и существуют доказательства, подтверждающие модели «сначала ORF» и «сначала транскрипция». Анализ генов de novo, которые расщепляются у D. melanogaster в отношении их экспрессии, показал, что транскрибируемые последовательности обладают аналогичным кодирующим потенциалом с ортологическими последовательностями из линий, не имеющих доказательств транскрипции, что подтверждает мнение о том, что существует, по крайней мере, много ORF. перед выражением. Ген гликопротеина антифриза AFGP, который появился de novo у арктических тресковых рыб, представляет собой более конкретный пример, в котором было показано, что появление de novo ORF предшествует появлению промоторной области. Кроме того, предположительно негенных ORF, достаточно длинных для кодирования функциональных пептидов, много в геномах эукариот, и ожидается, что они будут встречаться с высокой частотой случайно. В то же время транскрипция эукариотических геномов намного шире, чем считалось ранее, и также существуют задокументированные примеры геномных областей, которые были транскрибированы до появления ORF, которая стала геном de novo. Доля новых генов, кодирующих белок, неизвестна, но появление «сначала транскрипции» привело к предположению, что гены новых генов могут сначала существовать как промежуточные звенья гена РНК. Случай бифункциональных РНК, которые транслируются и функционируют как гены РНК, показывает, что такой механизм правдоподобен.
Эти два события могут происходить одновременно, когда хромосомная перестройка является событием, которое ускоряет рождение гена.
Раннее тематическое исследование рождения гена de novo, которое выявило пять генов de novo у D. melanogaster, отметило преимущественную экспрессию этих генов в семенниках и нескольких дополнительных генов. novo гены были идентифицированы с использованием транскриптомных данных, полученных из семенников и дополнительных желез самцов D. yakuba и D. erecta (см. выше). Это соответствовало быстрой эволюции генов, которая наблюдалась в ряде клонов, предполагаемая, что половой отбор может играть ключевую роль в адаптивной и рождении гена de novo. Последующий крупномасштабный анализ шести штаммов D. melanogaster выявил 248 новых генов, экспрессируемых семенниками, из ~ 57% не были зафиксированы. Было высказано предположение, что большое количество генов de novo с мужской специфической экспрессией, идентифицированных у Drosophila, вероятно, связано с тем, что такие гены преимущественно сохраняются по сравнению с другими генами de novo по причинам, которые не совсем ясны. Интересно, что два предполагаемых гена de novo у дрозофилы (Годдард и Сатурн), как было показано, необходимы для нормальной мужской фертильности.
У людей исследование, выявленное 60 человеческих генов de novo, показало, что их средняя экспрессия как измерено с помощью RNA-seq, было самым высоким в семенниках. Другое исследование, посвященное более общим генам, специфичным для млекопитающих, также обнаружено повышенное экспрессию в семенниках. Транскрипция в тесте на животных считается особенно беспорядочным, частично из-за повышенного экспрессии транскрипционного аппарата и открытого хроматина. Считается, что наряду с иммунопривированной семенников (см. Выше) эта беспорядочная транскрипция идеальные условия для экспрессии негенных последовательностей, необходимые для рождения гена de novo. Экспрессия, специфичная для семенников, по-видимому, является общей чертой всех новых генов, поскольку анализ видов дрозофил и позвоночных показал, что молодые гены демонстрируют предвзятую экспрессию в семенниках независимо от механизма их возникновения.
С расширением и широким использованием таких технологий, как RNA-seq и Ribo-seq, теперь известно, что геномы эукариот широко транскрибируются и транслируются. Многие ORF либо не аннотированы, либо аннотированы как длинные некодирующие РНК (lncRNAs), транслируются на каком-то уровне, по крайней мере при некоторых условиях или в конкретной ткани. Эти события трансляции, хотя и нечастые, подвергаются селекции негенную последовательность. Эта повсеместная экспрессия на основе нескольких моделей, описывающих рождение гена de novo.
Большинство негенных ORF, которые транслируются, по-видимому, эволюционируют нейтрально. Обе модели преадаптации и протогена предсказывают, однако, что экспрессия негенных ORF может обеспечить иногда адаптивное преимущество для клетки. факторов транскрипции, участвующих в регуляции стрессового ответа, адаптивный потенциал протогенов. Кроме того, известно, что новые функциональные белки могут быть экспериментально получены из случайных аминокислотных последовательностей. Случайные последовательности обычно хорошо переносятся in vivo; Многие из них легко образуют вторичные структуры. Повсеместный характер трансляции предполагает, что новые протогены часто появляются, обычно возвращаясь в негенное состояние. В популяциях диких S. paradoxus обнаруживаются некоторые ORF с преобразительными геноподобными особенностями среди пула транслируемых межгенных полипептидов. Неясно, особенно ли такие такие ORF.
Было высказано предположение, что эпигенетический ландшафт генов de novo на ранних стадиях может быть особенно изменчивым между популяциями, приводит к различным уровням экспрессии генов и таким образом, позволяет молодым генам исследовать «экспрессию» пейзаж. "Ген QQS у A. thaliana является одним из примеров этого феномена; его экспрессия негативно регулируется метилированием ДНК, которое является наследуемым среди нескольких поколений, широко используемым своим уровнем как среди естественных образцов, так и различных популяций. степени отвечает за пермиссивную транскрипционную среду в семенниках, в частности, за счет включения нуклеосомы неканонических вариантов гистонов, которые заменяются гистоноподобными протаминами во время сперматогенеза.
В преадаптационной модели рождения гена de novo используется математическое моделирование, чтобы показать, что, когда, когда следует, обычно которые скрыты, подвергаются слабому или экранированному отбору, результирующий пул «загадочных» последовательностей (т.е. протогенов) может быть очищенным от «самоочевидно вредных» вариантов, таких как те, которые склонны приводить к агрегации белков, таким образом, обогащаться потенциальными адаптаци ями по сравнению с полностью невыраженным и неочищенным набором последовательностей. Это выявление и удаление загадочных вредных негенных последовательностей является побочным продуктом всепроникающей транскрипции и трансляции межгенных последовательностей, как ожидается, будет рождению функциональных генов, кодирующих белок de novo. Это с тем, что при устранении наиболее вредных вариантов, что остается в процессе исключения, с большей вероятностью будет адаптивным, чем ожидалось от случайных последовательностей.
Математические модели преадаптации предполагают, что использование возможностей приспособления является бимодальным, с новыми последовательностями мутаций, имеющими тенденцию что-тоать или исправить, но редко между ними. Предусматривает, что эти накапливания обеспечивают локальные загадочные решения, обеспечивающие один высокий уровень, либо глобальное решение с низким уровнем ошибок. Считается, что рождение гена devo предпочтительнее в популяциях, которые развивают локальные, поскольку относительно высокий уровень ошибок к пулу загадочных вариаций, которые адаптированы посредством очистки от отрицательных последовательностей. Локальные решения более вероятных в популяциях с высоким эффективным размером популяции.
Эта модель протогена согласуется с моделью преадаптации о важности повсеместной экспрессии и относится к набору широко экспрессируемых последовательностей, которые не соответствуют всем как «протогены». Отличие в том, что он обеспечивает более безопасный процесс отбора от негенного состояния, отвергая бинарную классификацию, при этом ожидается, что протогены будут проявлять признаки, промежуточные между генами и негенными.
Используя эволюционное определение функций (то есть, что ген по определению находится под очищающим отбором против потерь), модель преадаптации предполагает, что «рождение гена - это внезапный переход к функциональности» », Которая возникает, как только ORF приобретает чистый положительный эффект. Ожидается, что для того, чтобы не быть вредными, новорожденные гены будут демонстрировать преувеличенные версии генных проблем, связанным сением. Это контрастирует с моделью протогена, которая ожидает, что гены новорожденных имеют характеристики, промежуточные между старыми генами и негенами.
Некоторые особенности ORF коррелируют с возрастом ORF, как определено филостратиграфическим анализом (см. Выше) с молодыми ORF, имеющими промежуточные свойства между старыми ORF и негенными; это было воспринято как доказательство в пользу модели протогена, в которой состояние протогена является континуумом. Это свидетельство подверглось критике, потому что те же очевидные тенденции ожидаются и в модели. Согласно этой модели, когда каждая возрастная группа содержит различное соотношение генов и не генов, парадокс Симпсона может генерировать корреляции в неправильном направлении.
Более конкретно, в поддержку предварительной адаптации Модель, анализ ISD у мышей и дрожжей показывает, что гены имеют более высокий ISD, чем старые гены, в то время как случайные негенные примеры, как правило, самые низкие уровни ISD. Хотя наблюдаемая тенденция может частично быть результатом подмножества молодых генов, полученные путем наложения на более высокий ISD в молодых генах также наблюдаются среди перекрывающихся пар вирусных генов. Достижение консенсуса по значениям ISD самых молодых генов затруднено из-за различных стандартов аннотации, а также из-за разногласий по поводу того, обеспечивает ли гены бинарную или непрерывную категорию. ISD меняется на противоположную, когда протогены с меньшим изменяющимся показателем для выбранной функции исключаются из которых наблюдаются континуум, наклон тенденции. Однако остается неопределенность относительно того, сохраняются ли наблюдаемые тенденции стабильно в более короткие сроки. Что касается других предсказанных структурных функций, таких как содержание β-цепи и склонность к агрегации, пептиды, кодируемые протогенами, негенным последовательностям и категорически отличаются от канонических генов.
Модель «потенциальный механизм рождения гена de novo», кодирующих белок. В этом создают новые сценарии ORF, кодирующие, расширяются на своих концах, особенно на их 3 ’концах, что создает к созданию новых N- и C-концевых доменов. Новые С-концевые домены могут сначала эволюционировать при слабом отборе посредством случайной экспрессии посредством сквозной трансляции, как в модели преадаптации, только позже стандартных конститутивно экспрессируемых посредством мутации, которая нарушает стоп-кодон. Гены, испытывающие быстрое считывание трансляции, обычно имеют неупорядоченные С-концы. Более того, полезены часто близки к повторяющимся последовательностям, кодирующим неупорядоченные домены. Эти новые неупорядоченные устройства неупорядоченного использования неупорядочены. Последовательности, кодирующие эти новые домены, могут отделяться от их родительской ORF, приводя или способствуя созданию гена de novo. Интересно, что анализ 32 геномов насекомых показали, что новые домены имеют тенденцию развиваться довольно нейтрально, только несколько сайтов находятся под положительным отбором, в то время как их белки-хозяева остаются под очищенным отбором, что позволяет предположить, что новые функциональные домены появляются постепенно. и несколько стохастично.
Помимо значения для области эволюционной биологии, рождение гена de novo имеет значение для здоровья человека. Было высказано предположение, что новые гены, в том числе гены de novo, могут огромную роль в видоспецифичных признаках; однако многие видоспецифичные гены лишены функциональной аннотации. Тем не менее, есть данные, позволяющие предположить, что специфические для гены de novo участвуют в таких болезненных процессах, как рак. NYCM, ген de novo, уникальный для человека и шимпанзе, регулирует патогенез нейробластом на моделях мышей, специфичный для приматов PART1, ген lncRNA, был идентифицирован как опухолевый супрессор и онкоген в различных контекстах. Несколько других генов de novo, специфичных для человека или приматов, включая PBOV1, GR6, MYEOV, ELFN1-AS1 и CLLU1, также связаны с раком. Некоторые даже предлагать специфически экспрессируемые в опухолях новые эволюционные гены как отдельные классические элементы, отмеченные, что многие такие гены находятся под определенным отбором и неофункционализированы в контексте опухолей.
Специфическая экспрессия Многие гены de novo в человеческом мозге также поднимают интригующую возможность того, что гены de novo влияют на когнитивные особенности человека. Одним из таких примеров является FLJ33706, который был идентифицирован в GWAS и анализ сцепления для никотиновой зависимости и демонстрирует повышенную экспрессию в мозге с болезнью Альцгеймера. Вообще говоря, экспрессия молодых генов, специфичных для приматов, в мозге эмбриона человека выше по сравнению с экспрессией аналогичных генов в мозге мыши. Большинство этих молодых генов, некоторые из которых возникли de novo, выражаются в неокортексе, который, как считается, отвечает за многие аспекты человеческого познания. Многие из этих молодых генов демонстрируют признаки положительного отбора, они участвуют в различных молекулярных процессах, но обогащают факторы транскрипции.
Помимо своей роли в процессах рака, de novo возникли у человека, гены участвуют в поддержании плюрипотентности и иммунной функции. Преимущественная экспрессия генов de novo в семенниках (см. Выше) также указывает на их роль в репродукции. Учитывая, что функция многих новых человеческих генов остается не охарактеризованной, кажется вероятным, что оценка их вклада в здоровье и развитие человека будет продолжать расти.
| Организм / происхождение | Метод (ы) определения гомологии | Доказательства экспрессии? | Доказательства выбора? | Доказательства физиологической роли? | # Orphan / De Novo Genes | Примечания | Ref. |
|---|---|---|---|---|---|---|---|
| Членистоногие | BLASTP для всех 30 видов друг против друга, TBLASTN только для Formicidae, поиск по синтению неаннотированных ортологов только у Formicidae | EST, RNA-seq; ОТ-ПЦР на выбранных кандидатах | 37 ортологов, ограниченных Formicidae, появляются отношения при положительном отборе (модели M1a-M2a и M7-M8 с использованием тестов правдоподобия); как группа ортологи, ограниченные Formicidae, имеют значительно более высокий коэффициент K a/Ks, чем ортологи без ограничений | Прогнозирование сигнальных пептидов и субклеточная локализация для подмножества сирот | ~ 65000 сиротских генов через 30 видов | Обилие генов-сирот в зависимости от времени, прошедшего с момента появления от общего предка;>40% сирот в результате межгенных совпадений, возможные на возможное происхождение de novo | |
| Arabidopsis thaliana | BLASTP против 62 видов, PSI-BLAST против базы данных неизбыточных белков NCBI, TBLASTN против базы данных уникальных транскриптов, собранных PlantGDB ; искали синтеническую область двух близкородственных видов | Транскриптомные и трансатомические данные из множественных источников | Частоты аллелей de novo генов коррелировали с их уровнями метилирования ДНК | Нет | 782 гена de novo | Также оценивали метилирование ДНК и модификации гистонов | |
| Bombyx mori | BLASTP против четырех чешуекрылых, TBLASTN против последовательностей EST чешуекрылых, BLASTP против NCBI базы данных неизбыточных белков | Микроматрица, ОТ-ПЦР | Нет | РНКи на пяти de novo генах не давали видимых фенотипов | 738 орфанных генов | Пять сирот, идентифицированных как de novo гены | |
| Brassicaceae | BLASTP против базы данных неизбыточных белков NCBI, TBLASTN против базы данных нуклеотидов NCBI, TBLASTN против базы данных NCBI EST, PSI-BLAST против базы данных неизбыточных белков NCBI, InterProScan | Микроматрица | Нет | TRG, обогащенные для изменений экспр ессии в ответ на абиотические стрессы по сравнению с другими генами | 1761 ядерных ТРГ; 28 митохондриальных TRG | ~ 2% TRG считаются генами de novo | |
| Drosophila melanogaster | BLASTN запрашиваемых кДНК против геномов D. melanogaster, D. simulans и D. yakuba; также выполнила проверку синтенической области сестринских видов | кДНК / теги экспрессируемой последовательности (ESTs) | Ka/Ks. Рассчитанные соотношения между сохраненными новыми генами и их родительскими генами превышают 1, что указывает на то, что большинство новых генов функционально ограничены | Список включает несколько генов с охарактеризованными молекулярными ролями | 72 орфанных гена; 2 гена de novo | Доминантный механизм дупликации генов для новых генов; 7/59 сирот, специфичных к комплексу видов D. melanogaster, идентифицированных как de novo | |
| Drosophila melanogaster | Наличие или отсутствие ортологов у других видов дрозофил, определяемое синтенией на основе выравнивания генома UCSC и синтении на основе белка FlyBase ; TBLASTN против подгруппы Drosophila | Непрямая (RNAi) | Самые молодые существенные гены демонстрируют признаки положительного отбора (α = 0,25 как группа) | Нокдаун с конститутивной РНКи летальна для 59 TRG | 195 «молодых» (>35мес.) ТРГ; 16 генов de novo | Доминантный механизм дупликации генов для новых генов | |
| Drosophila melanogaster | РНК-seq у D. melanogaster и близких родственников; синтенические выравнивания с D. simulans и D. yakuba; BLASTP против базы данных неизбыточных белков NCBI | RNA-seq | Нуклеотидное разнообразие ниже у неэкспрессирующих родственников; Статистика Хадсона-Крейтмана-Агуаде ниже в фиксированных генах de novo, чем в межгенных областях | Структурные особенности генов de novo (например, обогащение длинных ORF), указывающие на функцию | 106 фиксированных и 142 сегрегационных гена de novo | , специфически экспрессируемых в семенниках | |
| Homo sapiens | BLASTP против других приматов; BLAT против геномов шимпанзе и орангутанга, ручная проверка синтенных областей у шимпанзе и орангутанга | последовательность РНК | Скорость замещения дает некоторые доказательства слабого отбора; Зафиксированы 59/60 генов de novo | Нет | 60 генов de novo | Выявлены активирующие мутации; самая высокая экспрессия, наблюдаемая в головном мозге и семенниках | |
| Homo sapiens | BLASTP против шимпанзе, BLAT и поиск синтенической области у шимпанзе, ручная проверка синтенической области у шимпанзе и макака | EST / cDNA | Нет доказательств избирательного ограничения, наблюдаемого по расхождению нуклеотидов | Один из идентифицированных генов играет известную роль в лейкемии | 3 гена de novo | Предполагается, что человек геном содержит ~ 18 специфичных для человека de novo генов | |
| Lachancea и Saccharomyces | BLASTP всех очаговых видов против друг друга, BLASTP против базы данных неизбыточных белков NCBI, PSI-BLAST против базы данных неизбыточных белков NCBI, HMM Profile- Профиль семей TRG друг против друга; затем семьи объединились и провели поиск по четырем базам данных профилей | масс-спектрометрия (MS) | Ka/Ksсоотношения между Saccharomyces указывают на то, что кандидаты находятся в условиях слабого отбора, который увеличивается с возрастом гена; у видов Lachancea с множественными штаммами отношения pN / pS ниже для кандидатов de novo, чем для «ложных TRG» | Нет | 288 кандидатов de novo TRGs у Saccharomyces, 415 у Lachancea | свидетельство MS о трансляции 25 кандидатов | |
| Mus musculus и Rattus norvegicus | BLASTP крысы и мыши друг против друга, BLASTP против базы данных сравнения Ensembl; найденные синтенические области у крыс и мышей | База данных UniGene | Подмножество генов демонстрирует низкое нуклеотидное разнообразие и высокую консервативность ORF у 17 штаммов | Два гена мыши вызывают заболеваемость при нокауте | 69 генов de novo у мышей и 6 генов de novo у крыс | Активирующие мутации, идентифицированные для 9 генов мыши | |
| Mus musculus | BLASTP против базы данных неизбыточных белков NCBI | Микроматрица | Нет | Нет | 781 сиротский ген | Возрастные особенности генов, совместимые с появлением de novo многих сирот | |
| Oryza | BLAT-белок-белок и нуклеотид-нуклеотид против восьми видов Oryza и двух видов внешней группы; искали синтенные области этих видов на предмет кодирования потенциала | РНК-seq (все TRG de novo); Профилирование рибосом и нацеленная MS (некоторые de novo TRG) | 22 кандидата de novo появляются при отрицательном выборе и шесть при положительном выборе, как измерено с помощью K a/Ksrate | Выражение de novo TRGs является тканеспецифичным | 175 TRG de novo | ~ 57% генов de novo имеют доказательства трансляции; транскрипция предшествует кодирующему потенциалу в большинстве случаев | |
| Приматы | BLASTP против 15 эукариот, BLASTN против генома человека, анализ синтенных областей | ESTs | Ka/Ksсоотношения для TRG ниже единицы, но выше установленных гены; оценки кодирования, соответствующие транслированным белкам | Некоторые гены имеют хорошо охарактеризованные клеточные роли | 270 TRG | ~ 5,5% TRG, по оценкам, возникли de novo | |
| Pristionchus pacificus | BLASTP и tBLASTN, синтенический анализ | RNA-Seq | 2 случая полного происхождения гена de novo | 27 других сирот с высокой степенью достоверности, чьи методы происхождения включали артефакты аннотаций, химерное происхождение, использование альтернативной рамки считывания и расщепление гена с последующим усилением экзонов de novo | |||
| Rodentia | BLASTP против базы данных неизбыточных белков NCBI | Нет | Мышиные гены имеют 50% идентичность с ортологом крысы | Нет | 84 TRG | Видоспецифичные гены, исключенные из анализа; результаты устойчивы к скорости эволюции | |
| Saccharomyces cerevisiae | BLASTP и PSI-BLAST против 18 видов грибов, HMMER и HHpred против нескольких баз данных, TBLASTN против трех близких родственников | Нет | Нет | Большинство сирот имеют характерные эффекты приспособляемости | 188 сиротских генов | Возраст генов определяется на уровне отдельных остатков | |
| Saccharomyces cerevisiae | BLASTP, TBLASTX и TBLASTN против 14 других видов дрожжей, BLASTP против базы данных неизбыточных белков NCBI | Профилирование рибосом | Все 25 генов de novo, 115 протогенов при очищающей селекции (pN / pS < 1) | Нет | 25 генов de novo; 1891 «протогены» | рождение гена de novo чаще встречается, чем новые гены от дупликации; протогены уникальны для Saccharomyces (Sensu stricto ) дрожжи | |
| Saccharomyces cerevisiae | BLASTN, TBLASTX, против nt / nr, ручная проверка синтенного выравнивания | транскрипт ов, предположительно некодирование, ручная проверка следов профилирования рибосом | Нет | Нет | 1 ген-кандидат de novo, 217 транскриптов, связанных с рибосомами | Кандидат de novo ген полиморфен. Данные рибосомного профилирования такие же, как в | |
| Saccharomyces sensu strictu | BLASTP против базы данных неизбыточных белков NCBI, TBLASTN против десяти видов внешней группы; BLASTP и phmmer против 20 видов дрожжей, повторно аннотированные с использованием синтенных выравниваний | Секвенирование изоформ транскрипта (TIF-seq), профилирование рибосом | Большинство генов слабо ограничены, но являются подмножеством при сильном отборе, согласно индексу нейтральности, Направление отбора, K a/Ksи тесты Макдональда-Крейтмана | Субклеточная локализация продемонстрирована для пяти генов | ~ 13000 генов de novo | >65% генов de novo изоформы древних генов;>97% из набора данных TIF-seq |
Примечание: для целей этой таблицы гены определяются как гены-сироты (если они видоспецифичны) или TRG (если они ограничены близкородственной группой видов), если механизм происхождения не исследовались, и как гены de novo, когда предполагалось происхождение de novo, независимо от метода вывода. Обозначение генов de novo в качестве «кандидатов» или «протогенов» отражает язык, используемый авторами соответствующих исследований.
![]() Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 () (отчеты рецензента ): Стивен Бранден Ван Осс; Анне-Руксандра Карвунис (2019), "De novo gene Birth", PLOS Genetics, 15 (5): e1008160, doi : 10.1371 / JOURNAL.PGEN.1008160, PMC 6542195, PMID 31120894, Wikidata Q86320144
Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 () (отчеты рецензента ): Стивен Бранден Ван Осс; Анне-Руксандра Карвунис (2019), "De novo gene Birth", PLOS Genetics, 15 (5): e1008160, doi : 10.1371 / JOURNAL.PGEN.1008160, PMC 6542195, PMID 31120894, Wikidata Q86320144