| цистатионин гамма-лиаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
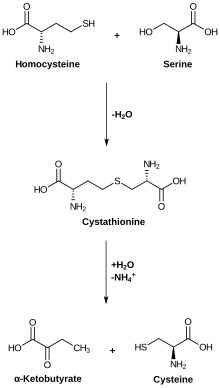 Метаболизм цистеина. Цистатионаза катализирует нижнюю реакцию. Метаболизм цистеина. Цистатионаза катализирует нижнюю реакцию. | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 4.4.1.1 | ||||||||
| Номер CAS | 9012-96-8 | ||||||||
| Базы данных | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
| цистатионаза (цистатионин гамма-лиаза) | |
|---|---|
 | |
| Идентификаторы | |
| Символ | CTH |
| ген NCBI | 1491 |
| HGNC | 2501 |
| OMIM | 607657 |
| RefSeq | NM_001902 |
| UniProt | P32929 |
| Другие данные | |
| Номер ЕС | 4.4.1.1 |
| Locus | Chr. 1 p31.1 |
Цистатионин гамма-лиаза (CTH или CSE ; также цистатионаза ) является фермент, который расщепляет цистатионин на цистеин, α-кетобутират и аммиак. Пиридоксальфосфат является простетической группой этого фермента.
Цистатионин гамма-лиаза также катализирует следующие реакции элиминирования:
У некоторых бактерий и млекопитающих, включая людей, этот фермент принимает участие в генерации водорода. сульфид. Сероводород - один из немногих газов, который, как недавно было обнаружено, играет роль в передаче клеточных сигналов в организме.
Цистатионаза использует пиридоксальфосфат для облегчения разрыва связи сера-гамма-углерод цистатионин, что приводит к высвобождению цистеина. После этого внешний кетимин гидролизуется, вызывая высвобождение α-кетобутирата. Остаток лизина преобразует внутренний альдимин, отделяя уходящую группу аммиака.
Аминогруппа цистатионина депротонирована и подвергается нуклеофильная атака внутреннего альдимина. Дополнительное депротонирование с помощью общего основания приводит к образованию внешнего альдимина и удалению остатка лизина. Затем основной остаток лизина способен депротонировать альфа-углерод, перемещая электронную плотность в азот пиридинового кольца. Пиридоксальфосфат необходим для стабилизации этого карбанионного промежуточного соединения; в противном случае pKa протона будет слишком высоким. Затем бета-углерод депротонируется, создавая альфа-бета-ненасыщенность и выталкивая неподеленную пару на азот альдимина. Чтобы преобразовать альдимин, эта неподеленная пара отталкивается назад, разрывая связь сера-гамма-углерод, что приводит к высвобождению цистеина.
Пиридоксаминовое производное винил глиоксилата остается после гамма устранение. Неподеленная пара из пиридинового азота подталкивает электронную плотность к гамма-углероду, который протонируется лизином. Затем лизин атакует внешний альдимин, подталкивая электронную плотность к бета-углероду, который протонируется общей кислотой. Затем имин гидролизуют с высвобождением α-кетобутирата. Депротонирование остатка лизина вызывает улет аммиака, завершая, таким образом, каталитический цикл..
Цистатионин-гамма-лиаза также проявляет активность гамма-синтазы в зависимости от присутствующих концентраций реагентов. Механизмы одинаковы, пока они не расходятся после образования производного винилглиоксилата. В механизме гамма-синтазы гамма-углерод атакуется нуклеофилом серы, что приводит к образованию новой связи сера-гамма-углерод.
 Механизм цистатионин-гамма-лиазы.
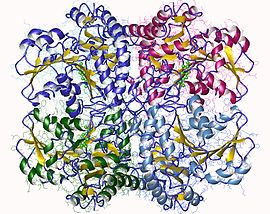
Механизм цистатионин-гамма-лиазы. Цистатионин-гамма-лиаза является членом семейства PLP-зависимых ферментов метаболизма Cys / Met. Другие члены включают цистатионин-гамма-синтазу, цистатионин-бета-лиазу и метионин-гамма-лиазу. Он также является членом более широкого семейства аспартатаминотрансферазы. Как и многие другие PLP-зависимые ферменты, цистатионин-гамма-лиаза представляет собой тетрамер с симметрией D2.
Пиридоксальфосфат связывается в активном сайте с помощью Lys.
 Активный центр ингибированной цистатионазы. Ингибитор и Tyr выделены голубым, PLP - фиолетовым, а Lys - желтым.
Активный центр ингибированной цистатионазы. Ингибитор и Tyr выделены голубым, PLP - фиолетовым, а Lys - желтым. Цистеин является ограничивающим скорость субстратом в пути синтеза глутатиона в глаза. Глутатион является антиоксидантом, который защищает кристаллины глаза от активных форм кислорода; денатурированные кристаллины могут привести к катаракте. Цистатионаза также является мишенью для активных форм кислорода. Таким образом, по мере окисления цистатионазы ее активность снижается, вызывая уменьшение цистеина и, в свою очередь, глутатиона в глазу, что приводит к снижению доступности антиоксидантов, вызывая дальнейшее снижение активности цистатионазы. Также было показано, что недостаточность цистатионазной активности способствует истощению запасов глутатиона у пациентов с раком и СПИДом.
Мутации и дефицит цистатионазы связаны с цистатионинурией. Мутации T67I и Q240E ослабляют сродство фермента к пиридоксальфосфату, кофактору, жизненно важному для ферментативной функции. Низкие уровни H 2 S также были связаны с гипертензией у мышей.
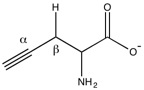 Пропаргилглицин (явно показан кислый бета-водород).
Пропаргилглицин (явно показан кислый бета-водород). Избыточные уровни H 2 S из-за повышенной активности цистатионазы связаны с эндотоксемией, острым панкреатитом, геморрагическим шоком и сахарным диабетом.
и β-цианоаланин представляют собой два необратимых ингибитора цистатионазы, используемых для лечения повышенных уровней H 2 S. Механически аминогруппа пропаргилглицина атакует альдимин с образованием внешнего альдимина. Затем β-положение алкина депротонируется с образованием аллена, который затем атакуется фенолом Tyr. Внутренний альдимин может регенерироваться, но вновь созданный виниловый эфир стерически препятствует активному центру, блокируя цистеин атаковать пиридоксальфосфат.
H2S снижает транскрипцию цистатионазы в концентрациях от 10 до 80 мкМ. Однако транскрипция увеличивается при концентрациях около 120 мкМ и полностью подавляется при концентрациях, превышающих 160 мкМ.