 | |
| Имена | |
|---|---|
| Название IUPAC Сульфид меди (I) | |
| Другие имена Сульфид меди. Халькоцит. Медный взгляд | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.040.751 |
| PubChem CID | |
| номер RTECS |
|
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | Cu2S |
| Молярная масса | 159,16 г / моль |
| Плотность | 5,6 г / см |
| Точка плавления | 1130 ° C (2070 ° F; 1400 K) |
| Растворимость в воде | Нерастворим |
| Растворимость | мало растворим в HCl ; растворим в NH4OH ; растворяется в KCN ; разлагается на HNO 3, H2SO4 |
| Опасности | |
| Температура вспышки | Невоспламеняющийся |
| NIOSH (пределы воздействия на здоровье в США): | |
| PEL (Допустимо) | TWA 1 мг / м (как Cu) |
| REL (Рекомендуется) | TWA 1 мг / м (как Cu) |
| IDLH (Непосредственная опасность) | TWA 100 мг / м (в виде Cu) |
| Родственные соединения | |
| Другие анионы | Оксид меди (I). |
| Прочие катионы | Сульфид никеля (II). Сульфид меди (II). Сульфид цинка |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Сульфид меди (I) представляет собой сульфид меди, химическое соединение меди и сера. Он имеет химическое соединение Cu 2 S. В природе встречается как минерал халькоцит. Он имеет узкий диапазон стехиометрии: от Cu 1,997 S до Cu 2.000 S.
Cu2S можно получить, сильно нагревая медь в парах серы или H 2 S. Реакция медного порошка в расплавленной сере быстро дает Cu 12 2 115 S, тогда как для таблеток меди требуется гораздо более высокая температура. Cu 2 S реагирует с кислородом с образованием SO 2:
При производстве меди две трети расплавленного сульфида меди окисляются, как указано выше, и Cu 2 O реагирует с неокисленным Cu 2 S с образованием металлической Cu:
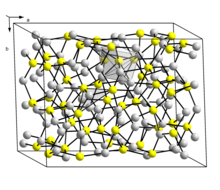
Существует две формы Cu 2 S: низкотемпературная моноклинная форма («низкохалькоцит»), который имеет сложную структуру с 96 атомами меди в элементарной ячейке и гексагональную форму, стабильную при температуре выше 104 ° C. В этой структуре есть 24 кристаллографически различных атома Cu, и эта структура была описана как приближенная к гексагональному плотноупакованному массиву атомов серы с атомами Cu в плоской 3-координации. Первоначально эта структура получила ромбическую ячейку из-за двойникования кристалла образца.
Существует также кристаллографически отличная фаза (минерал джурлеит ) со стехиометрией Cu 1,96 S, которая нестехиометрична (диапазон Cu 1,934 S-Cu 1,965 S) и имеет моноклинную структуру с 248 атомами меди и 128 атомами серы в элементарной ячейке. Cu 2 S и Cu 1,96 S похожи по внешнему виду и их трудно отличить друг от друга.