| Конканавалин A | |||||||
|---|---|---|---|---|---|---|---|
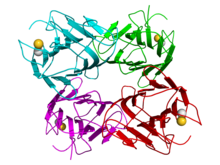 Кристаллографическая структура тетрамера jack bean конканавалина A (мономеры окрашены в голубой, зеленый, красный и пурпурный цвета соответственно). Кальций (золото) и катионы марганца (серый) обозначены сферами. Кристаллографическая структура тетрамера jack bean конканавалина A (мономеры окрашены в голубой, зеленый, красный и пурпурный цвета соответственно). Кальций (золото) и катионы марганца (серый) обозначены сферами. | |||||||
| Идентификаторы | |||||||
| Организм | Canavalia virosa (бобы) | ||||||
| Symbol | ConA | ||||||
| PDB | 3CNA | ||||||
| UniProt | P81461 | ||||||
| |||||||
Конканавалин A (ConA ) представляет собой лектин (углевод -связывающий белок ), первоначально извлеченный из Джек-Бин, Canavalia ensiformis. Это член семейства лектинов бобовых. Он специфически связывается с определенными структурами, обнаруженными в различных сахарах, гликопротеинах и гликолипидах, в основном с внутренним и невосстанавливающим концевым α-D- маннозилом и α-D-глюкозильные группы. ConA - это растение митоген, известное своей способностью стимулировать субпопуляции Т-клеток мыши, приводя к возникновению четырех функционально различных популяций Т-клеток, включая предшественников; Подмножество супрессорных Т-клеток человека также чувствительно к ConA. ConA был первым лектином, доступным на коммерческой основе, и широко используется в биологии и биохимии для характеристики гликопротеинов и других сахаросодержащих соединений на поверхность различных клеток. Он также используется для очистки гликозилированных макромолекул в лектиновой аффинной хроматографии, а также для изучения иммунной регуляции различными иммунными клетками.
Как и большинство лектинов, ConA является гомотетрамером : каждая подгруппа (26,5 кДа, 235 аминокислот, сильно гликозилированные) связывает атом металла (обычно Mn и Ca). Он имеет симметрию D2. Его третичная структура была выяснена, как и молекулярные основы его взаимодействия с металлами, а также его сродство к сахарам манноза и глюкоза хорошо известны.
ConA специфически связывает α-D-маннозил и α-D-глюкозильные остатки (две гексозы, различающиеся только спиртом на углероде 2) в концевых положениях разветвленных структур из B-гликанов (достигаются в α-маннозе, или гибридные и двухантенные гликановые комплексы). Он имеет 4 сайта связывания, соответствующих 4 субъединицам. Молекулярная масса составляет 104-112 кДа, а изоэлектрическая точка (pI) находится в диапазоне 4,5-5,5.
Конканавалин А имеет волновое число 20 см в его спектрах комбинационного рассеяния. Это излучение было приписано бета-стволу, состоящему из 14 бета-цепей в молекуле конканавалина А.
ConA также может инициировать деление клеток (митогенез), прежде всего действуя на Т- лимфоциты, стимулируя их энергетический метаболизм в течение нескольких секунд после воздействия.
Конканавалин А взаимодействует с различными рецепторами, содержащими углеводы маннозы, особенно с родопсином, группа крови маркеры, рецептор инсулина, Иммуноглобулины и карцино-эмбриональный антиген (CEA). Он также взаимодействует с липопротеинами.
ConA, сильно агглютинирует эритроциты независимо от группы крови и различные раковые клетки. Было продемонстрировано, что трансформированные клетки и нормальные клетки, обработанные трипсином, не агглютинируют при 4 ° C, что позволяет предположить, что в ConA-опосредованной агглютинации участвует термочувствительный этап.
ConA Сообщалось о -опосредованной агглютинации других типов клеток, включая мышечные клетки, B- лимфоциты (через поверхностные иммуноглобулины ), фибробласты, крысы тимоциты, эмбриональные клетки человека (но не взрослые) кишечные эпителиальные клетки и адипоциты.
ConA представляет собой лимфоцит митоген. Подобно фитогемагглютинину (PHA), это селективный митоген Т-клеток по сравнению с его действием на В-клетки. PHA и ConA связывают и перекрестно связывают компоненты Т-клеточного рецептора, и их способность активировать Т-клетки зависит от экспрессии Т-клеточного рецептора.
ConA взаимодействует с поверхностью маннозы остатков многих микробов, включая бактерии E. coli и Bacillus subtilis и простейший Dictyostelium discoideum.
. Он также был показан в качестве стимулятора нескольких матричных металлопротеиназ (ММП).
ConA оказался полезным в приложениях, требующих твердофазной иммобилизации гликоферментов, особенно тех, которые оказалось трудно иммобилизовать традиционным ковалентным связыванием. Используя матрицы ConA-пар, такие ферменты можно иммобилизовать в больших количествах без одновременной потери активности и / или стабильности. Такие нековалентные сочетания ConA-гликофермент могут быть относительно легко отменены путем конкуренции с сахарами или при кислом pH. Если необходимо для определенных применений, эти связывания можно преобразовать в ковалентные связывания с помощью химических манипуляций.
Отчет из Тайваня (2009) продемонстрировал мощный терапевтический эффект ConA против экспериментальной гепатомы (рака печени); в исследовании Lei и Chang было обнаружено, что ConA в большей степени секвестрируется опухолевыми клетками печени, а не окружающими нормальными гепатоцитами. Интернализация ConA происходит преимущественно в митохондриях после связывания с гликопротеинами клеточной мембраны, что вызывает аутофагическую гибель клеток. Было обнаружено, что ConA частично ингибирует рост опухолевых узлов независимо от активации его лимфоцитов; Искоренение опухоли на мышиной модели гепатомы in-situ в этом исследовании было дополнительно приписано митогенному / лимфопролиферативному действию ConA, которое могло активировать CD8 + T-клетки, а также NK- и NK-T-клетки. опосредованный иммунный ответ в печени.
Интравитреальная инъекция ConA может быть использована при моделировании пролиферативной витреоретинопатии у крыс.
| Викискладе есть медиафайлы, связанные с Канавалином. |