Комбинаторная химия включает методы химического синтеза, которые позволяют получить большое количество (от десятков до тысячи или даже миллионы) соединений в одном процессе. Эти библиотеки соединений могут быть созданы в виде смесей, наборов индивидуальных соединений или химических структур, созданных с помощью компьютерного программного обеспечения. Комбинаторную химию можно использовать для синтеза небольших молекул и пептидов.
Стратегии, позволяющие идентифицировать полезные компоненты библиотек, также являются частью комбинаторной химии. Методы комбинаторной химии применяются и вне химии.
Комбинаторная химия была изобретена Фуркой Á (Университет Этвёша Лоранда, Будапешт, Венгрия), который описал ее принцип, комбинаторный синтез и процедуру деконволюции в документе, нотариально заверенном в 1982 году. комбинаторный метод: синтезировать многокомпонентную составную смесь (гребенчатую inatorial library) за одну пошаговую процедуру и скрининг для поиска кандидатов в лекарственные препараты или других видов полезных соединений также в одном процессе. Важнейшим нововведением комбинаторного метода является использование смесей в синтезе и грохочении, что обеспечивает высокую производительность процесса. Мотивы, которые привели к изобретению, были опубликованы в 2002 году.
Синтез молекул комбинаторным способом может быстро привести к большому количеству молекул. Например, молекула с тремя точками разнообразия (R 1, R 2 и R 3) может генерировать 



Основной принцип комбинаторной химии состоит в том, чтобы подготовить библиотеки очень большого числа соединений, а затем идентифицировать полезные компоненты библиотек.
Хотя комбинаторная химия действительно используется промышленностью только с 1990-х годов, ее корни можно увидеть еще в 1960-х годах, когда исследователь из Рокфеллеровского университета, Брюс Меррифилд, начал исследовать твердофазный синтез пептидов.
В своей современной форме комбинаторная химия, вероятно, оказала наибольшее влияние на фармацевтическую промышленность. Исследователи, пытающиеся оптимизировать профиль активности соединения, создают «библиотеку » из множества различных, но родственных соединений. Достижения робототехники привели к промышленному подходу к комбинаторному синтезу, позволяющему компаниям регулярно производить более 100 000 новых и уникальных соединений в год.
Чтобы справиться с огромным количеством структурных возможностей, исследователи часто создают «виртуальную библиотеку», вычислительный перечень всех возможных структур данного фармакофор со всеми доступными реагентами. Такая библиотека может состоять из тысяч и миллионов «виртуальных» соединений. Исследователь выберет подмножество «виртуальной библиотеки» для фактического синтеза на основе различных расчетов и критериев (см. ADME, вычислительная химия и QSAR )..
 Пептиды, образующиеся в циклах 3 и 4
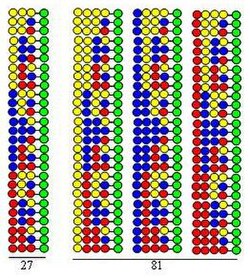
Пептиды, образующиеся в циклах 3 и 4 Комбинаторная сплит-микс (сплит и пул) Синтез основан на твердофазном синтезе, разработанном Merrifield. Если комбинаторная пептидная библиотека синтезируется с использованием 20 аминокислот (или других видов строительных блоков), твердая подложка в форме гранул делится на 20 равных частей. За этим следует присоединение разных аминокислот к каждой части. Третий шаг - смешивание всех порций. Эти три шага составляют цикл. Удлинение пептидных цепей можно осуществить, просто повторяя этапы цикла.
 Блок-схема комбинаторного синтеза расщепленной смеси
Блок-схема комбинаторного синтеза расщепленной смеси Процедура проиллюстрирована синтезом библиотеки дипептида с использованием тех же трех аминокислот в качестве строительных блоков в обоих циклах. Каждый компонент этой библиотеки содержит две аминокислоты, расположенные в разном порядке. Аминокислоты, используемые в соединениях, представлены на рисунке желтыми, синими и красными кружками. Расходящиеся стрелки показывают разделение смолы твердого носителя (зеленые кружки) на равные части, вертикальные стрелки означают связывание, а сходящиеся стрелки обозначают смешивание и гомогенизацию частей носителя.
На рисунке показано, что в двух синтетических циклах образуется 9 дипептидов. В третьем и четвертом циклах будут образовываться 27 трипептидов и 81 тетрапептид соответственно.
«Сплит-синтез» имеет несколько выдающихся характеристик:
В 1990 году три группы описали методы получения пептидных библиотек биологическими методами, а год спустя Fodor et al. опубликовали замечательный метод синтеза массивов пептидов на небольших предметных стеклах.
Метод «параллельного синтеза» был разработан Марио Гейзеном и его коллегами для получения массивов пептидов. Они синтезировали 96 пептидов на пластиковых стержнях (шпильках), покрытых на концах твердой подложкой. Штифты погружали в раствор реагентов, помещенных в лунки микротитровального планшета . Метод широко применяется, в частности, с использованием автоматических параллельных синтезаторов. Хотя параллельный метод намного медленнее, чем настоящий комбинаторный, его преимущество состоит в том, что точно известно, какой пептид или другое соединение образуется на каждом штыре.
Были разработаны дополнительные процедуры для объединения преимуществ как разделенного микширования, так и параллельного синтеза. В методе, описанном двумя группами, твердая подложка была заключена в проницаемые пластиковые капсулы вместе с радиочастотной меткой, на которой был нанесен код соединения, которое должно быть сформировано в капсуле. Процедура проводилась аналогично методу сплит-микса. Однако на стадии разделения капсулы распределяли по реакционным сосудам в соответствии с кодами, считываемыми с радиочастотных меток капсул.
Другой метод для той же цели был разработан Furka et al. называется «струнный синтез». В этом методе на капсулах нет кода. Их нанизывают, как жемчуг в ожерелье, и помещают в реакционные сосуды в виде нитей. Идентификационные данные капсул, а также их содержимое хранятся по их положению на струнах. После каждого шага связывания капсулы перераспределяются между новыми струнами по определенным правилам.
В процессе разработки лекарств синтез и биологическая оценка представляющих интерес малых молекул, как правило, были долгим и трудоемким процессом. Комбинаторная химия появилась в последние десятилетия как подход к быстрому и эффективному синтезу большого количества потенциальных малых молекул-кандидатов в лекарственные препараты. В типичном синтезе только одна целевая молекула образуется в конце схемы синтеза, причем каждая стадия синтеза дает только один продукт. В комбинаторном синтезе, при использовании только одного исходного материала, можно синтезировать большую библиотеку молекул с использованием идентичных условий реакции, которые затем могут быть проверены на их биологическую активность. Этот пул продуктов затем разделяется на три равные части, содержащие каждый из трех продуктов, а затем каждый из трех отдельных пулов реагирует с другой единицей реагента B, C или D, производя 9 уникальных соединений из предыдущих 3. Затем этот процесс повторяется до тех пор, пока не будет добавлено желаемое количество строительных блоков, в результате чего будет образовано множество соединений. При синтезе библиотеки соединений посредством многостадийного синтеза должны использоваться эффективные методы реакции, и если традиционные методы очистки используются после каждой стадии реакции, выходы и эффективность будут страдать.
Твердофазный синтез предлагает потенциальные решения, позволяющие избавиться от необходимости в типичных стадиях гашения и очистки, часто используемых в синтетической химии. Обычно исходная молекула прикрепляется к твердой подложке (обычно), затем проводятся дополнительные реакции, и конечный продукт очищается и затем отщепляется от твердой подложки. Поскольку представляющие интерес молекулы прикреплены к твердой подложке, можно сократить очистку после каждой реакции до одной стадии фильтрации / промывки, устраняя необходимость в утомительных стадиях жидкостно-жидкостной экстракции и испарения растворителя, которые используются в большинстве синтетических химикатов. Кроме того, при использовании гетерогенных реагентов можно использовать избыток реагентов для доведения вялых реакций до завершения, что может дополнительно повысить выходы. Избыточные реагенты можно просто смыть без необходимости дополнительных стадий очистки, таких как хроматография.
 Использование полиамина на твердой подложке для удаления излишков реагента
Использование полиамина на твердой подложке для удаления излишков реагента На протяжении многих лет были разработаны различные методы для уточнения использование твердофазного органического синтеза в комбинаторной химии, включая усилия по упрощению синтеза и очистки, а также нетрадиционные методы для характеристики промежуточных продуктов. Хотя в большинстве описанных здесь примеров будут использоваться гетерогенные реакционные среды на каждой стадии реакции, Бут и Ходжес предоставляют ранний пример использования реагентов на твердой подложке только во время стадии очистки традиционных синтезов в фазе раствора. По их мнению, химия в фазе раствора предлагает преимущества, заключающиеся в предотвращении реакций присоединения и расщепления, необходимых для закрепления и удаления молекул на смолах, а также в устранении необходимости воссоздавать твердофазные аналоги известных реакций в фазе раствора.
Единственная стадия очистки в конце синтеза позволяет удалить одну или несколько примесей, при условии, что химическая структура вредной примеси известна. Хотя использование реагентов на твердой подложке значительно упрощает синтез соединений, многие комбинаторные синтезы требуют нескольких стадий, каждая из которых по-прежнему требует определенной формы очистки. Армстронг и др. описывают однокомпонентный метод создания комбинаторных библиотек, называемый многокомпонентными уплотнениями (MCC). В этой схеме три или более реагентов реагируют так, что каждый реагент включается в конечный продукт за одну стадию, что устраняет необходимость в многостадийном синтезе, который включает множество стадий очистки. В МКЦ не требуется деконволюция для определения того, какие соединения являются биологически активными, потому что каждый синтез в массиве имеет только один продукт, поэтому идентичность соединения должна быть однозначно известна.
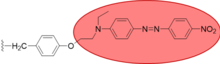 Пример твердофазного нанесенного красителя для сигнализации связывания лиганда
Пример твердофазного нанесенного красителя для сигнализации связывания лиганда В другом матричном синтезе Стилл генерировал большую библиотеку олигопептидов путем раздельного синтеза. Недостатком создания многих тысяч соединений является то, что трудно определить структуру образующихся соединений. Их решение состоит в использовании молекулярных меток, где к гранулам прикреплено крошечное количество (1 пмоль / гранула) красителя, и идентичность определенной гранулы может быть определена путем анализа того, какие метки присутствуют на гранулах. Несмотря на то, насколько легко прикрепление меток позволяет идентифицировать рецепторы, было бы совершенно невозможно индивидуально проверить каждое соединение на его способность связывания с рецептором, поэтому краситель был прикреплен к каждому рецептору, так что только те рецепторы, которые связываются с их субстратом, вызывают изменение цвета.
Когда необходимо запустить множество реакций в массиве (например, 96 реакций, описанных в одном из массивов MCC Armstrong), некоторые из наиболее утомительных аспектов синтеза можно автоматизировать для повышения эффективности. ДеВитт и Чарник подробно описывают метод, называемый «», в котором многие миниатюрные версии химических реакций выполняются одновременно. В этом методе используется устройство, которое автоматизирует циклы загрузки смолы и промывки, а также мониторинг и очистку реакционного цикла, а также демонстрирует осуществимость их метода и устройства, используя его для синтеза различных классов молекул, таких как гидантоины. и бензодиазепины, в большинстве случаев протекающие 40 индивидуальных реакций.
Зачастую использование дорогостоящего оборудования невозможно, и Schwabacher и др. описать простой метод комбинирования параллельного синтеза членов библиотеки и оценки целых библиотек соединений. В их методе нить, которая разделена на разные области, оборачивается вокруг цилиндра, где другой реагент затем присоединяется к каждой области, которая содержит только один вид. Затем нить повторно разделяется и наматывается на цилиндр другого размера, после чего этот процесс повторяется. Прелесть этого метода в том, что идентичность каждого продукта может быть определена просто по его расположению на нити, а соответствующая биологическая активность идентифицируется с помощью.
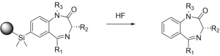 Использование бесследного линкера
Использование бесследного линкера В большинстве описанных здесь синтезов необходимо прикрепить и удалить исходный реагент на твердой подложке или с нее. Это может привести к образованию гидроксильной группы, которая потенциально может повлиять на биологическую активность целевого соединения. Эллман использует твердофазные носители в схеме многостадийного синтеза для получения 192 индивидуальных производных 1,4-бензодиазепина, которые являются хорошо известными терапевтическими агентами. Чтобы исключить возможность потенциального вмешательства гидроксильных групп, используется новый метод, основанный на химии силиларила, для связывания молекул с твердой подложкой, которая отщепляется от подложки и не оставляет следов линкера.
 Соединения, которые можно синтезировать из иминов, связанных твердой фазой.
Соединения, которые можно синтезировать из иминов, связанных твердой фазой. При закреплении молекулы на твердом носителе промежуточные соединения нельзя выделить друг от друга без отщепления молекулы от смолы. Поскольку многие традиционные методы определения характеристик, используемые для отслеживания хода реакции и подтверждения структуры продукта, основаны на растворах, необходимо использовать разные методы. Гель-фазовая 13 C ЯМР-спектроскопия, MALDI-масс-спектрометрия и ИК-спектроскопия использовались для подтверждения структуры и мониторинга хода твердофазных реакций. Гордон и др. Описывают несколько тематических исследований, в которых имины и пептидилфосфонаты используются для создания комбинаторных библиотек малых молекул. Для создания иминной библиотеки аминокислота, связанная со смолой, реагирует в присутствии альдегида. Авторы продемонстрировали использование быстрой 13 C-гель-фазовой ЯМР-спектроскопии и 1 H-ЯМР-спектроскопии с вращением под магическим углом для отслеживания хода реакций и показали, что большинство иминов может быть образовано всего за 10 минут при комнатной температуре, когда триметилортоформиат использовался в качестве растворитель. Образованные имины затем дериватизировали с образованием 4-тиазолидинонов, B-лактамов и пирролидинов.
Использование твердофазных носителей значительно упрощает синтез больших комбинаторных библиотек соединений. Это делается путем прикрепления исходного материала к твердой подложке и последующего проведения последующих реакций до тех пор, пока не будет создана достаточно большая библиотека, после чего продукты отщепляются от подложки. Использование твердофазной очистки также было продемонстрировано для использования в схемах синтеза в растворе в сочетании со стандартными методами очистки экстракцией жидкость-жидкость.
Комбинаторные библиотеки - это специальные многокомпонентные смеси низкомолекулярных химических соединений, которые синтезируются в единственном пошаговом процессе. Они отличаются от набора индивидуальных соединений, а также от ряда соединений, полученных параллельным синтезом. Важной особенностью является то, что при их синтезе используются смеси. Использование смесей обеспечивает очень высокую эффективность процесса. Оба реагента могут быть смесями, и в этом случае процедура будет еще более эффективной. Однако по практическим причинам рекомендуется использовать метод смешивания, в котором одна из двух смесей заменяется отдельными строительными блоками (BB). Смеси настолько важны, что не существует комбинаторных библиотек без использования смеси в синтезе, и если смесь используется в процессе, неизбежно образуются комбинаторные библиотеки. Синтез расщепленной смеси обычно осуществляется с использованием твердого носителя, но его можно применять и в растворе. Поскольку он структурирует компоненты, неизвестны методы деконволюции, которые необходимо использовать при скрининге. Одной из наиболее важных особенностей комбинаторных библиотек является то, что вся смесь может быть проверена в одном процессе. Это делает эти библиотеки очень полезными в фармацевтических исследованиях. Также могут быть синтезированы частичные библиотеки полных комбинаторных библиотек. Некоторые из них могут быть использованы при деконволюции
Если синтезированные молекулы комбинаторной библиотеки отщеплены от твердого носителя, образуется растворимая смесь. В таком растворе можно найти миллионы различных соединений. Когда был разработан этот синтетический метод, сначала казалось невозможным идентифицировать молекулы и найти молекулы с полезными свойствами. Однако для решения этой проблемы были разработаны стратегии определения полезных компонентов. Все эти стратегии основаны на синтезе и тестировании частичных библиотек. Самая ранняя итеративная стратегия описана в вышеупомянутом документе Furka, нотариально заверенном в 1982 г. Метод был позже независимо опубликован Erb et al. под названием «Рекурсивная деконволюция»
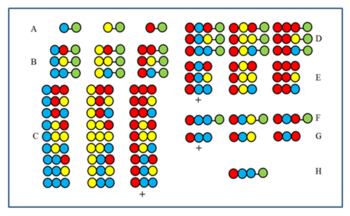 Рекурсивная деконволюция. Синие, желтые и красные кружки: аминокислоты, зеленый кружок: твердая подложка
Рекурсивная деконволюция. Синие, желтые и красные кружки: аминокислоты, зеленый кружок: твердая подложка Метод понятен из рисунка. Пептидная библиотека из 27 членов синтезируется из трех аминокислот. После первого (A) и второго (B) циклов образцы были отложены перед их смешиванием. Продукты третьего цикла (C) перед смешиванием расщепляют, затем проверяют на активность. Предположим, что группа, помеченная знаком +, активна. Все члены имеют красную аминокислоту в последней позиции связывания (CP). Следовательно, активный член также имеет красную аминокислоту на последней CP. Затем красная аминокислота соединяется с тремя образцами, отложенными после второго цикла (B), чтобы получить образцы D. После расщепления образуются три образца E. Если после тестирования образец, помеченный знаком +, является активным, это показывает, что синяя аминокислота занимает вторую CP в активном компоненте. Затем к трем образцам A сначала присоединяется синяя, затем красная аминокислота (F), затем снова тестируется после расщепления (G). Если компонент + оказывается активным, последовательность активного компонента определяется и отображается в H.
Позиционное сканирование было введено независимо Furka et al. и Pinilla et al. Метод основан на синтезе и тестировании серии подбиблиотек. в которой определенное положение в последовательности занято одной и той же аминокислотой. На рисунке показаны девять подбиблиотек (B1-D3) полной библиотеки пептидных тримеров (A), состоящей из трех аминокислот. В подбиблиотках есть позиция, которую во всех компонентах занимает одна и та же аминокислота. При синтезе подбиблиотеки носитель не разделяется, и только одна аминокислота связывается со всем образцом. В результате одно положение действительно занято одной и той же аминокислотой во всех компонентах. Например, в подбиблиотеке B2 позиция 2 занята «желтой» аминокислотой во всех девяти компонентах. Если в скрининговом тесте эта подбиблиотека дает положительный ответ, это означает, что позиция 2 в активном пептиде также занята «желтой» аминокислотой. Аминокислотная последовательность может быть определена путем тестирования всех девяти (или иногда меньше) подбиблиотек.
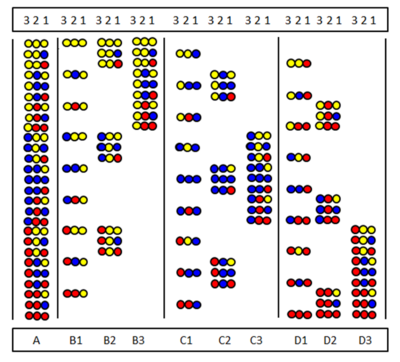 Позиционное сканирование. Библиотека полных тримеров пептидов, состоящая из 3 аминокислот и ее 9 подбиблиотек. В первой строке показаны положения связывания
Позиционное сканирование. Библиотека полных тримеров пептидов, состоящая из 3 аминокислот и ее 9 подбиблиотек. В первой строке показаны положения связывания  полной библиотеки трипептидов из 27 членов и трех библиотек пропусков. Цветные кружки представляют собой аминокислоты.
полной библиотеки трипептидов из 27 членов и трех библиотек пропусков. Цветные кружки представляют собой аминокислоты. В пропускаемых библиотеках некоторая аминокислота отсутствует во всех пептидах смеси. На рисунке показана полная библиотека и три библиотеки пропусков. Вверху показаны пропущенные аминокислоты. Если библиотека пропусков дает отрицательный результат, значит пропущенная аминокислота присутствует в активном компоненте.
Если пептиды не отщепляются от твердой подложки, мы имеем дело со смесью гранул, каждая гранула содержит один пептид. Смит и его коллеги ранее показали, что пептиды можно тестировать и в связанной форме. Этот подход также использовался при скрининге пептидных библиотек. Библиотеку связанных пептидов тестировали с растворенным целевым белком. Гранулы, к которым был прикреплен белок, были взяты, белок удален из гранулы, затем связанный пептид идентифицирован путем секвенирования. Несколько иного подхода придерживались Тейлор и Моркен. Они использовали инфракрасную термографию для идентификации катализаторов в библиотеках, не связанных с пептидами. Метод основан на тепле, которое выделяется в шариках, содержащих катализатор, когда привязанная библиотека погружается в раствор подложки. Когда шарики исследуются под инфракрасным микроскопом, шарики, содержащие катализатор, выглядят как яркие пятна и их можно различить.
Если мы имеем дело с библиотекой непептидных органических библиотек, определить идентичность содержимого гранулы не так просто, как в случае пептидной. Чтобы обойти эту трудность, были разработаны методы прикрепления к шарикам, параллельно с синтезом библиотеки, молекул, которые кодируют структуру соединения, образованного в шарике. Олмайер и его коллеги опубликовали метод двоичного кодирования. Они использовали смеси из 18 меченых молекул, которые после отщепления их от бусинок можно было идентифицировать с помощью газовой хроматографии с электронным захватом. Саркар и др. описали хиральные олигомеры пентеновых амидов (COPA), которые можно использовать для создания массово кодируемых библиотек OBOC. Kerr et al. представил инновационный метод кодирования. Ортогонально защищенный съемный бифункциональный линкер был прикреплен к гранулам. Один конец линкера использовали для присоединения неприродных строительных блоков библиотеки, в то время как с другим концом были связаны триплеты кодирующих аминокислот. Строительными блоками были неприродные аминокислоты, и последовательность их кодирующих триплетов аминокислот может быть определена деградацией по Эдману. Важным аспектом этого типа кодирования была возможность отщепить от бусинок членов библиотеки вместе с прикрепленными к ним тегами кодирования, формируя растворимую библиотеку. Такой же подход использовали Nikolajev et al. для кодирования пептидами. В 1992 году Бреннер и Лернер представили последовательности ДНК для кодирования гранул твердой подложки, что оказалось наиболее успешным методом кодирования. Нильсен, Бреннер и Янда также использовали подход Керра для реализации кодирования ДНК. В последнее время произошли важные достижения в области секвенирования ДНК. Методы следующего поколения позволяют параллельно секвенировать большое количество образцов, что очень важно при скрининге библиотек, кодируемых ДНК. Было еще одно нововведение, которое способствовало успеху кодирования ДНК. В 2000 году Хэлпин и Харбери отказались от твердой основы в синтезе комбинаторных библиотек, кодируемых методом сплит-микса, и заменили ее кодирующими олигомерами ДНК. При твердофазном расщеплении и синтезе пула количество компонентов библиотек не может превышать количество гранул носителя. Благодаря новому подходу авторов это ограничение было полностью снято и позволило получать новые соединения практически в неограниченном количестве. Датская компания Nuevolution, например, синтезировала кодированную ДНК библиотеку, содержащую 40 триллионов! компоненты. Библиотеки, кодируемые ДНК, являются растворимыми, что позволяет применять эффективное аффинное связывание при скрининге. Некоторые авторы применяют DEL для акромима комбинаторных библиотек, кодируемых ДНК, другие используют DECL. Последнее кажется лучше, поскольку в этом названии четко выражается комбинаторный характер этих библиотек. В первое десятилетие нынешнего тысячелетия были введены и описаны несколько типов комбинаторных библиотек, кодируемых ДНК. Эти библиотеки очень успешно применяются в исследованиях лекарственных средств.
Подробно об их синтезе и применении можно найти на странице ДНК-кодированная химическая библиотека. Растворимые комбинаторные библиотеки, кодируемые ДНК, также имеют недостатки. Прежде всего, полностью теряется преимущество от использования прочной опоры. Кроме того, полиионный характер цепей, кодирующих ДНК, ограничивает использование неводных растворителей в синтезе. По этой причине многие лаборатории предпочитают разрабатывать ДНК-совместимые реакции для использования в синтезе DECL. Многие из доступных уже описаны
Материаловедение применило методы комбинаторной химии для открытия новых материалов. Первым в этой работе был П.Г. Шульц и др. в середине девяностых годов в контексте люминесцентных материалов, полученных путем совместного осаждения элементов на кремниевой подложке. Его работе предшествовал J. J. Hanak в 1970 году, но компьютерные и робототехнические инструменты не были доступны для распространения метода в то время. Работа была продолжена несколькими академическими группами, а также компаниями с крупными программами исследований и разработок (Symyx Technologies, GE, Dow Chemical и др.). Этот метод широко используется для катализа, нанесения покрытий, электроники и многих других областей. Применение соответствующих инструментов информатики критически важно для обработки, администрирования и хранения огромных объемов производимых данных. Новые типы методов Планирование экспериментов также были разработаны для эффективного решения больших экспериментальных задач, с которыми можно справиться с помощью комбинаторных методов.
Хотя Комбинаторная химия была неотъемлемой частью первых открытий лекарств более двух десятилетий, до сих пор только одно химическое вещество, синтезированное de novo комбинаторной химией, было одобрено для клинического использования FDA (сорафениб, ингибитор мультикиназы, показанный для запущенный рак почек). Было высказано предположение, что анализ плохой успешности подхода связан с довольно ограниченным химическим пространством, покрытым продуктами комбинаторной химии. При сравнении свойств соединений в библиотеках комбинаторной химии со свойствами одобренных лекарств и натуральных продуктов Фехер и Шмидт отметили, что библиотеки комбинаторной химии особенно страдают от недостатка хиральности, а также жесткости структуры, причем и то, и другое. широко считаются лекарственными свойствами. Несмотря на то, что натуральные продукты открытие лекарств, вероятно, не были самой модной тенденцией в фармацевтической промышленности в последнее время, большая часть новых химических соединений все еще является соединениями природного происхождения, и поэтому было высказано предположение, что Эффективность комбинаторной химии можно повысить за счет увеличения химического разнообразия скрининговых библиотек. Поскольку хиральность и жесткость являются двумя наиболее важными характеристиками, отличающими одобренные лекарства и натуральные продукты от соединений в библиотеках комбинаторной химии, эти две проблемы подчеркиваются в так называемых библиотеках, ориентированных на разнообразие, то есть коллекциях соединений, которые нацелены на охват химического пространства, а не всего огромного количества соединений.
В 8-м издании Международной патентной классификации (МПК), вступившей в силу 1 января 2006 г. был создан специальный подкласс для патентных заявок и патентов, связанных с изобретениями в области комбинаторной химии: «C40B».