 | |
| Клинические данные | |
|---|---|
| Произношение | |
| Торговые наименования | Cotellic |
| Другие наименования | GDC-0973, XL-518 |
| AHFS / Drugs.com | Монография |
| MedlinePlus | a615057 |
| Данные лицензии |
|
| Pr egnancy. категория |
|
| Пути введения. | Устно (таблетки ) |
| код АТС | |
| Правовой статус | |
| Правовой статус | |
| Фармакокинетика данные | |
| Биодоступность | сообщается от 28% до 46% |
| Связывание с белками | 95% |
| Метаболизм | Кишечный и низкий печеночный клиренс (в основном CYP3A4 окисление и UGT2B7 глюкуронизация) |
| Период полувыведения | 44 часа (среднее) |
| Экскреция | Кал (76–77%), моча (17,9–18 %) (после перорального и внутривенного введения) |
| Идентификаторы | |
Название ИЮПАК
| |
| Номер CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL |
|
| CompTox Dashboard (EPA ) | |
| Химические и физические данные | |
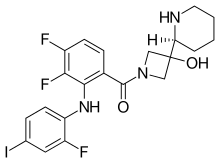
| Формула | C21H21F3IN3O2 |
| Молярная масса | 531,318 г · моль |
| 3D-модель (JSmol ) | |
УЛЫБКИ
| |
InChI
| |
Кобиметиниб (торговое название Cotellic ) представляет собой ингибитор MEK, разработанный Exelixis и Genentech (Рош ). Он используется в комбинации с вемурафенибом, ингибитором BRAF, для лечения меланомы. В ноябре 2015 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило кобиметиниб для лечения неоперабельной или метастатической меланомы с BRAF V600E или мутацией в сочетании с вемурафенибом (Зелбораф). Кобиметиниб не показан для лечения пациентов с меланомой BRAF дикого типа.
Кобиметиниб одобрен для использования в комбинации с вемурафенибом (Зелбораф) для лечения запущенной меланомы с мутацией BRAF (V600E или V600K), которая не может быть удален хирургическим путем или имеет метастазы.
Общие побочные эффекты, наблюдаемые у лиц, принимавших кобиметиниб и вемурафениб в клинических испытаниях, включали диарею, тошноту, рвоту, сыпь, светочувствительность и пирексия.
Кобиметиниб получил статус орфанного препарата FDA в отношении злокачественной меланомы с мутацией BRAFV600 в 2014 году.
Приобретено резистентность к ингибиторам BRAF, таким как вемурафениб и дабрафениб, обычно возникает после нескольких месяцев реакции опухоли без прогрессирования. Доклинические данные указывают на участие путей MAPK и MAPK-независимой передачи сигналов в развитии резистентности, что позволяет предположить двойное ингибирование киназы MEK и BRAF как стратегию увеличения продолжительности ответа опухоли, наблюдаемого при ингибировании только BRAF.
В клинических испытаниях фазы III комбинация кобиметиниба и вемурафениба была протестирована на пациентах с метастатической меланомой с мутацией BRAFV600, что привело к значительному улучшению выживаемости без прогрессирования у пациентов, но также произвело некоторое увеличение токсичности. Комбинация увеличивала выживаемость без прогрессирования в среднем до 12,3 месяца по сравнению с 7,2 месяцами для одного вемурафениба. Эти клинические данные также показали, что комбинированное лечение привело к 65% выживаемости пациентов через 17 месяцев после начала лечения, что выше у 50% пациентов, получавших только лечение вемурафенибом. Добавление кобиметиниба также увеличивало медианную общую выживаемость до 25,6 месяцев по сравнению с 18 месяцами для одного вемурафениба.
Доклинические исследования показывают, что комбинированное применение кобиметиниба с ингибированием PI3K может усилить действие антибиотиков. -раковые эффекты препарата с синергическим ответом, наблюдаемым в клеточных линиях рака легких.