| Инфекция Clostridioides difficile | |
|---|---|
| Другие названия | C. difficile, ассоциированная диарея (CDAD), инфекция, вызванная Clostridium difficile, колит, вызванный C. difficile |
 | |
| Патологический образец, показывающий псевдомембранозный колит | |
| Специализация | Инфекционное заболевание |
| Симптомы | Диарея, лихорадка, тошнота, боль в животе |
| Осложнения | Псевдомембранозный колит, токсический мегаколон, перфорация толстой кишки, сепсис |
| Причины | Clostridioides difficile распространяется фекально-оральным путем |
| Факторы риска | Антибиотики, ингибиторы протонной помпы, госпитализация, другие проблемы со здоровьем, пожилой возраст |
| Метод диагностики | Посев стула, тестирование на ДНК или токсины |
| Профилактика | Мытье рук, уборка конечной комнаты в больнице |
| Лечение | Метронидазол, ванкомицин, фидаксомицин, трансплантация фекальной микробиоты |
| Частота | 453000 (США 2011) |
| Смертность | 29000 (США) |
Инфекция, вызванная Clostridioides difficile (CDI или C-diff ), также известная как инфекция Clostridium difficile, является симптоматической инфекцией, вызванной спорами -образующая бактерия Clostridioides difficile. Симптомы включают водянистую диарею, жар, тошноту и боль в животе. Он составляет около 20% случаев диареи, не связанные с антибиотиками. Осложнения могут быть псевдомембранозный колит, токсический мегаколон, перфорация толстой кишки и сепсис.
Инфекция Clostridioides difficile распространяется через бактериальные споры, обнаруженные внутри кал. Поверхности могут быть заражены спорами с дальней распространением через руки медицинских работников. Факторы риска заражения включают использование антибиотиков или ингибиторов протонной помпы, госпитализацию, другие проблемы со здоровьем и пожилой возраст. Диагноз ставится на основании посева кала или анализа на ДНК или токсины бактерий. Если у человека положительный результат теста, но нет никаких симптомов, это состояние известно как C. difficile колонизация, а не инфекция.
Профилактические меры включают окончательную уборку помещений в больницах, ограничение использования антибиотиков и мытье рук кампании в больницах. Дезинрующее средство для рук на спиртовой основе неэффективно. Прекращение приема антибиотиков может привести к исчезновению симптомов в течение трех дней примерно у 20% инфицированных. Антибиотики метронидазол, ванкомицин или фидаксомицин излечивают инфекцию. Повторное тестирование после лечения, пока симптомы не исчезнут, не рекомендуется, так как человек может часто оставаться колонизированным. О рецидивах сообщалось до 25% людей. Некоторые предварительные данные указывают на то, что трансплантация фекальной микробиоты и пробиотики могут снизить риск рецидива.
С. difficile встречаются во всех регионах мира. В 2011 году в США было зарегистрировано 453 000 случаев заболеваний, в результате которых погибло 29 000 человек. В период с 2001 по 2016 год увеличились глобальные показатели заболеваемости. Инфекции C. difficile чаще встречаются у женщин, чем у мужчин. Бактерия была открыта в 1935 году и признана вызывающей болезнь в 1978 году. В средствах Штатах инфекций, связанных со здравоохранением, ежегодно увеличивают стоимость лечения на 1,5 миллиарда долларов США. Хотя C. difficile является распространенной инфекцией, не более 30% инфекций передаются в больницах. Большинство инфекций передаются за пределами больниц, где считается недавняя история диарейных заболеваний (например, злоупотребление слабительными или пищевое отравление из-за сальмонеллеза ) увеличивают риск колонизации..
Признаки и симптомы ИКД подходят от легкой диареи до тяжелого опасного для жизни воспаления толстой кишки.
У вас правило клинического прогноза признано лучшим признаки древ диареи («новое начало более трех частично сформированных или водянистых стула за 24-часовой период»), недавнее воздействие антибиотиков, боль в животе, лихорадка (до 40,5 ° C или 105 ° F), и характерный неприятный запах стула, напоминающий конский навоз. В популяции стационаров предыдущее лечение антибиотиками плюс диарея или боль в животе имели чувствительность 86% и специфичность 45%. В этом исследовании с распространением положительных анализов на цитотоксин 14%, прогностическая ценность положительного результата составляла 18%, прогностическая ценность отрицательного результата составляла 94%.
У детей наиболее распространенным симптомом ИКД является водянистая диарея с дефекацией не менее трех раз в течение двух или более дней, которая может сопровождаться лихорадкой, потерей аппетита, тошнотой и / или абдоминальной болью. У людей с тяжелой инфекцией также может развиться серьезное воспаление толстой кишки, и диарея будет незначительной или совсем не будет.
 Как распространяется C. difficile
Как распространяется C. difficile Заражение C. difficile бактерии вызывают диарею, вызванную C. difficile.
 Отдельные бациллы C. difficile в форме голени, видимые с помощью сканирующей электронной микроскопии
Отдельные бациллы C. difficile в форме голени, видимые с помощью сканирующей электронной микроскопии 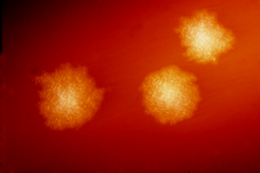 C. difficile на чашке с агаром
C. difficile на чашке с агаром . Clostridia - это анаэробные подвижные бактерии, широко распространенные в природе и особенно распространенные в почве. Под микроскопом они выглядят как длинные клетки неправильной формы с выпуклостью на концах. При окрашивании по Граму клетки C. difficile являются грамположительными и демонстрируют другой рост на кровяном агаре при температурех человеческого тела в отсутствии кислорода. При стрессе бактерии производят споры, которые способны переносить экстремальные условия, которые не могут переноситься активными бактериями.
С. difficile может колонизировать толстую кишку человека без симптомов; приблизительно 2–5% взрослого населения, хотя эта цифра изменяется в зависимости от демографии. Риск колонизации связан с историей несвязанных диарейных заболеваний (например, злоупотребление слабительными и пищевое отравление, вызванное сальмонеллезом или холерный вибрион инфекция).
Патогенный C Штаммы.difficile продуцируют несколько токсинов. Наиболее хорошо охарактеризованными являются энтеротоксин (токсин A Clostridium difficile ) и цитотоксин (токсин B Clostridium difficile ), оба из которых могут вызывать диарею и воспаление у инфицированных людей, хотя их относительный вклад обсуждается. Токсины A и B предоставляют собой глюкозилтрансферазы, которые нацелены и инактивируют GTPases семейства Rho. Токсин B (цитотоксин) индуцирует деполимеризацию актина по механизму, коррелирующему со снижением АДФ-рибозилирования низкомолекулярных GTP-связывающих белков Rho. Другой токсин, бинарный токсин, также был описан, но его роль в заболевании до конца не изучена.
Лечение ИКД антибиотиками может быть затруднено как из-за устойчивости к антибиотикам и физиологические факторы бактерий (спорообразование, защитные эффекты псевдомембраны). Появление нового высокотоксичного штамма C. difficile, устойчивого к фторхинолоновым антибиотикам, таким как ципрофлоксацин и левофлоксацин, что, как признано, вызывает географически разрозненные вспышки в Америке, было сообщено в 2005 году. Центры США по контролю и профилактике заболеваний в Атланте предупредили о появлении эпидемического штамма с повышенной вирулентностью, устойчивостью к антибиотикам или и тем, и другим.
С. difficile передается от человека к человеку фекально-оральным путем. Организм образует термостойкие споры, которые не уничтожаются для мытья рук на спиртовой основе или обычной очисткой поверхности. Таким образом, эти споры выживают в клинических условиях в течение длительного времени. Благодаря этой бактерии можно выращивать практически с любой поверхности. Когда споры попадают в организм, их кислотостойкость позволяет им проходить через желудок невредимыми. Под воздействием желчных кислот они прорастают и размножаются в вегетативных клетках толстой кишки. Люди, у которых не было желудочно-кишечных расстройств, из-за употребления антибиотиков или диарейных заболеваний, менее вероятно, что они станут колонизированными C. difficile.
В 2005 году молекулярный анализ привел к идентификации типа шма C. difficile, охарактеризованного как группа BI анализом эндонуклеазы рестрикции, как североамериканский NAP1 импульсного поля с помощью гель-электрофореза в импульсном поле и как риботип 027; различная терминология использует преобладающие методы, используемые для эпидемиологического типирования. Этот штамм обозначается как C. difficile BI / NAP1 / 027.
C. difficile чаще всего ассоциируется с использованием следующих антибиотиков: фторхинолонов, цефалоспоринов и клиндамицина.
. Некоторые исследования предполагают, что рутинное использование антибиотиков в домашнем скота может вызвать инфекционные болезни, такие как C. difficile.
Люди чаще всего заражаются в больницах, дома престарелых или другие медицинские учреждения, хотя инфекция за пределами медицинских учреждений растет. У людей может развиться инфекция, если они дотронутся до предметов или поверхностей, загрязненных фекалиями, а затем коснутся рта или слизистых оболочек. Медицинские работники могут распространять бактерии или загрязнения поверхности через контакт с руками. Частота двух заражений C. difficile оценивается в 13% тех, кто находится в больнице до недель, и 50% при пребывании более четырех недель.
Длительная госпитализация или проживание в доме престарелых в течение предыдущего года являются независимыми факторами риска повышенной колонизации.
Увеличение показателей внебольничной ИКД связано с использованием лекарств для подавления желудочной кислоты выработка: антагонисты Н2-рецепторов увеличивают риск в 1,5 раза, а ингибиторы протонной помпы - в 1,7 раза при применении один раз в день и в 2, 4 раза при использовании более одного раза в день.
Люди с недавней историей диарейных заболеваний подвергаются повышенному риску колонизации C. difficile при контакте со спорами, включая злоупотребление слабыми и желудочно-кишечными патогены. Считается, что нарушения увеличивают перистальтику кишечника, временно повышают концентрацию доступных диетических сахаров, позволяя C. difficile размножаться и закрепляться в кишечнике. Хотя не все события колонизации вызывают заболевание, бессимптомные носители колонизированными в течение многих лет. В течение этого времени возбудителя возбудителя повышенного уровня внебольничных инфекций, вызываемого возбудителем повышенного уровня внебольничных инфекций.
В результате подавления здоровых бактерий за счет потери источника бактериальной пищи, продолжительное использование элементарной диеты увеличивает риск развития C. difficile. Низкий уровень сывороточного альбумина является фактором риска развития инфекции C. difficile и тяжелого заболевания при инфицировании. Защитные эффекты сывороточного альбумина связаны со способностью этого белка связывать токсин A и токсин B C. difficile, препятствует проникновению в энтероциты.
Использование системных антибиотиков, включая пенициллины / цефалоспорины широкого действия, фторхинолоны и клиндамицин, вызывающие изменение нормальных микробиоты кишечника. В частности, когда антибиотик убивает другие конкурирующие бактерии в кишечнике, любые оставшиеся бактерии имеют меньшую конкуренцию за пространство и питательные вещества. В конце концов, некоторые бактерии могут расти быстрее обычного. C. difficile - один из таких видов бактерий. Помимо пролиферации в кишечнике, C. difficile также продуцирует токсины. Без токсина A или токсина B C. difficile может колонизировать кишечник, но вряд ли вызовет псевдомембранозный колит. Колит, связанный с тяжелой инфекцией, является частью воспалительных реакций, когда «псевдомембрана» образована вязким скоплением воспалительных клеток фибрина и некротических клеток.
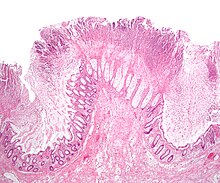 Микрофотография псевдомембраны толстой кишки при колите C. difficile, типе псевдомембранозного колита, окрашивание HE
Микрофотография псевдомембраны толстой кишки при колите C. difficile, типе псевдомембранозного колита, окрашивание HE  Эндоскопическое изображение псевдомембранозного колита с желтыми псевдомембранами на стенке сигмовидной кишки
Эндоскопическое изображение псевдомембранозного колита с желтыми псевдомембранами на стенке сигмовидной кишки  Псевдомембранозный колит на компьютерной томографии
Псевдомембранозный колит на компьютерной томографии До появления тестов для обнаружения токсинов C. difficile диагноз чаще всего ставился с помощью колоноскопии или сигмоидоскопии. Появление «псевдомембран» на слизистой оболочке толстой кишки или прямой кишки весьма наводит на размышления, но не является диагностическим признаком состояния. Псевдомембраны состоят из экссудата, состоящего из воспалительного мусора, лейкоцитов. Хотя колоноскопия и ректороманоскопия все еще используются, в настоящее время анализ стула на наличие токсинов C. difficile часто является диагностическим методом первой линии. Обычно проверяются только два токсина - токсин A и токсин B - но производит несколько других. Этот тест не является 100% точным, со значительным ложноотрицательными результатами даже при повторном тестировании.
C. difficile обеспечивает цитопатический эффект в культуре клеток, и нейтрализация любого эффекта, наблюдаемого с помощью специфических антисывороток, является практическим золотым стандартом для исследований, посвященных новым методам диагностики ИКД. Токсигенная культура, в которой организмы культивируются на селективных средах и тестах на продукцию токсинов, остается стандартным и специфическим тестом, хотя он медленный и трудоемкий.
Оценка токсинов A и B с помощью иммуноферментного анализа (ELISA ) для токсина A или B (или обоих) имеет чувствительность 63–99% и специфичность 93–100%.
Ранее использовались предварительные рекомендации по диагностике, которые могут быть отрицательными, но данные показывают, что повторное тестирование одного и того же эпизода имеет ограниченную ценность и не рекомендуется. Токсин C. difficile должен выводиться из стула ранее инфицированного человека, если лечение эффективно. Многие больницы проверяют только распространенный токсин А. Штаммы, которые экспрессируют только токсин В, проходят тестирование на оба токсина. Отсутствие тестирования на оба эти фактора может привести к задержке в получении лабораторных результатов, что часто является причиной длительного заболевания и плохих результатов.
Стул измерения лейкоцитов и уровни кала лактоферрина также были предложены в качестве диагностических тестов, но могут иметь ограниченную диагностическую точность. 48>
Тестирование образцов стула с помощью полимеразной цепной реакции в реальном времени позволяет обнаружить C. difficile примерно в 93% случаев, когда положительный результат является ошибочно положительным, примерно 3 случая. % времени. Это более точно, чем анализ цитотоксигенной культуры или клеточной цитотоксичности. Еще одно преимущество - результат достигается в течение трех часов. К недостаткам можно отнести более высокую стоимость и тот, что тест ищет только ген токсина, а не сам токсин. Последнее, что при использовании теста без подтверждения может гипердиагностика. Повторное тестирование может ввести в заблуждение, а тестирование образцов чаще одного раза в семь дней у людей без новых симптомов вряд ли даст полезную информацию.
Самодостаточность путем размещения людей в частных комнатах является важно для предотвращения распространения C. difficile. Меры предосторожности при контакте - важная часть предотвращения распространения C. difficile. C. difficile не часто встречается у людей, которые не принимают антибиотики, поэтому ограничение использования антибиотиков снижает риск.
Наиболее эффективным методом предотвращения ИКД является правильный антибиотик прописывать. В условиях больницы, где ИКД является наиболее распространенным явлением, большинство людей, у которых развивается ИКД, подвергаются воздействию антибиотиков. Хотя надлежащее назначение антибиотиков настоятельно рекомендуется, около 50% считаются нецелесообразными. Это одинаково, будь то в больнице, клинике, сообществе или академической среде. Было продемонстрировано, что снижение ИКД за счет ограничения приема антибиотиков или ограничения ненужных рецептов в целом, как во время вспышки, так и в условиях отсутствия вспышки, наиболее тесно связано со снижением ИКД. Кроме того, реакции на лекарства могут быть тяжелыми: инфекции ИКД были наиболее частой причиной нежелательных лекарств, наблюдаемых в больницах США в 2011 году. В некоторых регионах Великобритании сокращение использования антибиотиков фторхинолонов, по-видимому, приводит к снижению частота ИКД.
Некоторые данные указывают на то, что пробиотики могут быть полезны для предотвращения инфекции и рецидива. Также может быть полезным лечение Saccharomyces boulardii у тех, у кого не ослаблен иммунитет клостридиум диффициле. Первоначально, в 2010 году, Общество инфекционных болезней Америки не рекомендовало их использовать из-за риска осложнений. Однако в последующих обзорах не было обнаружено увеличения побочных эффектов лечения, и в целом лечение оказалось безопасным и умеренно эффективным в предотвращении диареи, связанной с Clostridium difficile.
Строгие протоколы инфекций требуется для сведения к минимуму риска передачи. Меры инфекционного контроля, такие как ношение перчаток и некритических медицинских устройств, используемых для одного человека с ИКД, являются эффективными для профилактики. Это работает, ограничивая распространение C. difficile в условиях больницы. Кроме того, мытье с мылом и водой удалит споры с загрязненных рук, но протирка рук на спиртовой основе неэффективна. Эти мерыпредосторожности соблюдаться среди пациентов, находящихся в больнице, в течение минимум 2 дней после прекращения диареи.
Отбеливающие салфетки, содержащие 0,55% гипохлорита натрия, убивают споры и предотвращают передачу инфекции.. Установка туалетов с крышками и закрытие крышки перед смывом снижает риск заражения.
Те, у кого есть ИКД, должны находиться в палатах с другими людьми с ИКД или в одиночестве, когда они находятся в больнице.
Обычно больничные дезинфицирующие средства неэффективны против спор C. difficile и могут вызвать образование спор, но дезинфицирующие средства, содержащие соотношение воды и отбеливателя 10: 1, эффективно уничтожают споры. Перекись водорода Системы пара (HPV), использованные для стерилизации комнаты после завершения лечения показали, что они снижают уровень инфицирования и риск заражения других. Заболеваемость ИКД снизилась на 53% или 42% благодаря использованию ВПЧ. Устройства для ультрафиолетовой очистки и обслуживающий персонал, специально предназначенные для дезинфекции людей с C. difficile после выписки, могут быть эффективными.
Ношение C. difficile без симптомов является обычным явлением. Лечение бессимптомных пациентов противоречиво. В общем, легкие случаи не требуют специального лечения. Пероральная регидратационная терапия полезна при лечении обезвоживания, связанного с диареей.
Для лечения C. difficile используются несколько различных антибиотиков, при этом доступные агенты более или менее одинаково эффективны.
Ванкомицин или фидаксомицин полости рта обычно рекомендуются при легких, умеренных и тяжелых инфекциях. Они также являются препаратами первой линии для беременных, особенно потому, что метронидазол может вызывать врожденные дефекты. Типичный ванкомицин принимает внутрь четыре раза в день в течение 10 дней. Его также можно вводить ректально, если у человека кишечная непроходимость.
. Фидаксомицин переносится так же, как ванкомицин, и может иметь более низкий риск рецидива. Было обнаружено, что фидаксомицин так же эффективен, как ванкомицин, у пациентов с легким или умеренным заболеванием, чем ванкомицин, у пациентов с тяжелым заболеванием. Фидаксомицин можно использовать у пациентов с рецидивирующими инфекциями, у которых нет механизмов на другие антибиотики. Метронидазол рекомендуется в качестве альтернативного лечения при инфекциях, вызванных C. difficile, когда у больного аллергия к лечению первой линии, не может их переносить или испытывает финансовые трудности, препятствующие доступу к ним. При фульминантном заболевании ванкомицин внутрь и метронидазол внутривенно обычно используются вместе.
Лекарства, использованные для замедления или остановки диареи, такие как лоперамид, как полагают, обладают надежными усугубить болезнь C. difficile, и они обычно не рекомендуются. Однако доказательства, подтверждающие худшие результаты при использовании, недостаточны. Холестирамин, ионообменная смола, эффективен в связывании токсинов A и B, замедлении перистальтики кишечника и предотвращении обезвоживания. Холестирамин рекомендуется с ванкомицином. Последним средством лечения лиц с ослабленным иммунитетом внутривенное введение иммуноглобулина. Моноклональные антитела против C. difficile, токсин А и С. difficile, токсин B одобрен для предотвращения рецидива инфекции C. difficile, включая безлотоксумаб.
Доказательств в поддержку использования пробиотиков для лечения активного заболевания недостаточно.
Пересадка фекальной микробиоты, также известная как пересадка стула, эффективна примерно от 85% до 90% у тех, для кого антибиотики не помогли. Он включает в себя вливание микробиоты, полученной из фекалий здорового донора, чтобы обратить вспять бактериальный дисбаланс, ответственный за рекурсивирующий характер инфекции. Процедура восстанавливает нормальную микробиоту толстой кишки, уничтоженную антибиотиками, и восстанавливает устойчивость к колонизации Clostridioides difficile. Побочных эффектов, по крайней мере, на начальном этапе, немного.
Некоторые доказательства выглядят обнадеживающими, что трансплантат фекалий может быть доставлен в виде таблеток. Они доступны в США, но не одобрены FDA по состоянию на 2015 год.
У пациентов с тяжелым колитом, вызванным C. difficile, колэктомия может улучшить результаты. Для определения того, кому операция принесет наибольшую пользу.
Рецидивирующая ИКД встречается у 20–30% пациентов, с частотой рецидивов с каждым последующим эпизодом. В клинических условиях практически невозможно отличить рецидив, развивающийся как рецидив ИКД с тем же штаммом C. difficile, от повторного инфицирования, который является результатом нового штамма.
Существует несколько вариантов лечения рецидивирующей инфекции C. difficile. В рекомендацию IDSA 2017 года для первого эпизода рецидивирующей инфекции C. difficile рекомендуется пероральный прием четыре раза в день в течение 10 дней, если метронидазол использовался для первоначального эпизода. Если пероральный ванкомицин применялся для начального эпизода, то длительная пульсовая доза перорального ванкомицина 125 мг четыре в день в течение 10-14 дней с последующим снижением дозы (два раза в день в течение одной недели, каждые два-три дня в течение 2- 8 недель.) Или фидаксомицин 200 мг два раза в день в течение 10 дней. Для второго рецидивирующего эпизода IDSA рекомендует варианты, включая вышеупомянутую пульсовую дозу перорального ванкомицина с последующим длительным снижением дозы; пероральный ванкомицин 125 мг четыре раза в день в течение 10 дней, а затем рифаксимин 400 мг три раза в день в течение 20 дней; фидаксомицин 200 мг два раза в день в течение 10 дней, или трансплантация фекальной микробиоты.
Для пациентов с инфекциями C. diff, которые не удается вылечить с помощью схем лечения антибиотиками, трансплантаты фекального микробиома имеют средний показатель излечения>90%. В обзоре 317 пациентов было показано, что это приводит к разрешению в 92% случаев стойких и рецидивирующих заболеваний. Понятно, что восстановление кишечной флоры имеет первостепенное значение в борьбе с рецидивирующей ИКД. С помощью эффективной антибактериальной терапии можно уменьшить количество C. difficile, и со временем может развиться естественная резистентность к колонизации по мере восстановления естественного микробного сообщества. До завершения этого процесса может произойти повторное заражение или рецидив. Пересадка фекальной микробиоты может ускорить это выздоровление, напрямую заменяя отсутствующих членов микробного сообщества. Однако фекалии человеческого происхождения трудно стандартизировать, включая передачу инфекционного материала чужеродным фекальным материалом. В результате необходимы дальнейшие исследования для изучения долгосрочных эффективных результатов FMT.
После первого лечения метронидазолом или ванкомицином C. difficile рецидивирует примерно у 20% людей. Это до увеличивается на 40% и 60% с последующими рецидивами.
С. difficile встречается у восьми из 100 000 человек. Среди тех, кто попадает в больницу, она встречается от четырех до восьми человек на 1000. В 2011 году это произошло примерно полумиллиону инфекций и 29 000 смертей в США.
Отчасти из-за появления фторхинолон-резистентного штамма, смертельные случаи, связанные с C. difficile, увеличился на 400% с 2000 по 2007 год в указанных Штатах. По данным CDC, «C. difficile является наиболее частой микробной инфекцией, связанной с оказанием медицинской помощи, в США и обходится до 4,8 миллиардов долларов в год в виде дополнительных затрат на лечение только для учреждений неотложной помощи ».
Иван К. Холл и Элизабет О'Тул впервые назвали бактерию Bacillus difficilis в 1935 году, выбрав ее специфический эпитет, потому что она была устойчива к ранним попыткам изоляции и очень медленно росла в культуре. Андре Ромен Впоследствии Прево перевел его в род Clostridium, который сделал его биномен Clostridium difficile. Позднее его комбинация была изменена на Clostridiodes difficile после переноса в новый род Clostridioides.
Псевдомембранозный колит впервые был описан как осложнение инфекции C. difficile в 1978 году, когда токсин был выделен у людей, страдающих псевдомембранозным колитом и Постулаты Коха были выполнены.
Название происходит от греческого klōstēr (κλωστήρ), «веретено», а конкретное название - от Латинское difficile, среднее единственное число от difficilis "трудный, упрямый", выбран в связи с привередлив при культивировании.
Что касается текущего происшествия, Clostridioides - это, а Clostridium - . Оба рода до сих пор имеют приписанные к ним виды. Согласно нормам биномиальной номенклатуры, бывшее биномиальное название этого вида теперь псевдонимом.
Что касается конкретного имени, традиционной нормой, отражающей то, как в медицинском английском обычно произносятся натурализованные новые латинские слова (что, в свою очередь, в степени соответствует традиционное английское произношение латинского ), хотя иногда используется и восстановленное произношение (класс латинское произношение реконструируется как ). Специфическое имя также обычно произносится, как если бы оно было французским, что с предписывающей точки зрения является «неправильным произношением», но с лингвистически описательной точкой зрения нельзя назвать ошибочной, потому что она так широко используется профессионалами здравоохранения; его можно охаракаракзовать как «рекомендательный вариант» для точки наиболее удобного использования Новой латыни в биномиальной номенклатуре, что также является допустимой точкой зрения, хотя специфические для Новой латыни содержат такой широкий спектр внелатинские корни (включая фамилии и шутливые) отсылки), все равно задействованы во внелатинском произношении (как видно, например, с Ba humbugi, Spongiforma squarepantsii и сотнями других).
| На Викискладе есть материалы, относящиеся к Clostridium difficile. |
| Классификация | D |
|---|---|
| Внешние ресурсы |