 Круглая хромосома, демонстрирующая двунаправленную репликацию ДНК, с двумя репликационными вилками, генерируемыми в «исходной точке». Каждая половина хромосомы, реплицируемая одной репликационной вилкой, называется «репликорой». (Графическое изображение Дэниела Юэна)
Круглая хромосома, демонстрирующая двунаправленную репликацию ДНК, с двумя репликационными вилками, генерируемыми в «исходной точке». Каждая половина хромосомы, реплицируемая одной репликационной вилкой, называется «репликорой». (Графическое изображение Дэниела Юэна) A круговая хромосома - хромосома в бактериях, архей, митохондриях и хлоропластах, в виде молекулы кольцевой ДНК, в отличие от линейной хромосомы большинства эукариот.
Большинство хромосом прокариотов содержат кольцевую молекулу ДНК - у ДНК. В противном случае свободные концы создавали бы серьезные проблемы для клеток в отношении репликации ДНК и стабильности. Клетки, которые действительно содержат хромосомы с концами ДНК или теломеры (большинство эукариот), приобрели сложные механизмы для преодоления этих проблем. Однако круглая хромосома может создавать другие проблемы для клеток. После репликации две кольцевые хромосомы потомства могут иногда оставаться взаимосвязанными или запутанными, и они должны быть разрешены так, чтобы каждая клетка унаследовала одну полную копию хромосомы во время деления клетки.
 Двунаправленная репликация в кольцевой хромосоме.
Двунаправленная репликация в кольцевой хромосоме. Репликация кольцевой хромосомы бактерий лучше всего изучены у хорошо изученных бактерий Escherichia coli и Bacillus subtilis. Репликация хромосомы происходит в три основных этапа: инициация, удлинение и завершение. Стадия инициации начинается с упорядоченной сборки «инициаторных» белков в исходной области хромосомы, называемой oriC. Эти этапы сборки регулируются, чтобы репликация хромосом происходила только один раз в каждом клеточном цикле. Во время фазы элонгации репликации ферменты, которые были собраны в oriC во время инициации, проходят вдоль каждого плеча («реплифора ») хромосомы в противоположных направлениях от oriC, реплицируясь. ДНК для создания двух идентичных копий. Этот процесс известен как двунаправленная репликация. Вся совокупность молекул, участвующих в репликации ДНК на каждом плече, называется «реплисомой ». На переднем крае реплисомы находится ДНК-геликаза, которая раскручивает две нити ДНК, создавая движущуюся «репликационную вилку ». Две развернутые одиночные цепи ДНК служат в качестве матриц для ДНК-полимеразы, которая перемещается вместе с геликазой (вместе с другими белками), чтобы синтезировать комплементарную копию каждой цепи. Таким образом создаются две идентичные копии исходной ДНК. В конце концов, две репликационные вилки, движущиеся по круговой хромосоме, встречаются в определенной зоне хромосомы, приблизительно противоположной oriC, называемой конечной областью. Затем ферменты элонгации разбираются, и две «дочерние» хромосомы разделяются до завершения деления клетки.
Ориджин бактериальной репликации E. coli, называемый oriC, состоит из последовательностей ДНК, которые распознаются белком DnaA, который высоко сохраняется среди различных бактериальных видов. Связывание DnaA с источником инициирует регулируемое рекрутирование других ферментов и белков, что в конечном итоге приведет к созданию двух полных реплисом для двунаправленной репликации.
Элементы последовательности ДНК в oriC, которые важны для его функция включает DnaA-боксы, 9-мерный повтор с высококонсервативной консенсусной последовательностью 5 '- TTATCCACA - 3', которые распознаются белком DnaA. Белок DnaA играет решающую роль в инициации репликации хромосомной ДНК. Связанная с АТФ и с помощью бактериальных гистон -подобных белков [HU] DnaA затем раскручивает AT-богатую область около левой границы oriC, которая несет три 13-мерных мотива, и открывает двухцепочечная ДНК для входа других белков репликации.
Эта область также содержит четыре последовательности «GATC», которые распознаются ДНК-аденинметилазой (Dam), фермент, который изменяет основание аденина, когда эта последовательность неметилирована или гемиметилирована. метилирование аденинов важно, поскольку оно изменяет конформацию ДНК, способствуя разделению цепей, и, похоже, эта область oriC имеет естественную тенденцию раскручиваться.
DnaA затем рекрутирует репликативную геликазу, DnaB из комплекса DnaB-DnaC в развернутую область для образования пре-праймингового комплекса. После того, как DnaB перемещается к вершине каждой репликационной вилки, геликаза как раскручивает родительскую ДНК, так и мгновенно взаимодействует с примазой.
. Для продолжения репликации ДНК необходимы одноцепочечные связывающие белки. предотвращать образование вторичных структур отдельными цепями ДНК и предотвращать их повторный отжиг. Кроме того, ДНК-гираза необходима для снятия топологического стресса, создаваемого действием геликазы DnaB.
Когда репликационная вилка перемещается по окружности, образуется структура в форме греческой буквы тета Ө. Джон Кэрнс продемонстрировал тета-структуру хромосомной репликации E. coli в 1963 году, используя инновационный метод визуализации репликации ДНК. В своем эксперименте он радиоактивно пометил хромосому, выращивая свои культуры в среде, содержащей 3H- тимидин. Основание нуклеозида было равномерно включено в бактериальную хромосому. Затем он изолировал хромосомы, осторожно лизируя клетки, и поместил их на сетку электронной микрофотографии (EM), которую он экспонировал на рентгеновской пленке в течение двух месяцев. Этот эксперимент четко демонстрирует модель тета-репликации кольцевых бактериальных хромосом.
Как описано выше, бактериальная хромосомная репликация происходит двунаправленным образом. Это было впервые продемонстрировано путем специфической маркировки реплицирующихся бактериальных хромосом радиоактивными изотопами. Затем участки ДНК, подвергающиеся репликации во время эксперимента, визуализировали с помощью авторадиографии и микроскопического исследования проявленной пленки. Это позволило исследователям увидеть, где происходит репликация. Первые убедительные наблюдения двунаправленной репликации были получены в результате исследований B. subtilis. Вскоре после этого было показано, что хромосома E. coli также двунаправленно реплицируется.
Холофермент ДНК-полимеразы III E.coli представляет собой комплекс 900 кДа, имеющий по существу димерную структуру. Каждая мономерная единица имеет каталитическое ядро, димеризационную субъединицу и компонент процессивности. ДНК Pol III использует один набор своих основных субъединиц для непрерывного синтеза ведущей цепи, в то время как другой набор ядерных субъединиц циклически перемещается от одного фрагмента Окадзаки к следующему на зацикленном отстающая нить. Синтез ведущей цепи начинается с синтеза короткого праймера РНК в начале репликации ферментом примазой (белок DnaG ).
Затем к этому праймеру добавляют дезоксинуклеотиды с помощью одного димера ДНК-полимеразы III в интегрированном комплексе с DnaB-геликазой. Затем синтез ведущей цепи продолжается непрерывно, в то время как ДНК одновременно разматывается на вилке репликации. Напротив, синтез отстающей цепи осуществляется короткими фрагментами Окадзаки. Во-первых, праймер РНК синтезируется примазой, и, как и при синтезе ведущей цепи, ДНК Pol III связывается с праймером РНК и добавляет дезоксирибонуклеотиды.
Когда синтез фрагмента Окадзаки завершен, репликация останавливается и субъединицы ядра ДНК Pol III диссоциируют от β-скользящего зажима [скользящий хлопок B - это субъединица процессивности ДНК Pol III]. Праймер РНК удаляется и заменяется ДНК на ДНК-полимеразу I [которая также обладает активностью проверочного считывания экзонуклеаз ], а оставшийся разрыв закрывается ДНК-лигазой, которая затем лигирует эти фрагменты с образованием отстающей нити.
Существенная часть (10-15%) репликационных вилок, происходящих в oriC, сталкивается с повреждением ДНК или разрывом цепи при выращивании клеток в нормальных лабораторных условиях (без обработки экзогенным повреждением ДНК). Выявленные повреждения ДНК обычно обрабатываются рекомбинационными ферментами репарации, чтобы обеспечить продолжение развития репликационной вилки.
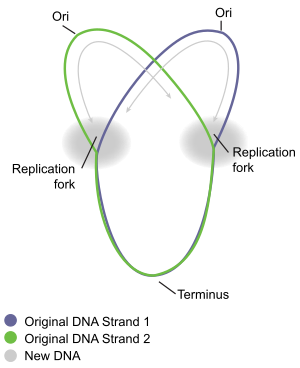
 Большинство кольцевых бактериальных хромосом реплицируются двунаправленно, начиная с одной точки происхождения и реплицируются в двух направлениях от начала координат. Это приводит к полуконсервативной репликации, при которой каждая новая идентичная молекула ДНК содержит одну матричную цепь исходной молекулы, показанную сплошными линиями, и одну новую цепь, показанную пунктирными линиями.
Большинство кольцевых бактериальных хромосом реплицируются двунаправленно, начиная с одной точки происхождения и реплицируются в двух направлениях от начала координат. Это приводит к полуконсервативной репликации, при которой каждая новая идентичная молекула ДНК содержит одну матричную цепь исходной молекулы, показанную сплошными линиями, и одну новую цепь, показанную пунктирными линиями. Терминация - это процесс слияния репликации вилки и разборка реплисом с образованием двух отдельных и полных молекул ДНК. Это происходит в области конца, примерно напротив oriC на хромосоме (рис. 5). Конечная область содержит несколько участков терминатора репликации ДНК или "Ter" сайтов. Специальный белок «терминатор репликации» должен быть связан на сайте Ter, чтобы он приостановил репликацию. Каждый сайт Ter имеет полярность действия, то есть он будет блокировать вилку репликации, приближающуюся к сайту Ter с одного направления, но позволит беспрепятственное движение вилки через сайт Ter с другого направления. Расположение участков Тер формирует две противоположные группы, которые заставляют две развилки встречаться друг с другом в пределах области, которую они охватывают. Такое расположение называется «ловушкой репликационной вилки».
Ter-сайты специфически взаимодействуют с белком-терминатором репликации, называемым Tus в E. coli. Комплекс Tus-Ter препятствует активности раскручивания ДНК DnaB в зависимости от ориентации.
Репликация ДНК, разделяющая противоположные репликационные вилки, оставляет завершенные хромосомы соединенными как «катенаны » или топологически взаимосвязанные круги. Круги не связаны ковалентно, но их нельзя разделить, потому что они переплетены, и каждый из них ковалентно замкнут. Связанные круги требуют действия топоизомеразы для разделения кругов [декатанация]. В E.coli ДНК-топоизомераза IV играет основную роль в разделении связанных хромосом, временно разрывая обе нити ДНК одной хромосомы и позволяя другой хромосоме пройти через разрыв.
Существовала некоторая путаница в отношении роли ДНК-гиразы в декатенации. Чтобы определить номенклатуру, существует два типа топоизомераз: тип I вызывает временные однонитевые разрывы в ДНК, а тип II дает временные двухцепочечные разрывы. В результате фермент типа I удаляет суперспирали из ДНК по одной, тогда как фермент типа II удаляет две суперспирали за раз. Топо I как прокариот, так и эукариот представляет собой топоизомеразу типа I. Эукариотический топо II, бактериальная гираза и бактериальный топо IV относятся к типу II.
Мы часто забываем, что ДНК-гираза действительно обладает активностью топоизомеразы типа II; таким образом, поскольку он является гомологом топоизомеразы IV (также обладающим активностью топоизомеразы II), мы ожидаем сходства в функциях двух белков. Предварительная роль ДНК-гиразы состоит в том, чтобы ввести отрицательные суперспирали в ДНК, тем самым расслабляя положительные суперспирали, которые вступают в игру во время репликации ДНК. Топоизомераза IV также расслабляет положительные суперспирали, поэтому ДНК-гираза и топоизомераза IV играют почти одинаковую роль в удалении положительных суперспиралей перед транслоцирующей ДНК-полимеразой, позволяя репликации ДНК продолжаться без препятствий топологической деформации. в некоторой научной литературе утверждается, что ДНК-гираза является единственным ферментом, ответственным за декатанацию. В эксперименте, проведенном Zechiedrich, Khodursky и Cozzarelli в 1997 году, было обнаружено, что топоизомераза IV является единственной важной декатеназой промежуточных продуктов репликации ДНК у бактерий. В этом конкретном эксперименте, когда ингибировалась только ДНК-гираза, большинство катенанов не были связаны. Однако, когда ингибировалась только топоизомераза IV, декатенация почти полностью блокировалась. Полученные результаты позволяют предположить, что топоизомераза IV является первичной декатеназой in vivo, и хотя ДНК-гираза действительно играет роль в декатенации, ее функция не так важна, как топоизомераза IV, в декатентации взаимосвязанных хромосом.
Это основано на статье Ималды Девапаранам и Дэвида Трайба, предоставленной в соответствии с условиями лицензирования CC by SA в рамках университетских курсов на факультете микробиологии и иммунологии Мельбурнского университета, 2007.
В эту статью включены материалы из статьи Citizendium «Репликация кольцевой бактериальной хромосомы », которая находится под лицензией Creative Commons Attribution-ShareAlike 3.0 Непортированная лицензия, но не в рамках GFDL.