 Листья меняют цвет осенью, потому что их хромофоры (хлорофилл молекулы) разрушаются и перестают поглощать красный и синий свет.
Листья меняют цвет осенью, потому что их хромофоры (хлорофилл молекулы) разрушаются и перестают поглощать красный и синий свет. A хромофор - это часть молекулы, отвечающая за его цвет. Цвет, который видят наши глаза, не поглощается в пределах определенного длины волны спектра видимого света. Хромофор - это область в молекуле, где разность энергий между двумя отдельными молекулярными орбиталями попадает в диапазон видимого спектра. Таким образом, видимый свет, попадающий на хромофор, может быть поглощен путем возбуждения электрона из его основного состояния в возбужденное состояние. В биологических молекулах, которые служат для захвата или детектирования световой энергии, хромофор представляет собой фрагмент , который вызывает конформационное изменение молекулы при попадании света.
 Здоровые растения воспринимаются как зеленые, потому что хлорофилл поглощает в основном синюю и красную длины волн и отражает зеленый цвет.
Здоровые растения воспринимаются как зеленые, потому что хлорофилл поглощает в основном синюю и красную длины волн и отражает зеленый цвет.  Одиннадцать сопряженных двойных связей, образующих хромофор молекулы β-каротина, выделены в красный.
Одиннадцать сопряженных двойных связей, образующих хромофор молекулы β-каротина, выделены в красный.  Фрагменты порфирина в наших красных кровяных тельцах, основная функция которых заключается в связывании атомов железа, которые захватывают кислород, приводят к гем хромофоры, придающие крови человека красный цвет. Гем расщепляется организмом на биливердин (который придает брускам сине-зеленый цвет), который, в свою очередь, разлагается на билирубин (который вызывает у пациентов желтуху желтый оттенок кожи).
Фрагменты порфирина в наших красных кровяных тельцах, основная функция которых заключается в связывании атомов железа, которые захватывают кислород, приводят к гем хромофоры, придающие крови человека красный цвет. Гем расщепляется организмом на биливердин (который придает брускам сине-зеленый цвет), который, в свою очередь, разлагается на билирубин (который вызывает у пациентов желтуху желтый оттенок кожи).  В человеческом глазу молекула сетчатки представляет собой конъюгированный хромофор . Сетчатка начинается с конформации 11-цис-сетчатки, которая после захвата фотона γ (света) правильной длины волны распрямляется в конформацию полностью трансретиналь. Это изменение конформации отталкивается от белка опсин в сетчатке, который запускает каскад химических сигналов, который может привести к восприятию света или изображений человеческим мозгом.
В человеческом глазу молекула сетчатки представляет собой конъюгированный хромофор . Сетчатка начинается с конформации 11-цис-сетчатки, которая после захвата фотона γ (света) правильной длины волны распрямляется в конформацию полностью трансретиналь. Это изменение конформации отталкивается от белка опсин в сетчатке, который запускает каскад химических сигналов, который может привести к восприятию света или изображений человеческим мозгом. Подобно тому, как две соседние p-орбитали в молекуле образуют пи-связь, три или более соседних p-орбитали в молекуле могут образовывать сопряженную пи-систему. В сопряженной пи-системе электроны могут захватывать определенные фотоны, поскольку электроны резонируют на определенном расстоянии p-орбиталей - аналогично тому, как радиоантенна обнаруживает фотоны по всей своей длине. Как правило, чем более сопряжена (длиннее) пи-система, тем больше длина волны фотона может быть захвачена. Другими словами, с каждой добавленной смежной двойной связью, которую мы видим на диаграмме молекулы, мы можем предсказать, что система будет все больше казаться желтой для наших глаз, поскольку она с меньшей вероятностью будет поглощать желтый свет и с большей вероятностью будет поглощать красный свет. («Конъюгированные системы из менее чем восьми конъюгированных двойных связей поглощают только в ультрафиолетовой области и бесцветны для человеческого глаза», «Соединения синего или зеленого цвета обычно не зависят только от конъюгированных двойных связей».)
В сопряженных хромофорах электроны прыгают между энергетическими уровнями, которые являются расширенными пи-орбиталями, созданными серией чередующихся одинарных и двойных связей, часто в ароматических системах. Общие примеры включают сетчатку (используется в глазу для обнаружения света), различные пищевые красители, красители для тканей (азосоединения ), индикаторы pH, ликопин, β-каротин и антоцианы. Различные факторы в структуре хромофора определяют, в какой области длин волн в спектре хромофор будет поглощать. Удлинение или удлинение сопряженной системы за счет большего количества ненасыщенных (кратных) связей в молекуле будет иметь тенденцию сдвигать поглощение в сторону более длинных волн. Правила Вудворда – Физера могут использоваться для аппроксимации длины волны видимого максимума поглощения в ультрафиолетовом диапазоне в органических соединениях с сопряженными системами пи-связей.
Некоторые из этих хромофоров представляют собой комплексные металлы, которые содержат металл в координационном комплексе с лигандами. Примерами являются хлорофилл, который используется растениями для фотосинтеза, и гемоглобин, переносчик кислорода в крови позвоночных животных. В этих двух примерах металл образует комплекс в центре кольца тетрапиррола макроцикла : металл представляет собой железо в гемовой группе (железо в порфириновое кольцо) гемоглобина или магния, образующего комплекс с кольцом типа хлорина в случае хлорофилла. Сильно сопряженная пи-связующая система кольца макроцикла поглощает видимый свет. Природа центрального металла также может влиять на спектр поглощения комплекса металл-макроцикл или на такие свойства, как время жизни в возбужденном состоянии. Тетрапиррольный фрагмент в органических соединениях, который не является макроциклическим, но все же имеет сопряженную систему пи-связей, все еще действует как хромофор. Примеры таких соединений включают билирубин и уробилин, которые имеют желтый цвет.
ауксохром представляет собой функциональную группу атомов, прикрепленных к хромофору, которая изменяет способность хромофора поглощать свет, изменяя длину волны или интенсивность поглощения..
Галохромизм возникает, когда вещество меняет цвет при изменении pH. Это свойство индикаторов pH, молекулярная структура которых изменяется при определенных изменениях окружающего pH. Это изменение структуры влияет на хромофор в молекуле индикатора pH. Например, фенолфталеин представляет собой индикатор pH, структура которого изменяется при изменении pH, как показано в следующей таблице:
| Структура | 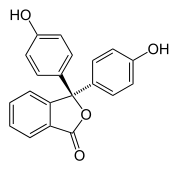 |  |
|---|---|---|
| pH | 0-8.2 | 8.2-12 |
| Условия | кислая или близкая к нейтральной | основная |
| Название цвета | бесцветная | от розового до фуксия |
| Цвет |
В диапазоне pH около 0-8 молекула имеет три ароматических кольца, все связанные с тетраэдрическим spгибридизованным атом углерода в середине, который не вызывает конъюгирования π-связи в ароматических кольцах. Из-за своей ограниченной протяженности ароматические кольца поглощают свет только в ультрафиолетовой области, поэтому соединение кажется бесцветным в диапазоне pH 0-8. Однако, когда pH увеличивается выше 8,2, этот центральный углерод становится частью двойной связи, становясь sp-гибридизированным и оставляя p-орбиталь, чтобы перекрываться с π-связью в кольцах. Это заставляет три кольца соединяться вместе, образуя удлиненный хромофор, поглощающий более длинноволновый видимый свет, чтобы показать цвет фуксии. В диапазоне pH за пределами 0–12 другие изменения молекулярной структуры приводят к другим изменениям цвета; см. Фенолфталеин подробнее.
| Функциональная группа или соединение | Длина волны поглощения |
|---|---|
| Бромфеноловый синий (желтая форма) | 591 нм |
.